2022年10月
群馬腎薬「CKD患者さんの療養指導」 Q&A
10月18日に開催された群馬腎薬「CKD患者さんの療養指導~透析導入を減らすための薬剤師からの処方提案~」では質疑応答の時間が取れなかったために、ブログ上で質問に答えさせていただきます。
Q.急性腎不全患者で入院した患者の内服薬について。薬の用量の考え方が難しいです。3剤ほど減量の提案をしたのですが「元々の腎機能は正常な患者なので問題ありません」との回答でした。
A.急性腎不全というのは急性腎障害(AKI)の中でも重篤なものとして考えると、急性腎不全時によって腎機能が急激に低下して一時無尿になったとしても、血清クレアチニン(Cr)値はすぐに下がってくれないことがあるため、急性腎不全時発症直後の腎機能の評価はむつかしいです。通常は血清Cr値によるeGFRでは腎機能が過小評価されますので、腎排泄性薬物の過剰投与が危惧されます(図)。
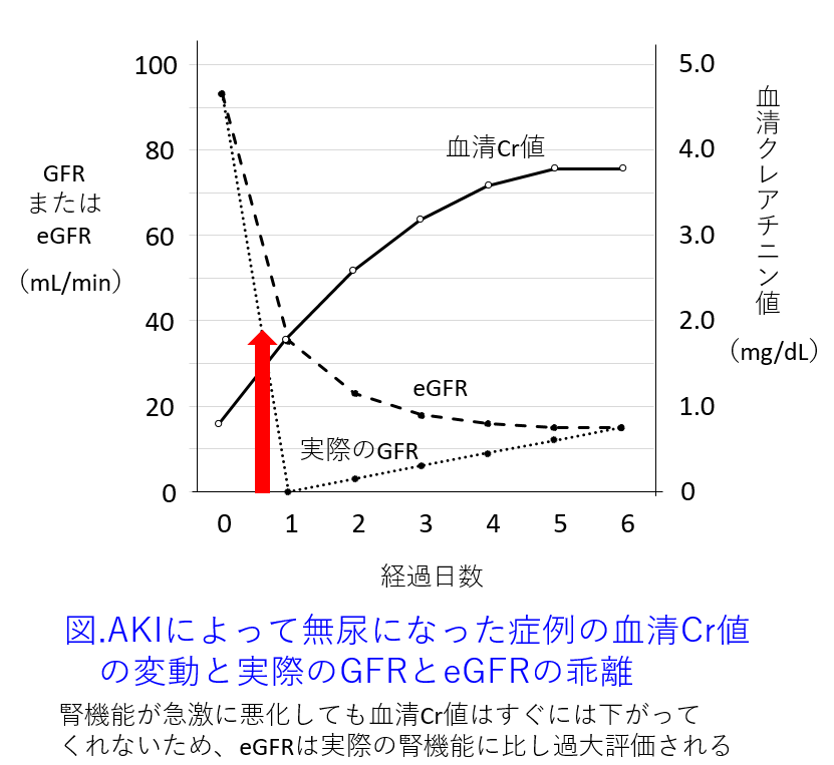
ただし脱水などによっておこる軽度の腎障害の場合、医師の判断では急性腎障害になったけれど回復しつつあるという判断をされたのかもしれません。たとえば、いつものCCrは50以上だったけど、今回だけ、明らかな脱水によるAKIで一時的にCCr<30になっただけなのに「メトホルミンは禁忌ですので中止してください」という疑義照会をしたら、医師から怒られたという話をよく聞きます。病態を十分、観察して検査値の動きを把握しておけばこのようなことは起こらないですね。
例えばSGLT2阻害薬を投与されている患者の腎機能が今回だけ下がっても、副作用が起こるわけではなく「効きにくくなる可能性がある」だけですから、疑義照会は熟慮してやりましょう。CCr<30で禁忌の薬があった時、29になったという1回の検査値のみで疑義照会をする「デジタル薬剤師」にならないよう注意したいものです。
Q.血圧を下げすぎるとeGFRが下がるとのことですが、降圧薬の服用をしていない低血圧の体質のCKD患者さんは血圧を100/50くらいにあげた方がいいのでしょうか。
A.血圧を下げすぎると当たり前にeGFRが下がるのではなく、正確にはSPRINT studyで収縮期血圧を120mmmHg以下に下げた群でeGFRが低下した症例が有意に多かったということです。血圧を下げすぎるとみんなeGFRが下がるわけではありません。
高血圧を放置すると腎硬化症によって高齢者になると腎機能が悪化することはふつうにあります。ただしこの状況を通り過ぎて、さらに高齢になると心機能が低下して血圧を上げることができなくなって腎血流が低下します。心腎連関といいますね。このような状態であれば動脈硬化は進行していて収縮期血圧は高いものの、拡張期血圧が低い、つまり脈圧が大きくなります。収縮期血圧が高いので、血圧を下げたいのですが、拡張期血圧が低すぎて降圧薬を使いにくくなります。
低血圧は低血圧症状のある人に対しては治療が必要ですが、無症状の人であれば治療する必要はありません。駆出率の低い心不全になったために血圧が下がった(血圧を上げる力がなくなった)症例に、RAS阻害薬やβ遮断薬を投与すべきかとなると、非常に悩ましいと思います。循環器医のご判断にお任せするしかないと思います。
Q.アセトアミノフェン750〜1000mg/回を推奨というお話がありましたが、これは体重50kg程度として考えてよろしいでしょうか。
A.体重50kg以上として考えてください。80歳以上の高齢女性で35kgなんて症例では500mgでも十分だと思います。
Q.心不全治療でfantastic fourとして注目されているARNIですが、RAS阻害薬に比較して腎障害作用が少ないとの一部データもあるようです。平田先生の見解はいかがでしょうか。
A.ARNIに関しては今のところ心不全に対する報告のみで、そのサブ解析でARNIのCKD予防作用はSGLT2阻害薬単独よりも明らかになっています血清クレアチニンの0.3 mg/dLを超える増加(AKI)および/またはeGFRの25%以上の低下,ESRDの発症,または腎死の複合アウトカムではARNIはRAS阻害薬群に比し、有意に優れていました(RR 0.84; 95% CI 0.72-0.96, p = 0.01;図)。
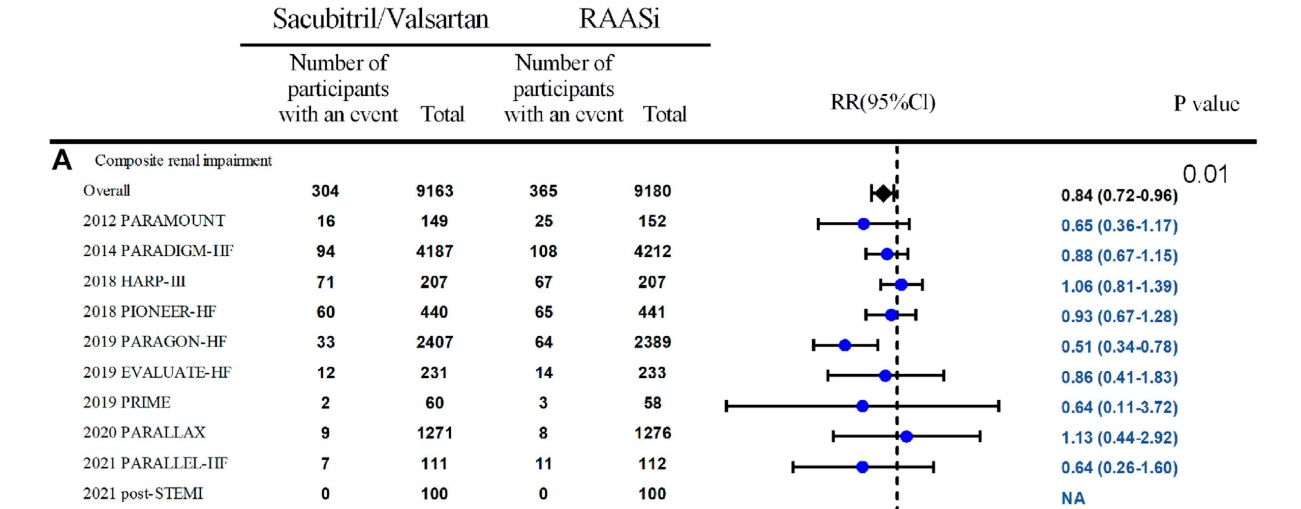
しかし降圧作用がARNI>RAS阻害薬だし、ARNIはANPやBNPを産生させるため利尿作用も強いことから、AKIには要注意かもしれません。上記のデータはあくまで複合アウトカムですので。カリウムの上昇はRAS阻害薬よりもやや軽度みたいです。
引用文献: Xu Y,et al. Front Pharmacol 2021 Nov 19;12:604017.
Q.トリプルワーミーを見た瞬間に疑義紹介するべきですか?
A.弱った高齢者のトリプルワーミー処方に関しては疑義照会すべきです。ただし、ちゃんと理論武装して、資料を見せて、医師に納得してもらわないと、その後のトリプルワーミー処方の減少にはつながらないと思います。ぼくが保険薬局薬剤師だったら電話で疑義紹介した後、論文を持参して医師とディスカッションしに行きます。
Q.米国と日本のCVDリスクと透析導入の差については医療制度の違いなどが影響しているのでしょうか?
A.アジア人はインスリン分泌量が少ないので、太りにくい。そして米国での食事摂取量や摂取カロリー量ははとても多いので肥満患者が非常に多いです。米国では心筋梗塞・心不全による死亡ががんよりも高いのは肥満が最も心血管病変リスクになっているためと思っています。貧しい人ほど安価なファストフードを食べざるを得ないので貧困者の方が肥満になりやすく、貧しいがゆえに保険を持っていない事によって心血管病変を起こしても十分なケアができないこともその理由だと思います。米国の医療レベルは非常に高いものの、先進国の中で皆保険制度がない国は米国だけといわれていますので、米国人のCVDリスクが高いのはおっしゃる通り医療制度も関与していると思われます。
Q.エンパグリフロジン開始初期はeGFR低下前か低下後、どちらの値で腎機能評価を行うほうが良いのでしょうか?
A.SGLT2阻害薬の投与によって腎機能は少しだけ低下しますが(効きすぎると腎機能が悪くなりすぎて投与しにくい人もいますが・・・)、過大評価も過小評価もされていないのですから低下後、その時の腎機能をそのまま用いるべきだと思います。
Q.腎保護作用についてはナトリウム利尿との認識でしたが、スライドの中でATPの消費量が影響しているのでしょうか?
A.最近の研究でSGLT2阻害薬のNa利尿は初期だけで、持続しないと言われています。おそらく腎でのNaを調整する機構が関わってSGLT2阻害薬によるNa利尿を調整しているのだと思います。ただし尿細管上皮細胞内のNa過剰は確実に起きていますので、SGLT2阻害薬による近位尿細管上皮細胞内でのNaポンプを回すためのATPの消費量軽減は、弱った腎臓を休ませてくれる可能性は大いにあると思っています。
Q.トリプルワーミーの論文間でリスク比がだいぶ違うのですが、その理由はどのようなことでしょうか?
A.トリプルワーミーの論文間で使っているNSAIDs、利尿薬、RAS阻害薬がみんなばらばらだからオッズ比に差があるのは当然です。NSAIDsだけでもセレコキシブのように腎機能に影響が少なく、心血管病変を起こしにくいものもありますが、ピロキシカムやメロキシカムのように半減期の長いオキシカム系は一般的に腎障害も胃障害も強いです。利尿薬だってサイアザイド系とループ利尿薬では利尿作用ははるかにループ利尿薬で強いですから、差が出て当然でしょう。また対象患者が日本人のように高齢者がほとんど、しかも後期高齢者が多いとなるとオッズ比は高くなりますから、対象患者の年齢や人種が異なることによって結果が異なることも考えられます。
SGLT2阻害薬のように併用によって急性腎障害が少なくなったという報告は前向きの大規模RCTのメタ解析によるものですから、リスク比・ハザード比がより均一なデータとして表れますが、トリプルワーミーの報告は薬剤師による後ろ向きの報告も多く、前向きの大規模RCTはほとんどないと思います。
Q.エンレストのバルサルタンの作用と抗利尿効果にNSAIDsを併用することはTriple Whammyとなるとお考えでしょうか。
A.エンレストもRAS阻害作用を持つので狭義のRAS阻害薬と考えていいと思います。それにNa利尿ペプチドの作用増強が加わりますので、降圧作用・利尿作用はRAS阻害薬より強く、カリウム上昇はRAS阻害薬よりも弱いです。となると脱水・降圧による腎機能悪化には気を付けるべきなので、Triple Whammyのリスクがあると今のところは考えています。ただしARNIはGFRを上げて腎保護作用を示すことからSGLT2阻害薬のようにAKIを予防する効果が出てくるかもしれませんが・・・・・。
Q.循環器疾患においてPCI後など低用量アスピリンを使用することが多く、RAS阻害薬が推奨されたりARNIが使用されるようになっております。その場合、心不全患者では既にダブルワーミーとなる場合が多くあると思います。やはりそういった患者様も腎障害リスクは高くなるのでしょうか?
A.心筋梗塞後で梗塞部位の大きければ心不全は必発です。心不全ではRAS阻害薬またはARNIの投与が必須になります。PCI後は低用量アスピリンを含めた2剤の抗血小板薬の併用は12か月は必要です。低用量アスピリンが腎機能を悪化させるかどうかは不明ですが、心不全の自覚症状が強くなれば利尿薬が必要になりますので、これらの薬物療法のそれぞれが腎障害リスクを上げる可能性があります。また心腎連関によって心不全自体が腎機能を悪化させます。
第18回 基礎から学ぶ薬剤師塾 Q&A
第 18回 基礎から学ぶ薬剤師塾 Q&A
広げてみようTDMの世界
~薬剤師が主役になれる薬物療法~
講演中にいただいた質問
沼津市立病院 平野雄一先生
Q1.腎機能が分からないときにシスタチン Cの依頼をしますが、返ってくるのが遅いです。その間のバンコマイシンの投与はどうすればよいのでしょうか?
A.おそらく腎機能低下患者にバンコマイシンを投与して数回目のトラフ値を測定していると思いますが、「測定したトラフ値が高いということは投与量が多すぎた=腎機能を高く見積もりすぎた」ということを表します。どの程度高かったかによって腎機能の見積もりの甘さを推測できます。バンコマイシンは尿中排泄率90%の薬ですので、腎機能の不明なときに投与するのは怖いことですが、逆にバンコマイシンの血中濃度測定によって、ある程度の腎機能をつかむことができます。多くの場合、高齢で栄養状態不良で活動度の低い患者さんがMRSA感染症に罹患しやすいのですが、このような症例では筋肉量が少ないために血清Cr値が低いので推算腎機能が高く見積もられるために用量過多になることが多いと思います。24時間畜尿による実測CCr(×0.715でGFRとして利用可能)またはシスタチンCによるeGFRの絶対値が分かれば、その後は血清Cr値が上昇しつつあるのか、低下しつつあるのかによって腎機能を追うことができます。
Q2.当院でのTDMの実施はバンコマイシンだけで終わっているが、次にやるとすれば何がおすすめですか?
A.バンコマイシンのTDMをやっているのであれば、抗菌薬のTDMを極めることから始めてはいかがでしょうか。テイコプラニン、アルベカシン、アミノグリコシド系抗菌薬、それに加えてボリコナゾールのTDMも開始すれば、院内でICTやAMT(抗菌薬適正使用推進チーム)で活躍できると思います。
ちなみに私の場合、1994年に100床以下の病院でも病棟での服薬指導業務を開始できるようになってから、通常のTDM対象薬の抗菌薬、ジゴキシン、テオフィリン、抗不整脈薬、抗てんかん薬、シクロスポリンに加えてアセタゾラミド、アシクロビルなどのTDM対象薬以外もHPLCを用いて測定することで、数か月で20種類近くのTDMを一挙に開始しました。薬剤科の人数は4~5人なのでHPLCを使用する薬物は担当性、つまりアシクロビルの依頼が来れば私が、ジソピラミドなどの抗不整脈薬の依頼が来ればAさんが研究室で前処理をして、検体をHPLCのある薬剤科に持って帰って分析していました。薬物動態的な解析(透析患者がほとんどなので解析ソフトはありません)をしたうえでのコメント記載は病棟でその患者さんの服薬指導担当者が記入することとし、最終的には私が内容をチェックしてからA4サイズの測定コメント付きの結果をカルテに貼付していました。つまり全員でTDMを担当していました。
TDMを開始する以前は仕事が終わってから午後6時くらいになって、ようやく研究(透析患者の中分子尿毒素、カテコラミン濃度の経時的変化、セレンなどの微量元素に関する研究)を開始できましたが、それはとても辛かったのです。でも透析患者のTDM自体が珍しかったこともあり、「原著論文が通常業務の一環として書ける」ということはとてもおいしいことだと思いました。
講演中にいただいたチャットでの質問
たかだ調剤薬局 永石潤先生
Q.TDM対象の薬剤の副作用の確認は行っていますが、先生はその他に薬局薬剤師に望むことはありますか?
A.クリニックの門前でも薬物濃度を測定することがあるはずです。ワルファリンだってINRを測定して、相互作用などによって異常値になることがよくあると思います(INRによるワルファリンの投与設計も広義のTDMといえます)。ジゴキシン、テオフィリンが当たり前に投与されていた1990年代には薬局薬剤師がTDMの解析をしていますという学会発表もありました。
例えば糸球体腎炎でシクロスポリンやタクロリムスの投与をしたり、抗てんかん薬を投与して血中濃度を測定することはクリニックでもあることだと思います。でもシクロスポリン濃度がいつもは100~200ng/mLだったのが800ng/mLになっていたらドクターは怖くなって投与中止してしまうかもしれません。実は単にトラフ値ではなく飲んだ直後のα相の採血だったというようなシンプルな間違いだと思いますが、薬物動態や相互作用に強くないドクターではやりがちなことです。だからクリニックでのTDMの解析やワルファリンの適正使用のお手伝いを申し出てはいかがでしょうか?
抗てんかん薬などもいのですが、くれぐれも濃度が低いだけで患者さんの病態を見ずに増量を申し出ないでください。抗てんかん薬の有効治療域には個人差がありますし、前回の薬剤師塾「薬物動態」で説明したように蛋白結合率低下によって、総クリアランスが低下するため、総濃度は低下しますが遊離型濃度は不変なことが多いので薬効は変化しないのです。患者さんを十分見ないで「血中濃度を直す」ことをTDMとは言いません。Therapeutic drug assayに過ぎません。Therapeutic drug monitoringによって患者さんの病態を観察して「患者さんを治す」ためにやっているのが本来のTDMですから。
国保多古中央病院 木内陽子先生
Q.全く基本的な質問ですが、トラフ採血を次回投与前の時間で代用してはいけないでしょうか。
A.トラフ値は、通常、次回投与直前の採血が望ましいとされています。一番低い濃度、つまりトラフ(谷底の意味)値ですから。
飯塚病院 田先由佳先生
Q.ガイドラインの改訂でCKDでのテイコプラニンの使用が増えそうな気がしました。あまり使用経験がないものの安全なイメージなのですが、副作用などのモニタリングのポイントはありますか?
A.僕もテイコプラニンのどの副作用をマークすべきなのかよくわからないくらい安全なイメージを持っています。だから副作用として聴覚障害や肝障害や腎障害など言われていますし国家試験にも出題されていますが、これらの経験をされた医師・薬剤師は非常に少ないと思います。蛋白結合率90%ですが、低アルブミン血症や尿毒症では蛋白結合率が低下し、遊離型のクリアランスが増大して総濃度は低下します。このことについての詳細はテイコプラニンが6種類の混合物であるため不明ですが、これによる増量によって起こった有害反応の例をあまり聞かないので、やはり安全性の高い薬物と考えてよさそうです。
ポイントは半減期が長いので初回負荷投与を躊躇しないことだと思います。新しいガイドライン2022でも腎機能に関わらず初日10~12mg/kgを2回、2日目10~12mg/kgを2回、3日目10~12mg/kgを1回で初回負荷投与をやっているって、初日からなんで1回2000mg程度の負荷投与をしないんだろうと思っています(平田の個人的な感想です)。初日の1回10~12mg/kgでは初日から有効濃度になるとは思えません。感染症は急性疾患ですから初日から効果を示さず、2~3日目から有効濃度になるようなやり方は、いい加減のやめてもらいたいと思います(これも平田の個人的な感想です)。
それからバンコマイシンによる腎障害が心配な症例、心内膜炎,骨関節感染症などの炎複雑性感染症では,目標トラフ値20~40 µg/mL(通常は15~30)を考慮します。バンコマイシン、テイコプラニン無効な症例ではリネゾリドやダプトマイシンなどをうまく使い分けてください。
講演後のアンケートでいただいた質問
熊本赤十字病院薬剤部 古庄 弘和先生
Q.90歳35㎏のサルコペニア高齢者にVCMを投与した症例において、シスタチンCの測定を考慮するとありましたが、私自身はどのような状況であれ、あまりシスタチンCの測定自体を医師に提案したことがありません。シスタチンCは保険診療請求で3月に1回しか測定できなかったり、外注で制約が多かったりするためです。腎機能が悪くなってしまった状態や、AKI発生により腎機能が変動している段階での測定では意義も低いように感じます。
サルコペニア高齢者であってもVCM開始のタイミングで測定を提案するには抵抗があり、シスタチンCはどういった患者にどのタイミングで測定を提案するべきでしょうか?
A.サルコペニア患者では血清Cr値による腎機能の絶対値は全く役に立ちません。だから実測CCrの測定か、それが無理ならシスタチンCの測定を、私は推奨しています。でも実際には沼津市立病院の平野先生への Q1 の回答と同じく、「測定したトラフ値が高いということは投与量が多すぎた=腎機能を高く見積もりすぎた」ということを表します。どの程度高かったかによって腎機能の見積もることができますので、これで十分対応できるように思います。
何もないときにシスタチンCの測定依頼をすることはあり得ないので、どのタイミングかといえば、VCM投与開始時になると思います。AKI発症により腎機能が変動している段階での測定ではシスタチンCの測定意義が低いのはおっしゃる通りです。古庄先生が医師にシスタチンC測定依頼を躊躇されるのはなぜ?僕はおそらく「シスタチンCってなに?」という医師がほとんどだからじゃないかと思います。腎臓内科医はもちろん測定経験がありますが、泌尿器科の先生はシスタチンCをもちろん知っていますが、測った経験者は非常にまれで、他科の先生はほとんどが「シスタチンCってなに?」という先生がほとんどだと思いますから。それでも何例かでも測定していただくことができれば、シスタチンCによるeGFRと血清Cr値によるeGFRあるいは推算CCr×0.789によるeGFRの乖離を体感できると思います(でもこのような場合、一番信頼できる腎機能マーカーは実測CCrだと思っています)。
バンコマイシンを投与する対象は多くの場合、高齢で栄養状態不良で活動度の低い患者さんがMRSA感染症に罹患しやすいので、このようなときに薬剤師がもっと医師にシスタチンCの測定を当たり前に依頼するようになれば、3か月に1回のみという制限も撤廃され、検査費用も1回1000円以上という価格も安くなるのではと思うのは私だけでしょうか。
松戸市立総合医療センター 井上大樹先生
Q.いつも大変貴重なご講演ありがとうございます。講演の中で、バンコマイシンやアミノグリコシドのピーク値採血のタイミングのお話がありましたが、病態や腎機能障害の有無、投与方法などにより分布相の延長や短縮などが発現する場合はございますでしょうか。ご教授いただけますと幸いです。
A.アミノグリコシド系抗菌薬の分布は細胞外液のみですので、末梢の毛細血管から間質液の移行にはほとんど個人差はないように思います。浮腫があると分布容積は増大しますが、ほぼ瞬時平衡に近いと思いますので分布相の時間の個人差はほとんどないでしょう。
バンコマイシンでは静注投与後の分布は各臓器によってさまざま濃度が異なりますから、病態や体格の個人差はありえると思いますが、具体的にそれらについて論じた報告はないと思います。「vancomycin×prolonged distribution time」で一応PubMed検索してみましたら何と21論文がヒットしましたが、決定的な論文は見つかりませんでした。
ただしUpToDateではバンコマイシンの分布容積に関しては「Adults: 0.4 to 1 L/kg (ASHP/IDSA/SIDP [Rybak 2009]); 0.3 to 0.5 L/kg in patients who are morbidly obese (Adane 2015; Bauer 1998; Hong 2015).」と記載されており、肥満患者ではVdが非常に小さいそうです。同じくUpToDateによるとピーク値測定について以下の記載がありました。「点滴終了後1~2時間を分布後のピーク濃度(Cmax)としているものの、定常状態に近い投与間隔での分布後ピーク濃度が望ましい」という記載は前半部分(赤字)と後半部分の内容(緑字)が著しく矛盾していますね。
UpToDateのTiming of serum samplesでの記載
投与1~2時間後に測定した分布後ピーク濃度(Cmax)と投与間隔の終了時に測定したトラフ濃度(Cmin)の2つの血清濃度の収集が必要である。定常状態に近い投与間隔での分布後ピーク濃度及びトラフ濃度を用いることが望ましい(可能であれば)。ベイズ法による AUC モニタリングでは、定常状態の血清濃度を必要としない(ASHP/IDSA/PIDS/SIDP [Rybak 2020] )。
≪ 2022.10.08 ≫ I&H平田塾「基礎から学ぶ心房細動治療薬と症例」での質問
Q.どの不整脈薬がどのタイプの不整脈に効果的という考え方がよく分かりません。1b群の抗不整脈薬が上室性の頻脈に効かない理由について心房筋の活動電位持続時間は短い為、APDを短くする1b群は効かないと聞いた事がありますがこの理解で合っていますか?
A.Vaughan-Williams分類Ⅰb群の中でもアプリンジンは上室性不整脈に効きますが、リドカイン、メキシレチンは心室性不整脈のみにしか効きません。その理由はおっしゃる通り「心房と心室ではAPDが異なり心房で短いためリドカイン、メキシレチンが心房のNaチャネルと結合できる時間は限られているので、不活性化状態にある時間が短い心房筋では効きにくい」で合っています(私も詳しくないです。ごめんなさい)。
心筋梗塞後の心室性不整脈患者にⅠc群の抗不整脈薬を投与すると不整脈に起因する心停止やすべての心停止がプラセボ群に比し有意に高かったという1991年のCAST study以降、循環器医による抗不整脈薬の投与は少なくなりました。致死的な心室性不整脈(心室細動、心室性頻拍、低心機能または肥大型心筋症に伴う心房細動)にアミオダロンなどを使わざるを得ないようなケースなど、極めて危険な不整脈にまれに処方することはありますが、危険な不整脈に関しては薬物療法以外のデバイスが進歩していますので、近年、循環器医が抗不整脈薬を投与することは多くはありません。ということで私自身は「薬剤師が不整脈という幅広い病態をすべて理解する必要はないけど、心房細動は心原性脳塞栓、心不全への移行が非常に怖いのでよく理解しておこう。あとはQT延長を起こす抗不整脈薬(ベプリジル、Ⅰa群、Ⅲ群のすべて)、WPW症候群による心房細動でレートコントロール薬の投与は心室細動に移行するため投与してはいけないなど、薬剤師が知っておくべきポイントをつかんでおけばいい」と大学での薬物治療学の講義で教えてきました。
平田への講演依頼に関しましては平田のメールアドレス
hirata@kumamoto-u.ac.jp までお気軽にご連絡ください。
第19回 薬剤師塾 開催案内
第19回 基礎から学ぶ薬剤師塾 2022年11月12日(土)13:30から15:30まで の申し込みを始めます。
登録していただいた方には再放送を繰り返し視聴できるようになりました。ただし、再放送は質疑応答のQ&Aはありません。今回のテーマは「腎機能悪化を防ぐこれからのtriple therapy~SGLT2阻害薬、ARNI、MRAの適正使用について考える~」です。
SGLT2阻害薬の腎保護作用、心保護作用は皆さんご存知の通り。でもこれに加えてARNIのサクビトリル/バルサルタン、MRAのフィネレノンはCKD腎機能悪化を防ぐtriple therapy(三種の神器と呼ぶ方もありますね)として欧米の腎関係学会で話題沸騰中です。これにβ遮断薬を加えるとfantastic fourという駆出率の低下した心不全治療の決め手となります。残念ながらわが国では今のところCKD患者への適応はないのですが、かなり近い将来、triple therapyは透析導入を減らすための重要な切り札になると平田は考えています。
今回はやはりSGLT2阻害薬が中心ではありますが、ARNI、MRAの情報も先取りしちゃいましょう。SGLT2阻害薬が腎保護に効く究極のメカニズムって何なの?併用したら薬剤性腎障害が心配じゃない?MRAの併用で高カリウム血症は怖くないの?どんな副作用が起こりやすいの?副作用を防ぐための薬剤師の服薬指導は?など、様々な疑問について考えてみたいと思います。
参加を希望される方は 申し込みフォーム に記入のうえ、送信してください。
薬剤師塾となっていますが、医師・看護師など医療従事者であれば参加可能です。ただし薬剤師塾への参加者は、ぜひ学会発表を目指している方に参加していただきたいと思います。そしてその先には原著論文を書くんだという大きな夢を持つ人になっていただきたいと思います。300名まで参加可能ですが、最近の登録者数は200名を超えていますので、早めに登録してください。

