薬についての真面目な話
臨床で使用可能な薬物除去率予測式 Murakami&Hirata式について
はじめに
透析除去率の計算式、Murakami&Hirata式なるものを何の前触れもなく、2021年の初めに本ホームページに掲載しましたが、その紹介する文章が遅れて申し訳ありません。この式は、生体内の薬物量が1回の血液透析で何%除去されるかを正確に(今のところ)予測することができる式です。ようやく臨床使用に耐える予測式が完成し、Blood Purification誌に掲載されましたので、急ぎ、にホームページに掲載しましたが、それまでのいきさつ、薬物の透析性についてまとめてみました。
薬物の透析性
透析で除去されやすい薬は透析後に補充投与しないと効かなくなる。例えばアミノグリコシド系の抗菌薬は細胞外液のみに分布し、アルブミンなどの蛋白質にほとんど結合しないため、透析で半分以上が除去されてしまう。当然、濃度依存性の抗菌作用を示すこの抗菌薬の殺菌力は期待できなくなってしまうであろう。βラクタム系抗菌薬も細胞外液のみに分布するが、蛋白結合率(PBR)は薬によってさまざまだ。汎用されているカルバペネム系抗菌薬のメロペネムのPBRは5%足らずで、アミノグリコシド系と同様なので、半分以上は透析で抜ける。ただし第3世代セフェムのセフトリアキソンやセフォペラゾンのPBRは90%なので、ほぼ除去できないので透析後の追加投与は必要ない。グリコペプチド系のテイコプラニンのPBRは90%と高いだけではなく、分子量が1,564~1,894Da(6種の薬物の混合物である)と大きいため、主に拡散の原理によって生体内物質を除去する血液透析では全く除去できない。
薬物の透析性予測式なんて、必要ないと思っている方もいるかもしれないが、体中から抜けた薬物を抜けた分だけ補充する必要があるとすれば、「抜けやすい」「抜けにくい」だけではなく明確に何%抜けるという精度の高い予測式があれば、それは有用なものになるであろう。たとえば抗がん薬を透析患者に投与された報告は極めて乏しい。投与量も論文によって実にさまざまだ。そして透析による除去について体系的に言及された論文はさらに少ない、というかほとんどない。抗がん薬の場合、効きすぎれば、当然、有害反応が起こるであろうし、効かなければがんの悪化によって生死を分けるかもしれないのに、透析によってどれくらい除去されるかどうかについて分かっているものは、シスプラチンなど特殊な抗がん薬を除いてほとんどないのが現実だ。
米国では麻薬の濫用が大きな問題になっており、オピオイドの透析性についてはかなり探求されている。横紋筋融解症やQT延長といった重篤な副作用の多いメサドンに関しては、PBRが89.4%で分布容積(Vd)が1~8L/kgであることから、動態的に見て透析では抜けないことは明らかである(後述)。透析で抜けないという報告が古くからすでに複数あり1)2)、最近の報告ではメサドンの1日投与量の2.3%(範囲、1,25-3,70%)であったという報告3)や古い報告でも1%しか抜けないという報告4)があるにもかかわらず、メサドン専用の透析性の予測式を作ったという報告もあるが5)、ほとんど臨床的な価値はないと思う。
個々の薬物の透析性は論文になりやすいのだ。例えばAという新薬の透析性については検討がされていなければ、動態的には除去されないことが分かり切っていたとしても、医師が査読をすると「新規性がある」とみなされ、容易にアクセプトされる。そしてCHDならノイエス、CHDFの報告は初だからノイエス、CHFでもノイエス、CVVHDFでもノイエスとみなされアクセプトされる。もっとひどい文献だと、知りうる限り最大の分布容積の薬物「アミオダロンによる透析性」についての英語論文の査読を依頼されたことがあるが、本来、筆者は教育的な配慮からrejectしない方針であるが、さすがにこれは「透析で全く除去されないことは動態的に明らかなことなのに、数名の透析患者で頻回採血を行って透析性を調べた」ことは倫理的に間違っているということでrejectしたことがある。このように薬物個々の報告、様々な血液浄化法での報告もまた、あまたとあるが、このような報告を待たなくても、あるいは文献を検索しなくても、1つの予測性の高い式ができれば、有用なことは間違いないのだが、これに関する報告は極めて少ないのが現実なのだ。
薬物の透析性に関わる因子
1983年にKellerら6)がPBR, 分布容積の逆数(1/Vd), 分子量を基に薬物の透析性の予測式を作成したが、R2=0.27と低く、臨床では全く使えないものであった。ただしこの報告により薬物の透析性に関わる因子はPBRと分子量以外にも、Vdが重要であることが明らかにされた。
Vdは薬物の組織移行性を表す指標で、前述のようにアミノグリコシド系の抗菌薬やβラクタム系抗菌薬は親水性であるため細胞膜の脂質二重層を通過できないので細胞外液のみに分布する。細胞外液が体重の20%であるためこれらの薬物のVdは0.2~0.3L/kg(重症感染症では炎症によってアルブミンが間質液に漏出するため0.3L/kg近くになる)となるが、PBRが90%のセフォペラゾン、セフトリアキソンはアルブミンにトラップされているため、間質液内濃度は血清濃度の1/10になるので、Vdは0.2L/kg以下になる(図1)。 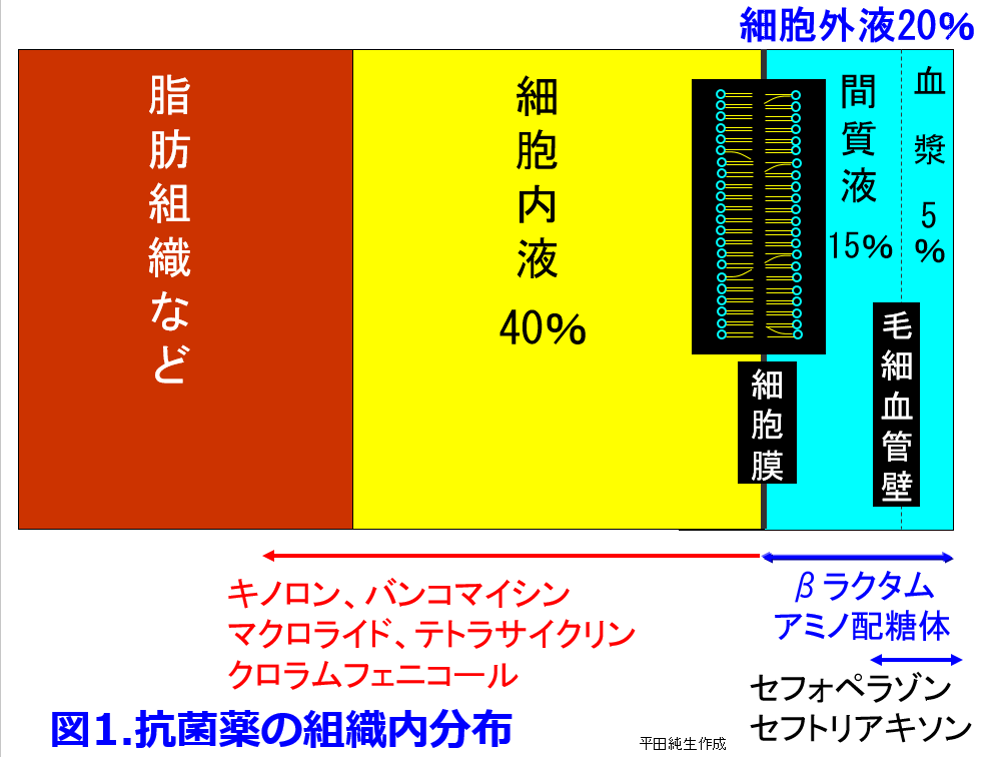
尿素、炭酸リチウム、エタノールなどは分子量が100Da以下の水溶性物質であるため、脂質二重層の細孔を自由に行き来できるため(図2)、細胞内液・細胞外液に均等に分布する。 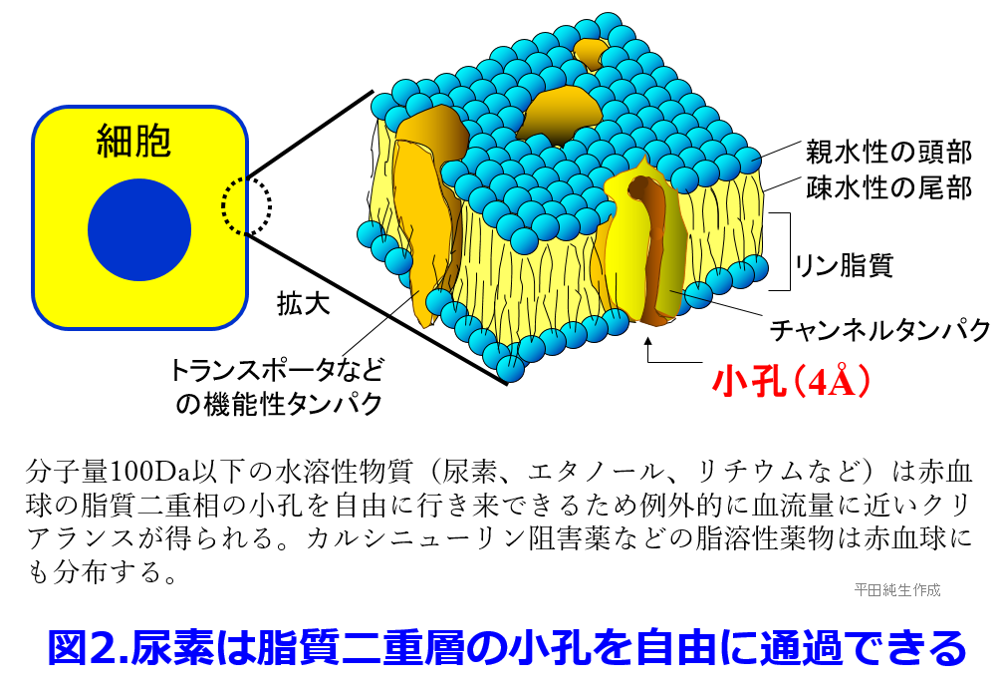 そのためこれらのVdは体内水分量に等しい0.6L/kgになり、これらの物質は分子量が小さいため拡散性能が極めて高く、血漿中だけでなく赤血球中からも除去可能である。
そのためこれらのVdは体内水分量に等しい0.6L/kgになり、これらの物質は分子量が小さいため拡散性能が極めて高く、血漿中だけでなく赤血球中からも除去可能である。
では強心配糖体のジゴキシンはどうだろうか?ジゴキシンはNa+-K+-ATPase阻害薬であるためこの酵素が多く存在する心筋や骨格筋に高濃度で分布し、心筋では血清濃度の30~70倍、骨格筋には10~20倍の高濃度で分布するため、血清濃度は相対的に低くなる。Vd=体内薬物量/血清薬物濃度で表されるため、ジゴキシンのVdは4~8L/kgと高い。血清及び間質液、つまり細胞外液を中心に浄化している血液透析だが、ジゴキシンは体内総量の4%しか細胞外液には存在しない(図3)。 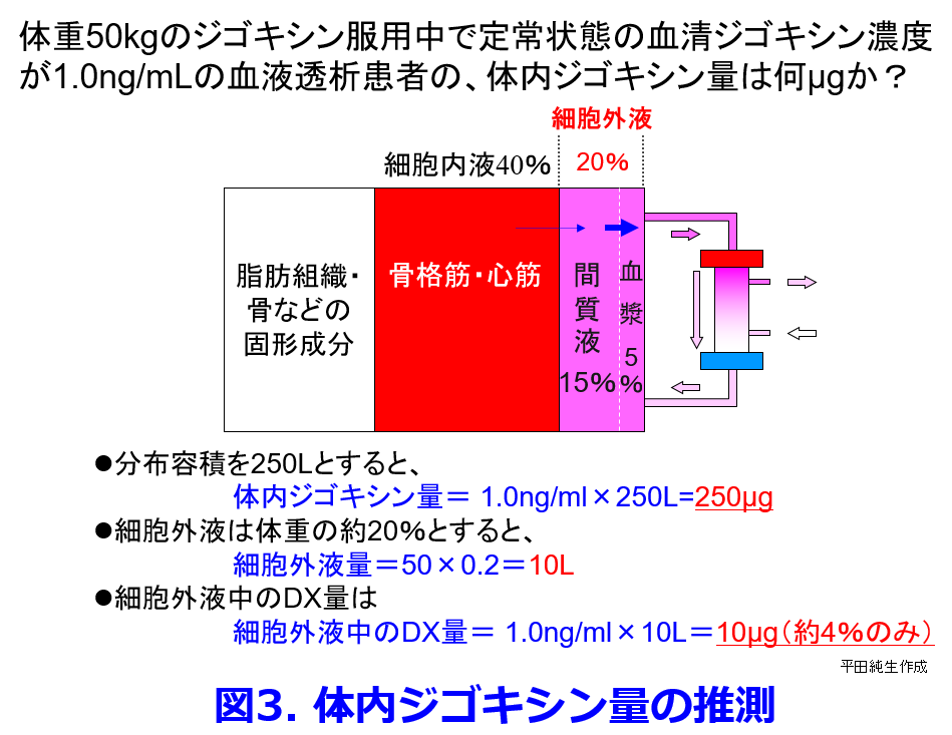 また組織から細胞外液へのジゴキシンの移行速度が透析による除去速度に比し極めて遅いため、Vdの大きいジゴキシンは透析では除去不可能だ。PBRが高くても活性炭による血液吸着や血漿交換によって除去可能であるが、Vdが大きい薬物は透析だけでなく、いかなる血液浄化法によっても除去されにくいのである。
また組織から細胞外液へのジゴキシンの移行速度が透析による除去速度に比し極めて遅いため、Vdの大きいジゴキシンは透析では除去不可能だ。PBRが高くても活性炭による血液吸着や血漿交換によって除去可能であるが、Vdが大きい薬物は透析だけでなく、いかなる血液浄化法によっても除去されにくいのである。
ただしVdが小さいと透析で除去されやすいかというと、そうではない。例えば動物実験で血漿量を測定するために用いられるアゾ染料のエバンスブルー(医療用ではない)は血漿中でアルブミンとの親和性が極めて高いためPBRが100%なので、Vdは0.05L/kgとVdの最小の薬物だし、分子量がアルブミンよりもはるかに大きい抗体製剤も0.05L/kgとVdは最小だが、透析で抜けるわけがない。ワルファリンのPBRは99%以上であるため、Vdは0.15L/kgと細胞外液量よりも小さい。NSAIDsのPBRは90%以上のものが多いが、イブプロフェン、ジクロフェナク、ナプロキセンのPBRは99%でVdは0.10~0.17L/kgとワルファリンとよく似ているが、PBR 93.1%のスリンダクのVdは2L/kgと大きい。Vdが小さくてもPBRが90%以上であれば透析によって全く抜けることはない。
血液透析で除去されにくい薬物
1997年に筆者は血液透析で除去されにくい薬物の共通点はPBRの高い薬物、脂溶性の高い薬物、腎排泄性の低い薬物、Vdが大きい薬物、分子量の大きい薬物であると推測した7)。さらに2004年に筆者は血液透析による除去率とVdの関係は図4に示すように双曲線を描くため8)、 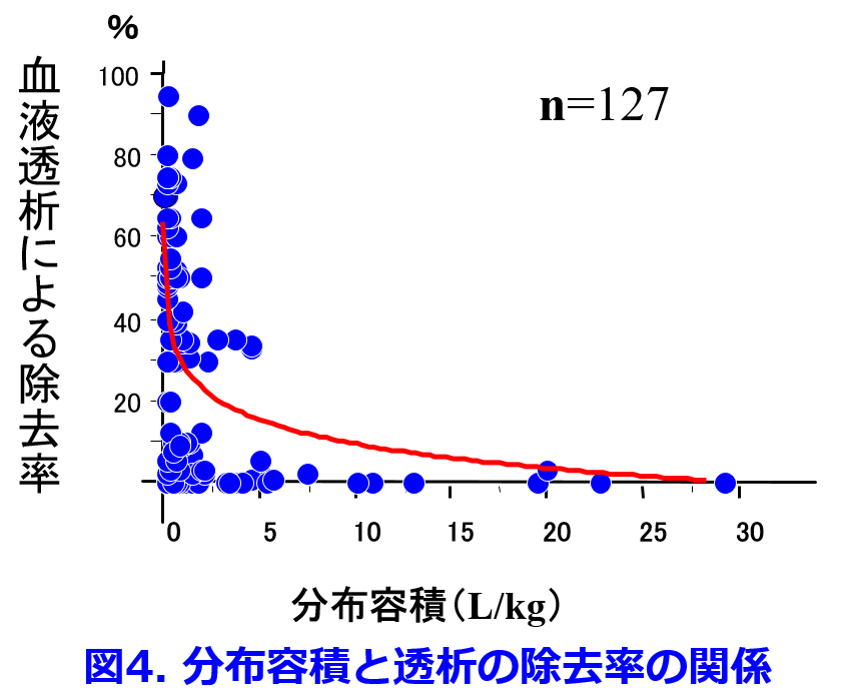 直線回帰では1/Vdの方が相関性は高くなるというKellerら6)の報告を再確認できた。そのうえで、
直線回帰では1/Vdの方が相関性は高くなるというKellerら6)の報告を再確認できた。そのうえで、
①PBR>90%以上の薬物は血液透析によって除去されない(図5)
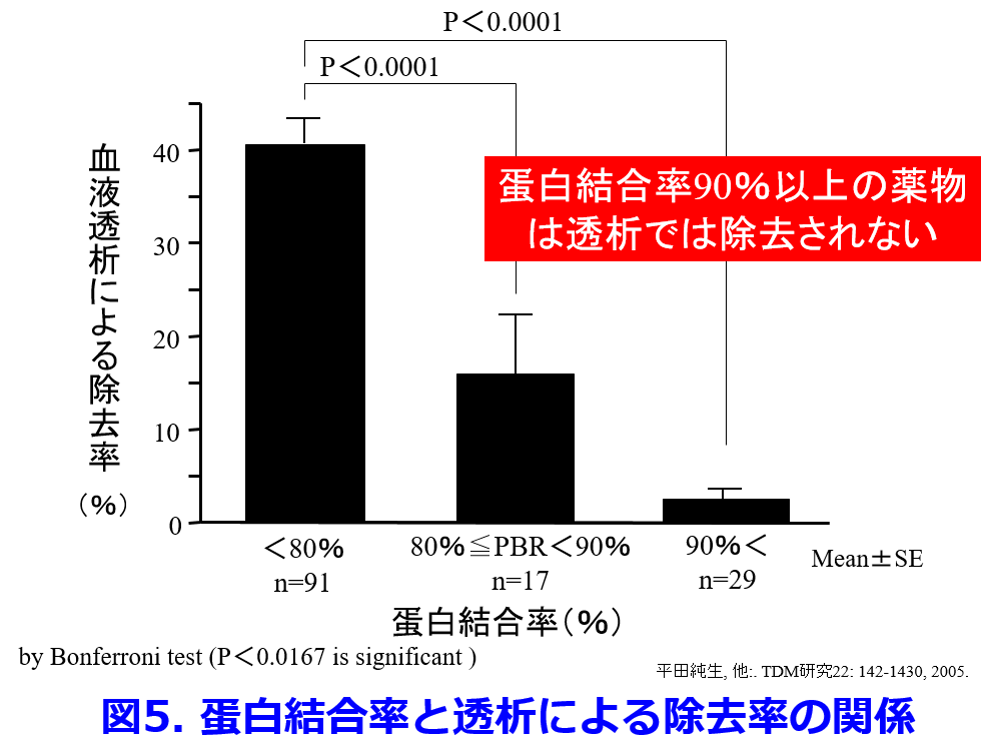 ②Vd>2.0L/kgの薬物は除去されにくい(図6)
②Vd>2.0L/kgの薬物は除去されにくい(図6)
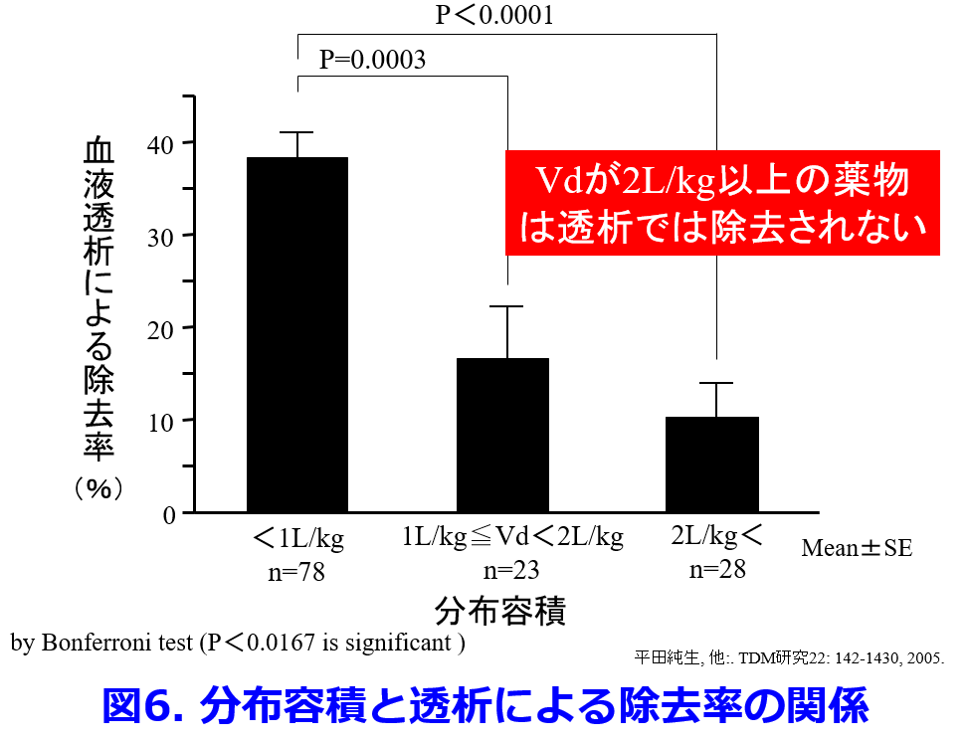 ③PBR>80%かつVd>1.0L/kgの薬物は除去されにくい(図7)
③PBR>80%かつVd>1.0L/kgの薬物は除去されにくい(図7)
ことを明らかにした9)。 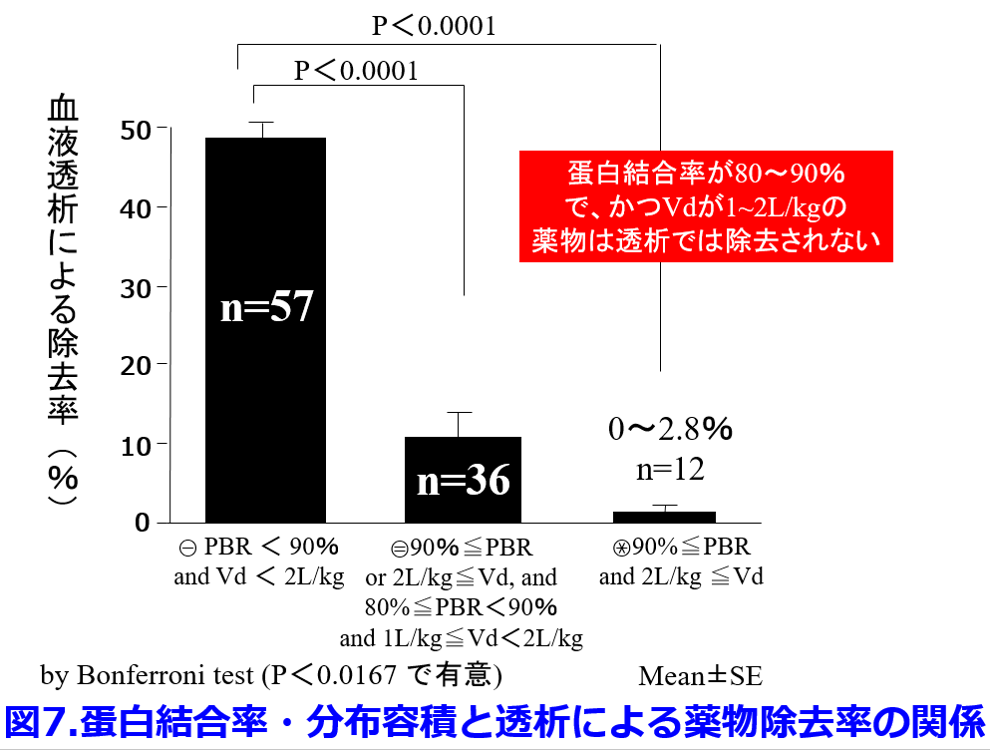
重回帰分析を行うとPBR、1/Vdは薬物の透析性に関与する有意な因子になったが、分子量は有意な因子ではなかった(表1)8)。 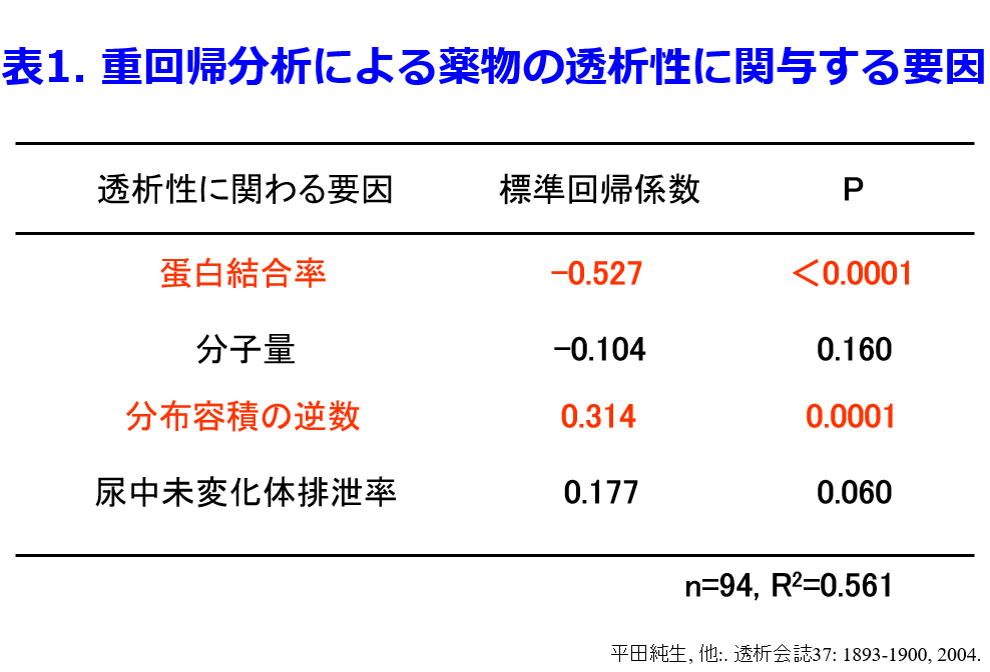 分子量と除去率の間に相関性は認められなかったものの(図8)、分子量の大きい薬物(MW>2,000)は拡散能が低いため除去されにくく、アルブミン以上の分子量の薬物(MW>66,000)は全く除去されないことは予測できた。
分子量と除去率の間に相関性は認められなかったものの(図8)、分子量の大きい薬物(MW>2,000)は拡散能が低いため除去されにくく、アルブミン以上の分子量の薬物(MW>66,000)は全く除去されないことは予測できた。 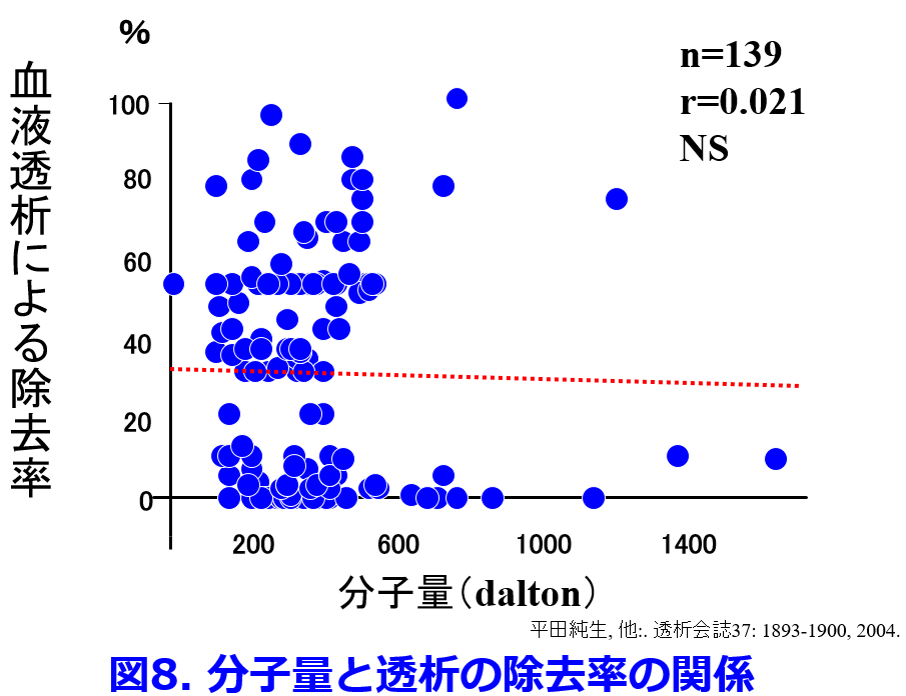 これらの取り組みによって透析によって抜けるか抜けないかを定性的に示すことはできるようになったが、透析による薬物除去率が何%で、透析後に薬物をどれだけ追加すべきかを推算する式、つまり定量的に推算できる薬物除去率推算式については、その後の浦田元樹博士、村上鞠奈氏の貢献が大きいが、その予測式の構築はややこしい話になるので、ここでは省略する。知りたい方は文献を読んでいただきたい10)11)。
これらの取り組みによって透析によって抜けるか抜けないかを定性的に示すことはできるようになったが、透析による薬物除去率が何%で、透析後に薬物をどれだけ追加すべきかを推算する式、つまり定量的に推算できる薬物除去率推算式については、その後の浦田元樹博士、村上鞠奈氏の貢献が大きいが、その予測式の構築はややこしい話になるので、ここでは省略する。知りたい方は文献を読んでいただきたい10)11)。
村上&平田式の予測性
薬物の特性を以下の特徴的な6つのカテゴリーに分類し、予測式に用いなかった薬物を主に用いてMH式による予測性を再確認した(図9)。  ①分子量100Da未満の水溶性物質は極めて除去されやすい、②PBRが低く水溶性の薬物で細胞外液のみに分布する薬物の除去率はとても高い、③水溶性の薬物で細胞外液のみに分布する薬物の除去率はPBRに依存して変化する、④Vdが小さいもののPBRが95%以上の脂溶性薬物は除去されない、⑤分子量が数万Da以上のものおよびPBR 100%の薬物は除去されない、⑥Vdが5L/kg以上の脂溶性薬物は除去されない。それぞれのカテゴリーに合致した特徴的な薬物でMW、PBR、fe、Vdの4つのパラメータが既知の薬物を2~3個ずつ、ランダムに示した。実測値と予測値の間にはy=1.009x-2.113でR2=0.924, P<0.0001の有意な正相関が認められた。
①分子量100Da未満の水溶性物質は極めて除去されやすい、②PBRが低く水溶性の薬物で細胞外液のみに分布する薬物の除去率はとても高い、③水溶性の薬物で細胞外液のみに分布する薬物の除去率はPBRに依存して変化する、④Vdが小さいもののPBRが95%以上の脂溶性薬物は除去されない、⑤分子量が数万Da以上のものおよびPBR 100%の薬物は除去されない、⑥Vdが5L/kg以上の脂溶性薬物は除去されない。それぞれのカテゴリーに合致した特徴的な薬物でMW、PBR、fe、Vdの4つのパラメータが既知の薬物を2~3個ずつ、ランダムに示した。実測値と予測値の間にはy=1.009x-2.113でR2=0.924, P<0.0001の有意な正相関が認められた。
Kellerら6)の予測式はR2=0.27、平田は定性的にHDで除去されない基準を作成した9)。そして浦田氏の簡易式の予測性はR2=0.64になり10)、MH式でR2=0.81に向上し11)、臨床使用可能な高い予測性を示すことができるようになった(図10)。

透析による薬物除去率予測式をどのように活用するか?
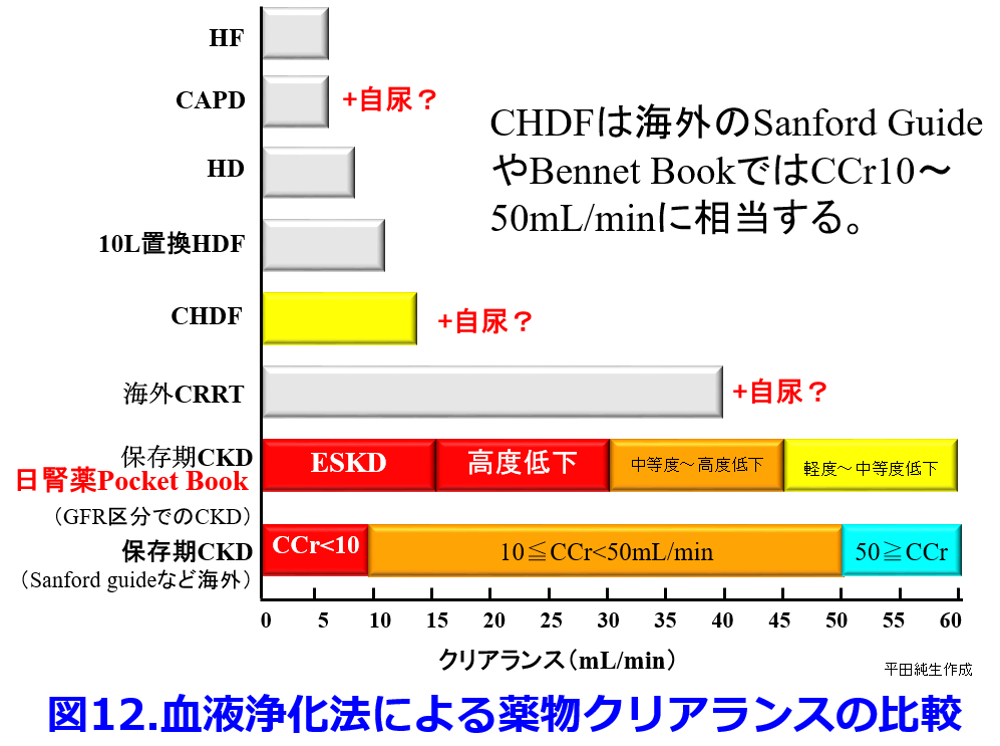
2020年9月に神戸国際会議場で開催された第66回化学療法学会学術大会のハイブリッド形式でのシンポジウムでは「SARS-COV-2感染症でCHDFを施行している患者にはアビガン?を多めに投与しているが、どれくらい量を投与したらよいかわからない」ということが話題になったが、MH式を使用する際に必要なVdが「0.34L/kg未満」となっているが、その値を代入すると透析による除去率は「少なくとも32.5%」と推算され(図11)、 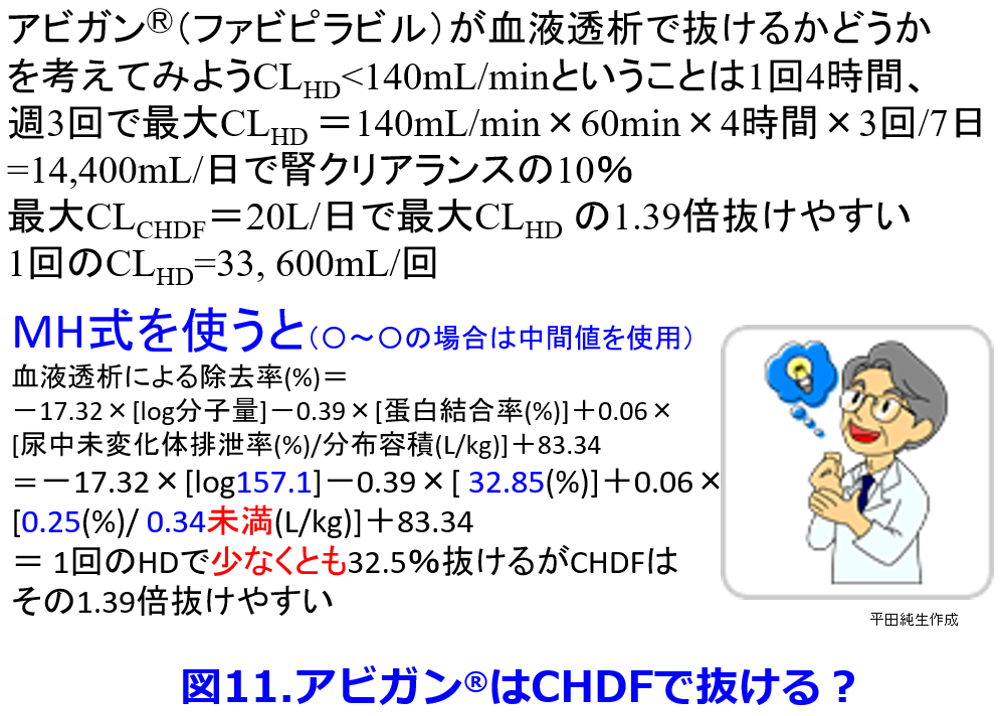 透析とCHDFのクリアランスを比べるとクレアチニンに関しては、透析療法は週に3回、1回4時間だが常時行われると仮定すると5~10mL/min、CHDFで13~14mL/min(尿量があればさらにクリアランスが高くなる)なので、CHDF患者では透析患者よりも多めに投与する必要があることが分かる(図12)。
透析とCHDFのクリアランスを比べるとクレアチニンに関しては、透析療法は週に3回、1回4時間だが常時行われると仮定すると5~10mL/min、CHDFで13~14mL/min(尿量があればさらにクリアランスが高くなる)なので、CHDF患者では透析患者よりも多めに投与する必要があることが分かる(図12)。
引用文献
1)Furlan V, et al: Methadone is poorly removed by haemodialysis. Nephrol Dial Transplant 14: 254-255, 1999
2)Perlman R, et al: Intradialytic clearance of opioids: methadone versus hydromorphone. Pain 154: 2794-2800, 2013
3)Opdal MS, et al: Effects of Hemodialysis on Methadone Pharmacokinetics and QTc. Clin Ther 37: 1594-1599, 2015
4)Kreek MJ, et al: Methadone use in patients with chronic renal disease. Drug Alcohol Depend 5: 197-205, 1980
5) Linares OA, et al: In silico ordinary differential equation/partial differential equation hemodialysis model estimates methadone removal during dialysis. Daly AL. J Pain Res. 8: 417-429, 2015
6) Keller F, Wilms H, Schultze G, Offerman G, Molzahn M: Effect of plasma protein binding, volume of distribution and molecular weight on the fraction of drugs eliminated by hemodialysis. Clin Nephrol 19: 201-205, 1983
7) 平田純生, 金 昌雄, 上野和行, 田中一彦: 薬物の透析性. TDM研究, 14: 277-287, 1997
8) 平田純生, 和泉 智, 古久保拓, 太田美由希, 藤田みのり, 山川智之: 血液透析による薬物除去率に影響する要因. 透析会誌37: 1893-1900, 2004
9) 平田純生, 和泉 智, 古久保拓, 太田美由希, 藤田みのり, 山川智之: 血液透析による薬物除去率に影響する要因. TDM研究22: 142-1430, 2005
10) Urata M, Narita Y, Fukunaga M, Kadowaki D, Hirata S: A simple formula for predicting drug removal rates during hemodialysis. Ther Apher Dial 22: 485-493, 2018
11) Murakami M, Narita Y, Urata M, Ichigi M, Nakatani S, Fukunaga F, Kondo Y, Ishitsuka Y, Irie T, Kadowaki D, Hirata S: Revised Formula for Predicting Hemodialyzability of intravenous and oral drugs. Bllod Purif 9: 1-11, 2021
腸内細菌叢の改善は腎機能悪化を防ぐ
腎機能をよくするための薬に食塩やNSAID?
腎機能は基本的に良くはならない。腎臓の糸球体の一部は再生できないからだ。ただし見かけの腎血流を一時的に高めれてやれば腎機能は改善したように見える。例えば終戦直後には腎機能をよくするためにその当時の医師は食塩摂取を勧めたそうだ。これによって循環血漿量が増え(腎臓への負荷をかけて)、糸球体内圧が上がってGFRが上がる。それによって一時的に血清クレアチニン値が下がれば、腎機能がよくなったように見えるのだ。ただし食塩摂取は長い目で見て血圧が上がり腎臓への負担を上げて、長い目で見ると腎機能は悪くなるだけでなく、高血圧を助長して心血管病、特に脳出血を増やすことはよく知られている。
これは良かれと思って慢性心不全にカテコラミンなどのβ刺激薬などの強心薬を用いると一時的に心機能は良くなるものの、長い目で見ると心臓の負荷が増大して予後が悪化する治療法によく似ている。現在は慢性心不全には「逆転の発想」でβ遮断薬を用いて前負荷を軽減して心臓を休ませ、レニン-アンジオテンシン系阻害薬を用いて後負荷・前負荷を軽減する薬物療法が主流になっている(図1)。 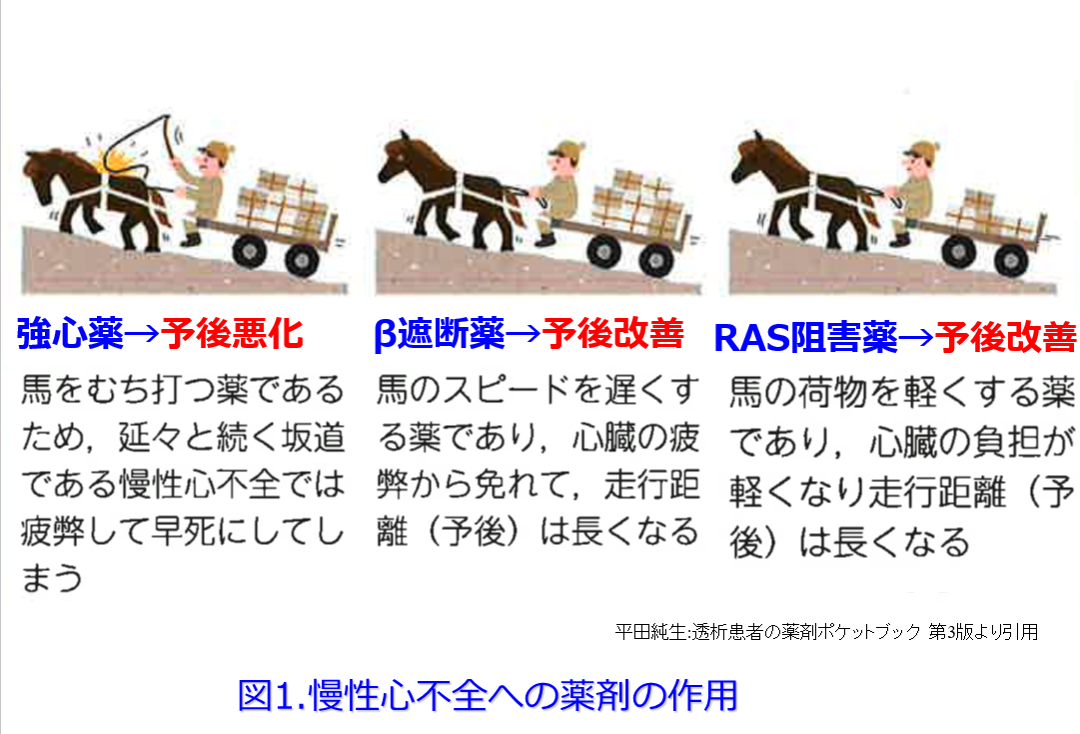
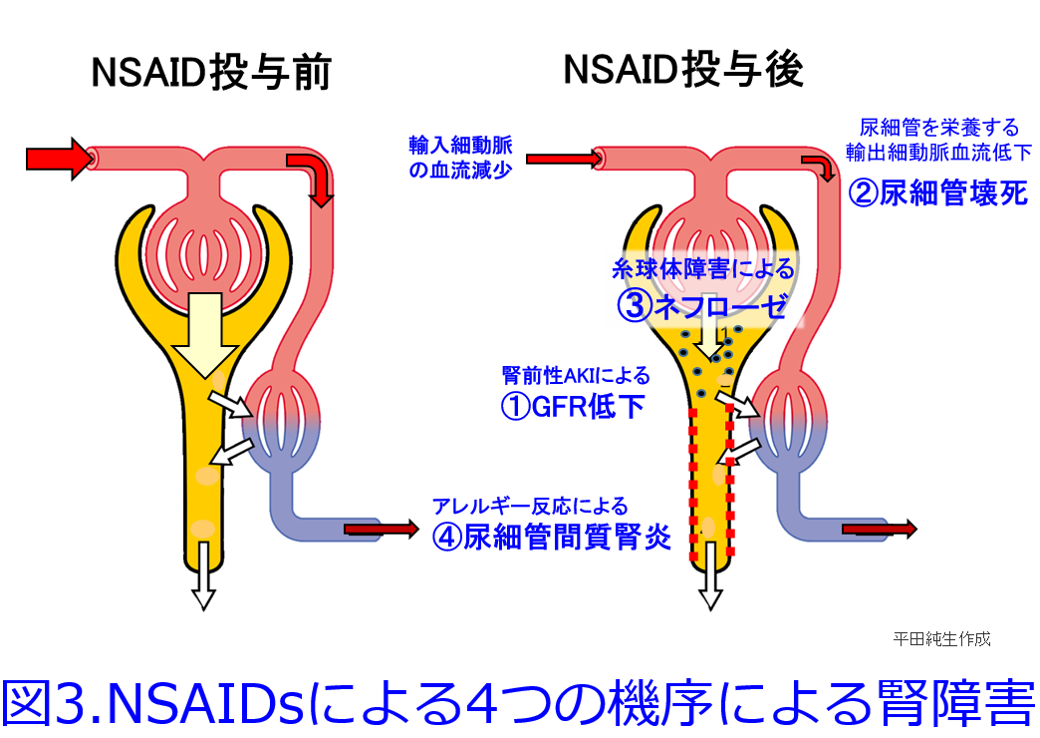
筆者が新米薬剤師のころ、つまり1980年前後にはネフローゼ症候群で蛋白尿を抑制するためにNSAIDのインドメタシンが用いられていたし、「今日の治療指針」にも書かれていた。確かにNSAIDは輸入細動脈を収縮することによって糸球体内圧を下げるので、蛋白尿は減少するはずだ。RAS阻害薬が輸出細動脈を拡張して、糸球体内圧を下げて(腎臓への負荷を軽減して)、蛋白尿を減少させるのと似た考え方だ(図2)。 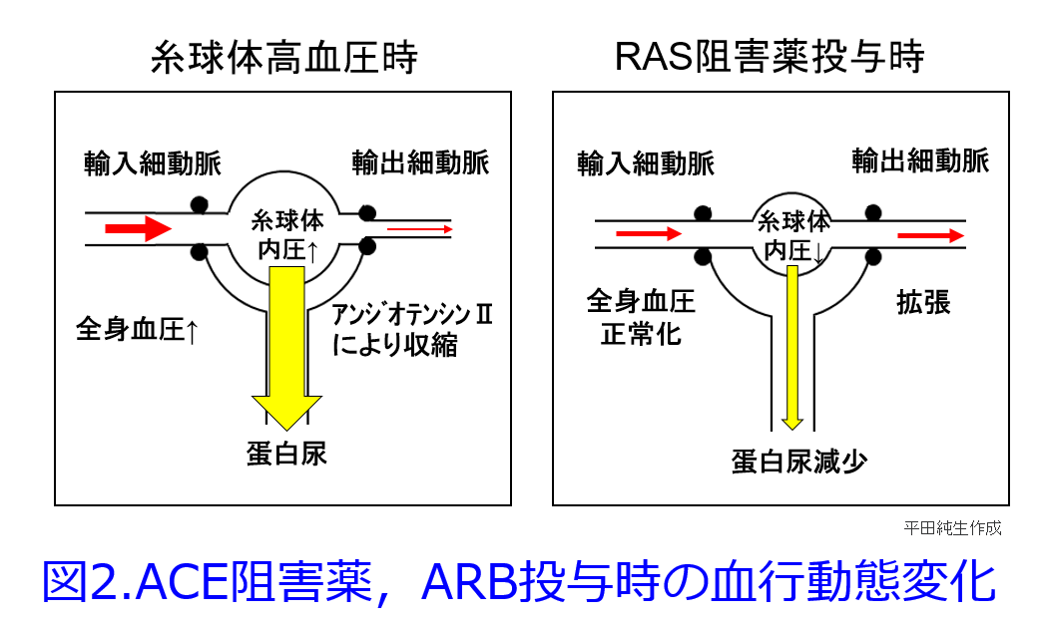 しかし休ませすぎると腎虚血によって急性腎障害になりやすい要注意の薬物なので、RAS阻害薬は蛋白尿のある患者にはとても効果的だが、蛋白尿のない症例ではうまく使わないと腎機能を悪化させてしまうことがある。NSAIDsは①輸入細動脈の血流減少によって腎前性急性腎障害の原因薬物になるだけではなく、②脱水時などにも連用すれば尿細管を栄養する輸出細動脈の血流が著明に低下すると重篤な尿細管壊死に至ることもあるし、③糸球体障害によるネフローゼをきたすこともあり、アレルゲン性の高い薬物であるため④アレルギー反応による尿細管間質性腎炎をきたすこともあるため、腎機能をよくする薬物にはなりえないのだ(図3)。
しかし休ませすぎると腎虚血によって急性腎障害になりやすい要注意の薬物なので、RAS阻害薬は蛋白尿のある患者にはとても効果的だが、蛋白尿のない症例ではうまく使わないと腎機能を悪化させてしまうことがある。NSAIDsは①輸入細動脈の血流減少によって腎前性急性腎障害の原因薬物になるだけではなく、②脱水時などにも連用すれば尿細管を栄養する輸出細動脈の血流が著明に低下すると重篤な尿細管壊死に至ることもあるし、③糸球体障害によるネフローゼをきたすこともあり、アレルゲン性の高い薬物であるため④アレルギー反応による尿細管間質性腎炎をきたすこともあるため、腎機能をよくする薬物にはなりえないのだ(図3)。
低栄養高齢者への低たんぱく療法の是非
炭水化物や脂肪はエネルギーを産生するとH2OとC2Oになるクリーンな栄養素だが、たんぱく質は尿素やクレアチニンといった老廃物、つまり燃えカスができる。このような尿毒素が腎不全になると蓄積して尿毒症を起こし、腎機能を悪化させる。老廃物の蓄積を抑えるためにはその発生源となるたんぱく質を制限すればよいのだが、制限しすぎると栄養状態が悪化する。CKD患者のほとんどが高齢者であり、加齢に伴い筋肉が脂肪に置き換わり、筋力が低下し活動が低下してエネルギーの消費をしなくなるから食事量が減少すると、蛋白異化が亢進してさらに筋肉量が減ってサルコペニアになってしまうというフレイルサイクルに陥ってしまう(図4)。 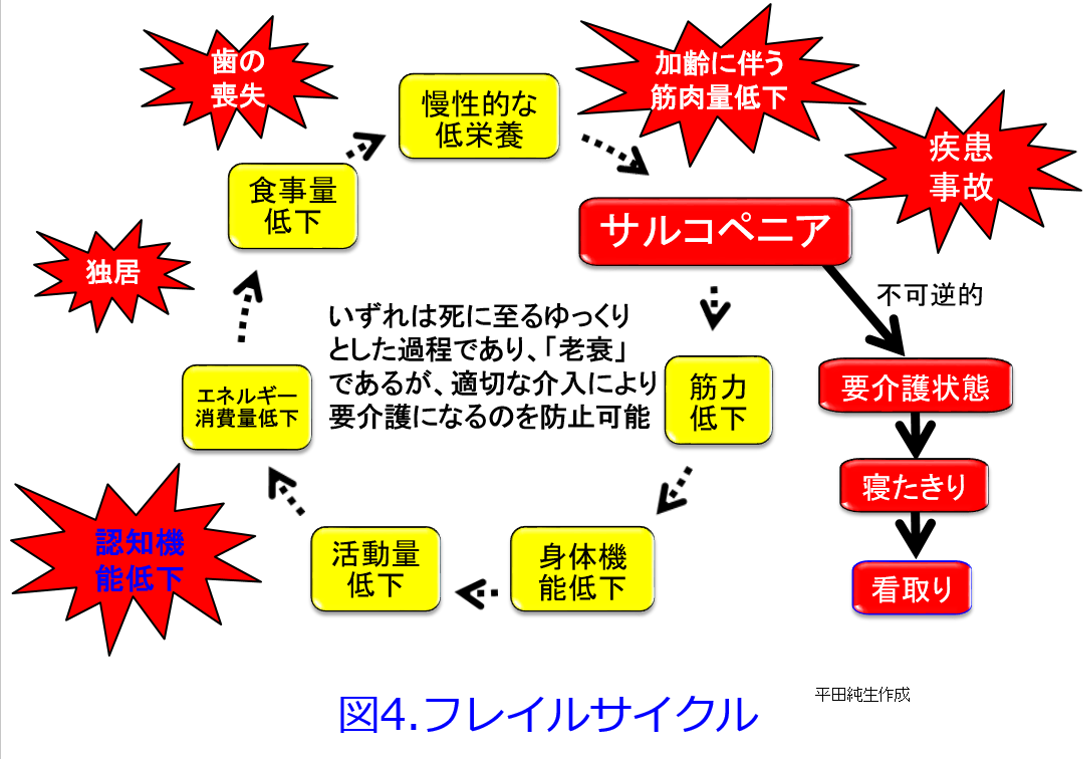 低栄養は免疫能の低下も引き起こすから肺炎の死亡率順位は加齢とともに上がってゆく(表1)。
低栄養は免疫能の低下も引き起こすから肺炎の死亡率順位は加齢とともに上がってゆく(表1)。 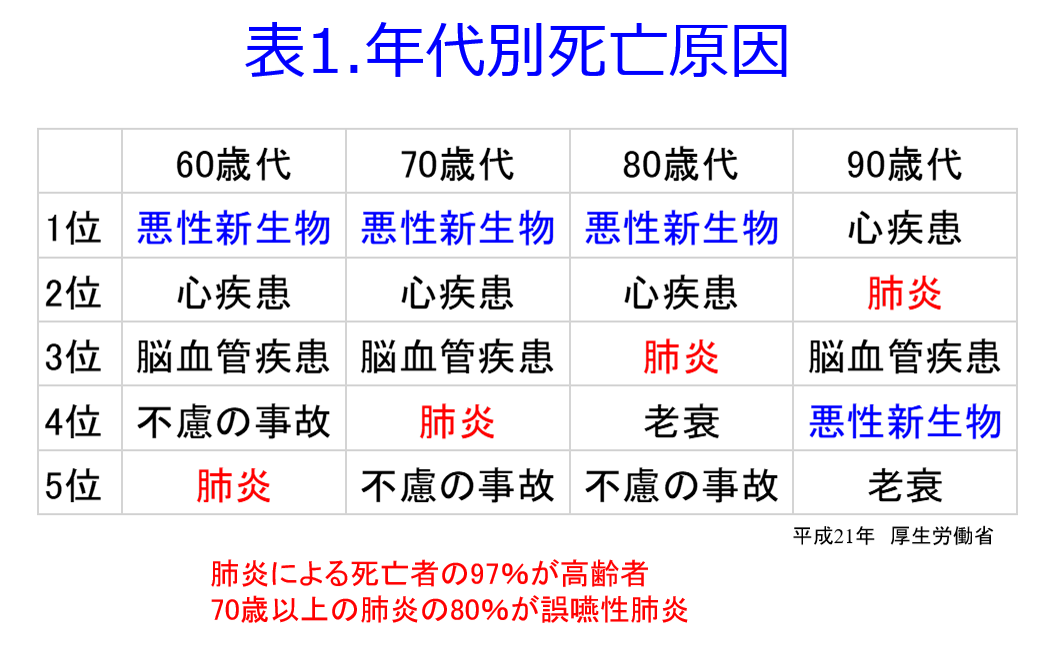 腎機能の悪化を防ぐにはたんぱく質摂取制限は重要な治療法ではあるが、低栄養状態の高齢者となると非常に悩ましい。一般的にはCKDステージ3aでは0.8~1.0 g/kg・標準体重/日、CKDステージ3b以降では0.6~0.8 g/kg・標準体重/日の摂取制限が推奨されている。高齢 CKD 患者においては、CKDステージ4~5 であっても十分な余命が見込まれる場合においてのみ、現状の BMI を維持すべき十分なエネルギー量を確保した上で,たんぱく質の摂取量を考慮する必要があるというところが妥当な落としどころであろう。現在の妥協点は高齢患者においても、0.8 g/kg・標準体重/日を目安にたんぱく質摂取制限が推奨されている。しかし高齢者が十分なエネルギー摂取ができれば体蛋白異化を防げて問題ないのだが、食欲の低下した高齢者に白米をたくさん食べていただくことには無理がある。筆者の個人的な考えではカロリーの多い中鎖脂肪酸(MCT)などをうまく活用していただくなどで、体蛋白の崩壊を防ぐ、あるいは後期高齢者・超高齢者では肉、魚、卵などの良質な動物性たんぱくは制限せずに、もちろんカリウムやリン値などには気を付けながら好きなものを何でも食べていただき、筋肉を減らさないようにしていただきたいと思っている。
腎機能の悪化を防ぐにはたんぱく質摂取制限は重要な治療法ではあるが、低栄養状態の高齢者となると非常に悩ましい。一般的にはCKDステージ3aでは0.8~1.0 g/kg・標準体重/日、CKDステージ3b以降では0.6~0.8 g/kg・標準体重/日の摂取制限が推奨されている。高齢 CKD 患者においては、CKDステージ4~5 であっても十分な余命が見込まれる場合においてのみ、現状の BMI を維持すべき十分なエネルギー量を確保した上で,たんぱく質の摂取量を考慮する必要があるというところが妥当な落としどころであろう。現在の妥協点は高齢患者においても、0.8 g/kg・標準体重/日を目安にたんぱく質摂取制限が推奨されている。しかし高齢者が十分なエネルギー摂取ができれば体蛋白異化を防げて問題ないのだが、食欲の低下した高齢者に白米をたくさん食べていただくことには無理がある。筆者の個人的な考えではカロリーの多い中鎖脂肪酸(MCT)などをうまく活用していただくなどで、体蛋白の崩壊を防ぐ、あるいは後期高齢者・超高齢者では肉、魚、卵などの良質な動物性たんぱくは制限せずに、もちろんカリウムやリン値などには気を付けながら好きなものを何でも食べていただき、筋肉を減らさないようにしていただきたいと思っている。
食物繊維の摂取は腎機能悪化を防ぐ
クレメジン?がインドールを吸着して糞便中に排泄することによって、尿毒素のインドキシル硫酸の産生を抑制して腎機能の進行を阻止することはよく知られている(図5)。 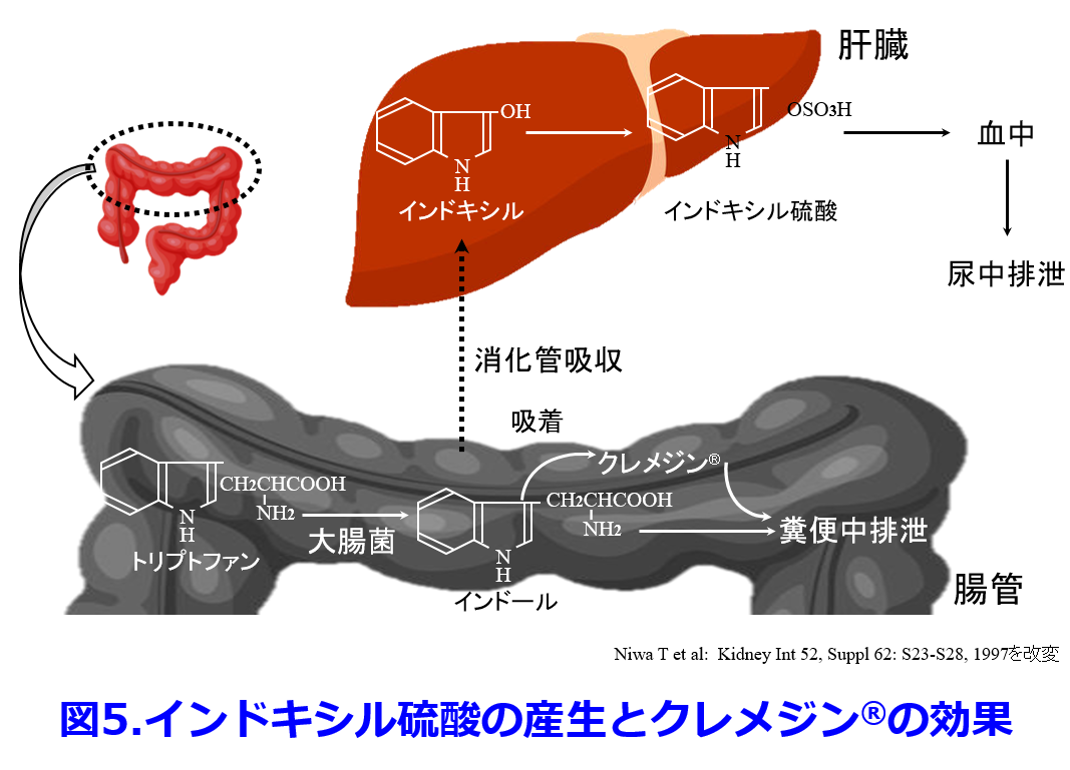 ただしこの図5でトリプトファンからインドールに変換する細菌は近年、大腸菌よりもBacteroides属がメインだといわれている。たんぱく質の摂取は窒素代謝産物の産生を助長し、その中には腎機能を悪化させる尿毒素も産生されている。以前に本HP内「わかりやすい細菌と抗菌薬の話」の第11回、12回で解説したようにインドキシル硫酸だけでなく、p-クレジル硫酸、トリメチルアミン-N-オキサイド(TMAO)の蓄積はいずれも死亡率を上げ、腎機能を悪化させたり、心血管病変を惹起する。そしてこれらすべての尿毒素の産生には腸内細菌が関わっており(図6)
ただしこの図5でトリプトファンからインドールに変換する細菌は近年、大腸菌よりもBacteroides属がメインだといわれている。たんぱく質の摂取は窒素代謝産物の産生を助長し、その中には腎機能を悪化させる尿毒素も産生されている。以前に本HP内「わかりやすい細菌と抗菌薬の話」の第11回、12回で解説したようにインドキシル硫酸だけでなく、p-クレジル硫酸、トリメチルアミン-N-オキサイド(TMAO)の蓄積はいずれも死亡率を上げ、腎機能を悪化させたり、心血管病変を惹起する。そしてこれらすべての尿毒素の産生には腸内細菌が関わっており(図6) 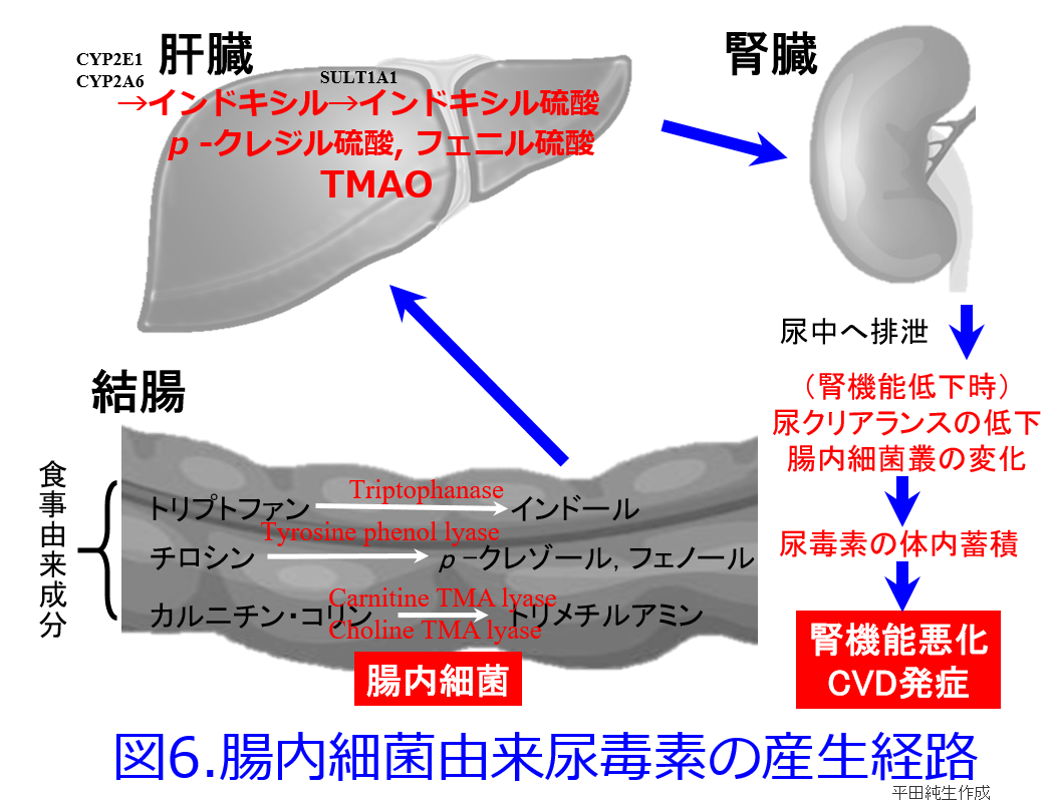 、便秘や肉食、食物繊維不足、肥満などによって尿毒素の産生はさらに助長される。
、便秘や肉食、食物繊維不足、肥満などによって尿毒素の産生はさらに助長される。
Mishimaら1)はアデニン誘発慢性腎不全のマウスに新規下剤のルビプロストン500μg/日を投与し効果を検証した。投与マウスでは腸液の分泌が増加し、腸壁の悪化・善玉菌の減少が改善した。TMAOやインドキシル硫酸などの尿毒素の蓄積も軽減し、BUNの上昇・尿細管間質障害・腎線維化が抑制された。腸内細菌叢の改善に伴ってインドキシル硫酸・馬尿酸・ trans-aconitateの血漿濃度が低下した。これによって腸内細菌叢・腸内環境の改善によって尿毒素の蓄積を抑制することによって腎障害の進行が抑制されたことが明らかになった。
筆者らも腎不全モデルマウスに浸透圧下剤でありプレバイオティクスであるラクツロースを投与するとインドキシル硫酸やp-クレジル硫酸濃度が低下するとともに腎機能悪化が抑制されたことを明らかにした。また腎不全モデルマウスのTGF-βのmRNA発現が低下し、腎線維化が抑制されたことも明らかにした2)。しかも興味深いことにラクツロース投与群ではインドキシル硫酸産生に関与し、肉類を多く摂取する米国人に多いBacteroides属が減少し、食物繊維分解作用が強く食物繊維を多く摂取する東南アジア人に多いPrevotella属が増加した(図7)。 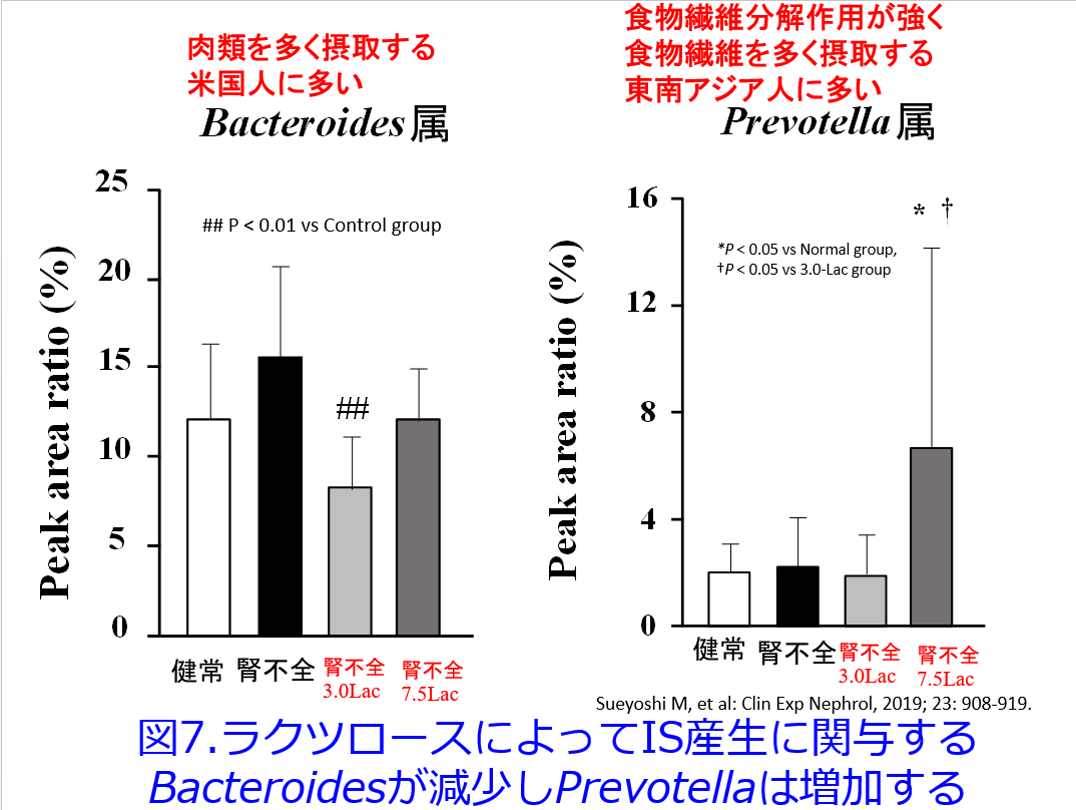
発展途上国の住民は、米国住民よりも腸内細菌叢の構成が多様で、腸管内に有益な微生物が多く存在するが米国に移住すると腸内細菌叢が変化し肥満や慢性疾患のリスクが高まることが知られている3)。さらにPrevotella属が多いタイプには認知症患者がいない4)、Prevotella属が有意に減少すると潰瘍性大腸炎が再燃しやすい5)などの報告もある。
便秘が腎機能を悪化させ透析導入を増やすことも明らかにされているが6)、以前、保存期CKD患者に大黄甘草湯を投与すると腎機能の悪化を抑制できたという報告があったが7)、これは個人的には下剤によってたんぱく質の吸収を抑える低たんぱく療法の一種だと思っていたが、ひょっとすると便秘を改善することによる腸内細菌叢改善作用だったのかもしれない。単に便秘改善だけではなく腸内細菌叢の改善あるいは多様化が腎機能悪化に関与していると筆者は考えている。21世紀以降、DNAシーケンシング分析とそのメタゲノミクスへの応用の技術的進歩は目覚ましく、複雑な細菌叢を定量化し、それらが人間の健康と病気に与える影響の解明に貢献している。腸内細菌叢の解明によって腸脳連関や腸腎連関に関する報告も増加しつつある。
腎機能正常者1,630人を6年追跡し、CKD発症率と食物繊維摂取量の三分位との関連についてみた報告では8)、総繊維摂取量の最低三分位と比較して総繊維摂取量最高の被験者のORは0.47(95% CI 0.27、0.86)。さらに、総繊維摂取量が5 g /日増加するごとに、CKDの発症リスクが11%減少したことが報告されており、交絡因子を調節しても結果は変わらず、特に野菜・豆類が良いそうだ。ということで、腎機能を悪化させない決め手は尿毒素を増やさない、低たんぱく食だけでなく、食物繊維やプレバイオティクス、プロバイオティクスの摂取による腸内細菌叢の改善による尿毒素産生低下かもしれない。
高カリウム血症には気を付けて!
このように「食物繊維は腎機能悪化を防ぐ」ことを聞いて、安易に高齢者や腎機能低下患者に野菜や果物の摂取を推奨しないでいただきたい。腎機能低下患者では高カリウム血症が起こりやすく、高カリウム血症を助長するRAS阻害薬を服用している患者が非常に多いからだ。聞くところによると、ある市ではカリウム摂取は血圧を下げるので、糖尿病やCKDを合併した高齢者に保健婦さんや栄養士さんが野菜・果物の摂取を勧めているそうだ。もしも心不全などでRAS阻害薬だけでなくスピロノラクトンやエキサセレノンなどのMRAが併用されている高齢患者では突然死のリスクになる。それとST合剤に含まれるトリメトプリムも高カリウム血症のリスクが非常に高い。ケールを主成分とする青汁もカリウム含量が非常に高いため、腎機能低下患者にはNGだ。難消化性デキストリンなどのカリウムを含まない水溶性食物繊維サプリメントやカリウムを含まない不溶性繊維サプリメントの方が安全なので、これらのことをよく知ってうえで患者指導にあたっていただきたい。
引用文献
1)Mishima E, et al: J Am Soc Nephrol , 2014
2)Sueyoshi M, et al: Clin Exp Nephrol, 2019; 23: 908-919
3)Vangay P, et al: Cell 2018; 175: 962-972 PMID: 30388453
4)Saji N, et al: Sci Rep 2019; 9(1):1008. doi: 10.1038/s41598-018-38218-7.
5)北江博晃, GI Week 2021
6)Sumida K, et al: J Am Soc Nephrol 28: 1248-1258, 2017
7)Akamatsu A, et al: 和漢医薬学雑誌5:1-12, 1988
8)Mirmiran P, et al: Br J Nutr 119: 479-485, 2018
日米で腎臓病患者への服薬指導のポイントが違う?-後編-
リン吸着薬は食事を始めるときに飲もう。これはとっても重要(super important)だよ。
最後の確認テストでは食直前は正解だけど食直後は間違いになっていた(ただし空腹時にのむとむかつくホスレノールⓇではなかった)。
リン吸着薬は日本では薬によって服用時間が違います。食直前服用もあれば食直後もあるけど、海外では「食事とともに(with each meal)」が正解です。アンサング・シンデレラの第3話でレナジェルが食前服用なのに1回量包装の中に入っているのを問題にしてたけど、服薬アドヒアランス不良の人やドラマのように1回量包装なら僕はドクターに頼んで食後にしてもらうことも十分ありだと思っています。
EPOの投与初期に体が痛くなったり、注射部位が痛むことがある。最も重要なことは、がんがあるときには投与しない方がいいかも。
なんで最も重要なのに「いいかも」っていうの?血栓症が起こりやすいから?このYoutubeは4年前に収録されたものなので、そんなに古くはないですね。がん患者にプラセボを投与した患者に比べて血栓症による死亡率が高いことが示されたとの報告が2008年に報告さており( Smith RE Jr, et al. J Clin Oncol. 2008;26(7):1040-50.)、日本輸血・細胞治療学会から「がん化学療法に伴う貧血の治療における赤血球造血刺激因子製剤の必要性についての学会見解」が出されています。この中でも「そして最も重要なことは、それぞれの治療選択肢(ESA か緊急避難的な輸血か、あるいはどちらも選択しないかなど)について、リスク(可能な限りコストも)とベネフィットを説明し、 患者の好みにより(同意を経て)、ESA は使用されるべきであると考える。」と一応書かれています。でもがん化学療法に伴う貧血に対して「輸血とESAとどちらにする?」と聞かれるとほとんどの医療者・患者ともにESAを選択するんじゃないでしょうか。体が痛くなるというのはあまり聞いたことない。ただし発売し始めたころはエスポーⓇとエポジンⓇはどちらかが注射の痛みが強かったらしくて,MRさんが宣伝材料にしていた時代があったのを思い出しました。
経口鉄剤は吸収がよい空腹時にのむべし
以前は日本でもこういう説明もあったかも?でも今は「経口鉄剤は胃腸障害や便通異常などの消化器系の副作用が出やすいために、治療を中断することが多いので」とか「特に空腹時服用で胃障害が多いといわれている」ので、食後に飲むことを勧めることが多いと思いますし、僕も薬剤師時代には「胃障害を起こさないために食後すぐ飲んでください」と迷わず説明していました。透析患者さんって胃が本当に弱くって半分くらいの方がPPIを飲んでましたから。アンサング・シンデレラの第3話でも「フェログラデュメットⓇ」を飲むと吐き気がする小学校の先生の話が出ていましたね。日本の鉄剤の添付文書も「通常成人1日105~210mg(1~2錠)を1~2回に分けて,空腹時に,または副作用が強い場合には食事直後に,経口投与」となっています。10年以上前にはリファンピシンの添付文書にも「食前服用」になっていましたが、他の抗結核薬が食後なのにこんな飲ませ方をしていたらアドヒアランス不良になるからでしょう、今は1日1回毎日服用に改められています。アンサング・シンデレラの第3話では添付文書では食直前になっているレナジェルⓇが食後の1包化されていたのが問題になっていましたが、これもアドヒアランス不良の原因になるので、僕は食直後で全然構わないと思っています。欧米の添付文書ではwith each meal、つまり食事とともに服用ですからね。
腎臓病の人は咳や風邪薬にNSAIDsが含有されていないことをチェックして
これは個人的にはいいと思います。NSAIDsの様々な不利益、胃障害、消化管出血、腎障害、アスピリン喘息、高血圧、脳梗塞、心不全、心臓死などの心血管疾患、を考えると(風邪だけじゃないけどCarter S, et al: JAMA Network Open. 2018;1(3):e180756. doi:10.1001をよく読んでほしい)やっぱりアセトアミノフェンにすべきだと思います。でもロキソニンⓇの適応症には「急性上気道炎(急性気管支炎を伴う急性上気道炎を含む)の解熱・鎮痛」と明記されています。NSAIDsのOTC薬はかつて米国では膝関節症で年間16,000人、リウマチで2,000人もの死亡者を出したため、日本と違って米国の病院でNSAIDsが処方されることはなく、痛み止めとしてはもっぱらアセトアミノフェンが汎用されていました。
アンサング・シンデレラについて随分、批判めいたことを書いてしまいましたが、ドラマとしての内容はいいし、薬剤師が日の目を浴びるのはとっても嬉しいことだと思って応援しています。それから僕の考えが間違っていると気づいた方はhirata@kumamoto-u.ac.jpまでご連絡ください。
日米で腎臓病患者への服薬指導のポイントが違う?-前編-
Pharmacist Discusses Medications for Kidney Disease(UC Sandiego Health)をyoutubeで視聴して
アマゾンプライムで見ることにできるGrey’s Anatomyという米国テレビドラマは医学用語の勉強になるのでコロナ禍のリモートワークの時にはよく見ていました。やけに院内恋愛が多いので気になりましたが…。最近、若い人はテレビよりもYoutubeをよく見るような時代になってきたらしいですね。ブームに乗るわけではないのですが、医学薬学情報をYoutubeで見ると医学英会話の勉強にもなりますし、国際学会での講演が聞き取りやすくなるので、昔からよく見ていました。腎臓の解剖学なども教科書を読むよりわかりやすく楽しいです。今回、薬剤師の腎臓病患者さんへの服薬指導についてのYoutubeを見ましたが、ちょっと????と思うことがありましたので、それについて解説してみたいと思います。青字がYoutubeでの米国薬剤師の説明内容、黒字が僕の感想です。
降圧薬の中でRAS阻害薬は夜のむといいかも。食欲がなく、飲み物も取れない元気がないときには、元気になるまで一時的に飲むのをやめることを医師が進言するかも
ある種の利尿薬は光線過敏症があるので気を付ける。
ちなみにARBは「アーブ(Rの発音がむつかしい)」と発音していました。UFOのことは「ユーフォー」とはNativeは言わないらしいですが…。
「食欲がなく、飲み物も取れないようなときに元気がないとき医師が一時中止する」これはRAS阻害薬による腎機能悪化を防ぐSick day対策としてはいい指導と思いますが、「高齢者で夏季には特に」そして「飲水励行」というのを付けくわえたいです。
利尿薬に光線過敏症は確かにあるけど、すごく重要とは思っていませんでした。白人だから多いのではないかしら?
ニフェジピンは夜にのんだ方がいい
RAS阻害薬でも夜にのんだ方がいいといっていましたが、ニフェジピンは24時間効果のある時効錠のことだと思うけど、「Non-dipper(睡眠時に血圧が高いままの人)なら高血圧による臓器障害が起こりやすいので」という説明が欲しかったです。Dipperの人にまでわざわざ「夜にのんで」ということはないでしょう。 というか、睡眠時に血圧を測定する人はほとんどいないんじゃないかしら。米国で非常に多い心筋梗塞が早朝(午前6時から8時)と夜間(午後8時から10時ごろ)に起こりやすいからかもしれません。
というか、睡眠時に血圧を測定する人はほとんどいないんじゃないかしら。米国で非常に多い心筋梗塞が早朝(午前6時から8時)と夜間(午後8時から10時ごろ)に起こりやすいからかもしれません。
アムロジピンでシンバスタチン濃度が上昇する
確かに、その可能性はあるけれど、もっともっと血中濃度が上がるはずのイトラコナゾール(併用で活性体のシンバスタチン酸の血中濃度が19倍になることが知られている[Neuvonen PJ, et al: Clin Pharmacol Ther 63: 332-341, 1998])やボリコナゾール、クラリスロマイシン(添付文書では禁忌になっていないけど禁忌レベルで、横紋融解筋症による腎機能悪化で透析導入になった症例報告もあるし[Lee AJ, Maddix DS: Ann Pharmacother 35: 26-31, 2001])、抗HIV薬(以上、CYP3A4阻害薬)、フィブラート系薬物(横紋融解筋症が起こりやすい)、シクロスポリン(これはOATP1B1阻害薬+CYP3A4阻害薬)の方が重要だし、グレープフルーツや九州・四国の特産品の文旦類の柑橘類の方が重要なんじゃないかしら(薬剤情報提供用紙を渡すだけではなく口頭説明も必要なレベル)。米国は心筋梗塞による死亡率が非常に高いからシンバスタチンの最高用量は80mg/日なっているので、気をつけなくっちゃいけないとは思うけど…。
アムロジピンの添付文書ではシンバスタチン80mgに併用するとシンバスタチンのAUCが77%上昇したと書かれているけど、上記の薬物の相互作用は数倍~20倍になるので1.77倍はあまり大したことはないと思っています。薬剤情報提供用紙に書いておけばそれでよしというレベルだと思います。
CKD患者の低血糖時にはオレンジジュースはやめてリンゴジュースかブドウ糖の錠剤に使用。だってオレンジはカリウムが高いから。
オレンジジュースのカリウム濃度は 180mg/100gで42kcal、りんごジュースのカリウム濃度は77 mg/100gで44kcal。なるほど!でも含量が比較的少ないとはいえ、リンゴジュースを高カリウムの人に勧められるかしら?
腎機能の判断は血清クレチニンではなく今後はeGFRで!
いまだに多くの医師・薬剤師が腎機能の指標として血清クレアチニン(Cr)値を使っているという学会発表や調査報告があります。以下の2人の患者の血清Cr値は同じ値ですが、皆さんは腎機能をどのように判断しますか?
Aさん:20歳男性180cm、70kg、血清Cr値1.2mg/dL
Bさん:80歳女性155cm、50kg、血清Cr値1.2mg/dL
Aさんは若くてアスリートのような体形を予想させますね。でもデータだけで腎機能を判断するのはよくないです。実際にAさんBさんの体格と活動度を確認する必要があります。Aさんは大学生でバスケットボール部のキャプテンで、筋骨たくましい男性でしたが、肉離れで整形外科を受診していました。そしてBさんは大きな病気はないものの、腰痛や膝関節症などで、整形外科に通っており、日常生活は通常にできているものの、ほとんど運動はしていません。血清Cr値が同じで、腎機能を判断しにくいので、腎機能推算式として汎用されているCockcroft-Gault式 によるクレアチニンクリアランス(CCr)を算出してみましょう。そうすると図1のようにAさんは97mL/min、アスリートでなかったら筋肉量は少ないので、もっと高いCCrになり、多分120~130mL/minはあるのではないかと思います。
BさんはAさんの1/3以下の29mL/minで高度腎障害に分類される腎機能した。もっと運動ができていたら、血清Cr値はもっと高くなってCCrは20mL/minに推算されていたかもしれません。Cockcroft-Gault式は肥満患者では腎機能を高く推算し、元気な高齢者では腎機能を低く見積もってしまうという2つの欠点がありましたが2人とも肥満ではなくBさんも活動度は低いので、推算値と実測値との乖離はそんなにないと思われます。
ただしこれらはあくまで推算値であり実測値ではありませんが、血清Cr値が同じでも推算CCrはこんなに差があり、実測するともっと差が出るかもしれないなと平田は予測します。

ということで、わす化に高い程度の血清Cr値で腎機能を判断するのはあまりよくありません。今後はCCr、いやもっと精度の高い体表面積未補正eGFR(mL/min)を使うべきだと思います。なぜこのようなことをブログで書いたのかというと、2016年4月8日にFDAから”FDA Drug Safety Communication: FDA revises warnings regarding use of the diabetes medicine metformin in certain patients with reduced kidney function“という医薬品安全性情報(Drug Safety Communications:http://www.fda.gov/Drugs/DrugSafety/ucm493244.htm)が出されたからです。内容は以下の通りです。
We are recommending that the measure of kidney function used to determine whether a patient can receive metformin be changed from one based on a single laboratory parameter (blood creatinine concentration) to one that provides a better estimate of kidney function in patients with kidney disease (i.e., glomerular filtration rate estimating equation (eGFR)).
メトホルミンを投与している患者に対しては血中Cr濃度のような単一の検査値からではなく腎機能をより正しく見積もることのできるeGFRに変えましょうという内容です。そうです。時代は変わってきているのです。国際間で、測定法の違いによって値が異なり、加齢・性別によって評価の仕方を注意しなければならない血清Cr値や、肥満患者で過大評価し、元気な後期高齢者では過小評価してしまう推算クレアチニンクリアランス(CCr)からeGFRを使って腎機能を評価しようという時代になりつつあるのです。
これに呼応して{かどうかは分かりませんが}2016年5月12日日本糖尿病学会は「ビグアナイド薬の適正使用に関する Recommendation」http://www.jds.or.jp/modules/important/index.php?page=article&storyid=20をおよそ2年ぶりに改訂し「メトホルミンの適正使用に関する Recommendation」として発表しました。
「ビグアナイド薬の適正使用に関するRecommendation」
メトグルコは中等度以上の腎機能障害患者では禁忌である。SCr値(酵素法)が男1.3mg/dL、女性1.2mg/dL以上の患者には投与を推奨しない。
高齢者ではSCr値が正常範囲内であっても実際の腎機能は低下していることがあるので、eGFR等も考慮して腎機能の評価を行う。ショック、急性心筋梗塞、脱水、重症感染症の場合やヨード造影剤の併用では急性増悪することがある。尚、SCrがこの値より低い場合でも添付文書の他の禁忌に該当する症例などで、乳酸アシドーシスが報告されている。
⇓
「メトホルミンの適正使用に関する Recommendation」
腎機能をeGFRで評価し、eGFRが30(mL/分/1.73m2)未満の場合にはメトホルミンは禁忌である。
eGFRが30~45の場合にはリスクとベネフィットを勘案して慎重投与とする。脱水、ショック、急性心筋梗塞、重症感染症の場合などやヨード造影剤の併用などではeGFRが急激に低下することがあるので注意を要する。eGFRが30~60の患者では、ヨード造影剤検査の前あるいは造影時にメトホルミンを中止して48時間後にeGFRを再評価して再開する。尚、eGFRが45以上また60以上の場合でも、腎血流量を低下させる薬剤(レニン・アンジオテンシン系の阻害薬、利尿薬、NSAIDsなど)の使用などにより腎機能が急激に悪化する場合があるので注意を要する。
「腎機能を正しく判断するには血清Cr値よりも推算CCr、推算CCrよりも体表面積未補正eGFR(mL/min)を使いましょう。そして諸々の事情で推算値が適応しにくい症例には実測CCrを使いましょう。軽度腎機能低下時や筋肉量の影響を受けないシスタチンCによる体表面積未補正eGFR(mL/min)も結構いいですよ」というのが今回のブログの結論です。
薬剤性腎障害などのNSAIDsの副作用が薬剤師による医師への教育によって有意に減少?
New England Journal of Medicineの3月17日号に載った論文「Safer Prescribing–A Trial of Education, Informatics, and Financial Incentives. より安全な処方のための教育、情報の提供、金銭的インセンティブ」を紹介します。これは薬剤師が自由に参加できる育薬フロンティアセンター主催の抄読会で6年生の福元君によって紹介されました。
NSAIDsや抗血小板薬をリスクの高い患者に投与するハイリスク処方による消化管出血、NSAIDsをCKD患者に投与したり、RA阻害薬+利尿薬と併用することによる急性腎障害(AKI: acute kidney injury)、あるいは心不全患者にNSAIDsを投与することによっておこる心機能悪化による入院に対して介入することによって、副作用による入院を減少できるかという研究が実施されました。
対象はプライマリケア診療所を営む英国スコットランドの開業医で、どのような介入をしたかというと、まず最初に行ったのが薬剤師など専門家によるハイリスク薬に関する教育なのです。そのほかの介入は表1に示す通りです。
表1. NSAIDsと抗血小板薬を含むハイリスク処方に対し3つの介入
(1)薬剤師など専門家による教育 (開始時に1時間受講)、その後8週ごとにレターなどが送付
(2)電子カルテから処方の見直しが必要な患者データを特定するなどの情報システムによる支援
(3)ハイリスク処方について見直しを行った際に支払う金銭的インセンティブ (初回固定額として600ドル、見直した患者ごとに25ドル;フルタイム医師当たり平均収入の約0.6 %に相当する平均約910ドルの支払いを見込んだ)をそれぞれ提供した。
では実際にどのような介入をハイリスク薬と定義したのかというと表2に示すNSAIDsと抗血小板薬を含む9種の処方でこれらを主要評価項目にしています。表2の(1)から(6)まではハイリスク患者に消化管出血を起こす可能性のあるハイリスク処方であり、(7)と(8)は急性腎障害(AKI)になるハイリスク処方であり、(9)は心不全を悪化させる可能性のあるハイリスク処方です。ではなぜ(7)(8)によるAKIになるかもしれない処方をハイリスク処方としたのかというと、英国では1999年から2009年の間に薬剤性腎障害による入院が約2倍に増加しており、AKIの重要な原因が薬剤性であるにもかかわらず薬剤間相互作用が急性腎障害リスクに及ぼす影響についてはほとんど知られていなかったことに起因します。
表2.NSAIDsと抗血小板薬に関する9種のハイリスク処方(主要評価項目)
(1)消化管潰瘍患者に胃粘膜保護薬処方なしでNSAIDまたはアスピリン処方
(2)75歳以上患者に胃粘膜保護薬処方なしでNSAID処方
(3)65歳以上患者に胃粘膜保護薬処方なしでNSAID処方
(4)65歳以上・アスピリン服用患者に胃粘膜保護薬処方なしでクロピドグレル処方
(5)経口抗凝固薬服用患者に胃粘膜保護薬処方なしでNSAID処方
(6)経口抗凝固薬服用患者に胃粘膜保護薬処方なしでアスピリンまたはクロピドグレル処方
(7)RAS阻害薬と利尿薬服用患者にNSAID処方
(8)慢性腎臓病患者にNSAID処方
(9)心不全歴あり患者にNSAID処方
副次評価項目として解析したのはこれらの処方に関連した「入院」です。統計解析は除外対象になったものも解析に含めるintention-to-treat解析です。
AKIに関しては1997年1月1日から2008年12月31日までに降圧薬投与を受けていた成人患者を登録し、48万7372人からなるコホートを対象にしています。主要転帰評価指標は、2剤または3剤の現在使用者のAKIによる入院に設定しています。最終的には試験を完了した33診療所を含み、介入前の対象患者3万3,334例と、介入後の対象患者3万3,060人について統計的解析を行っています。
では結果を示しましょう。事前に規定したハイリスク処方(あらゆるリスクを有した患者)の発生率は、介入直前の3.7%(2万9,537例中1,102例)から、介入終了時の2.2%(3万187例中674例)へと40%程度減少し(P<0.001)(図1)、介入後もその傾向は持続しています。
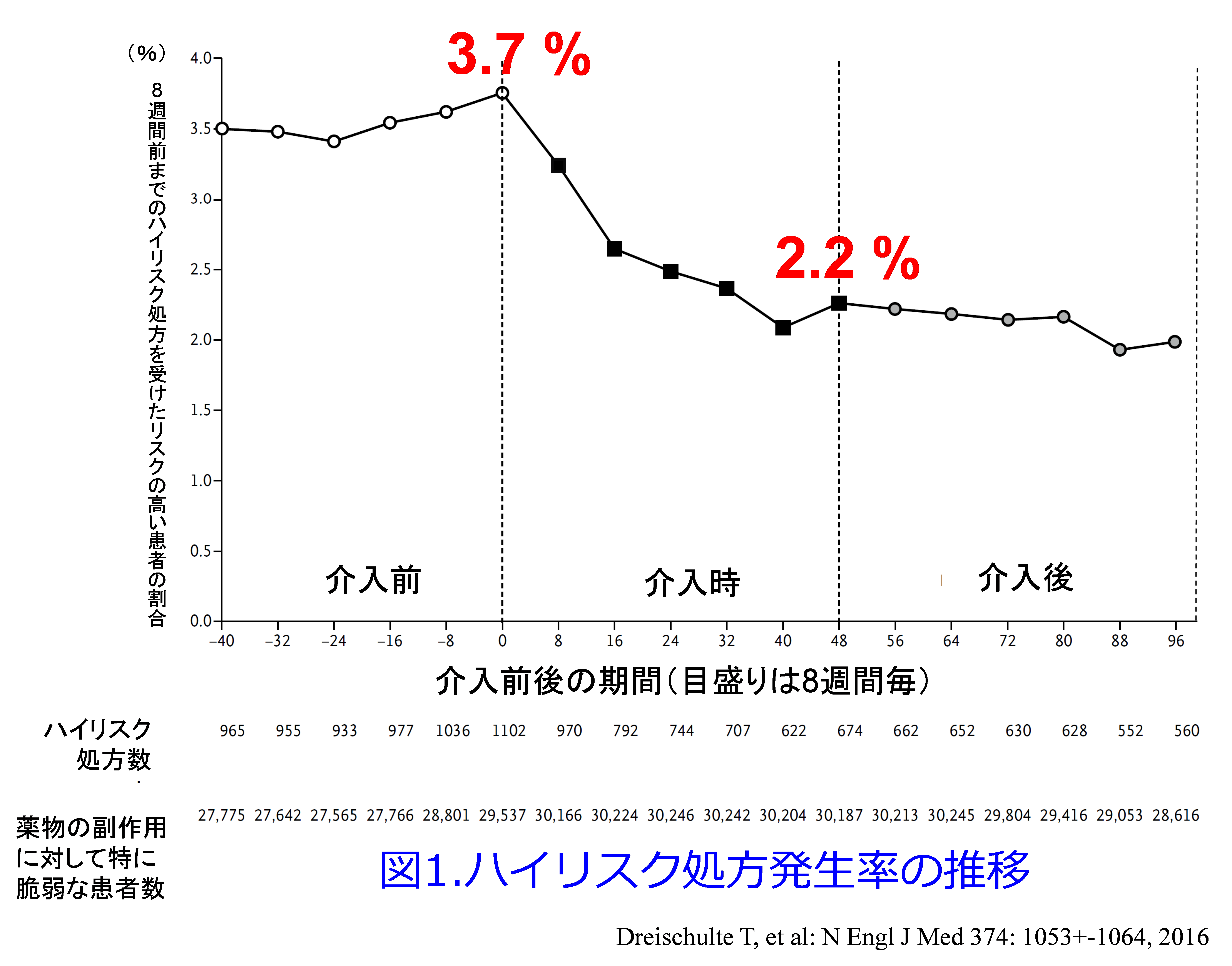
副次的評価項目である入院率の検討を行うと入院前の8週間における規定したハイリスク処方に関する潜在的な薬物関連入院に関しては消化管潰瘍や消化管出血による入院は、介入前の4.6件/1万患者年から介入期間中の0.4件/1万患者年へと、有意に減少し(P=0.004)、AKIによる入院も、34.6件/1万患者年から11.1件/1万患者年へと、有意に減少しました(P<0.001)。一方、NSAIDsによる心不全による入院は、59.0件/1万患者年から32.1件/1万患者年へと、有意な減少は認められませんでした(P=0.34)(図2)。
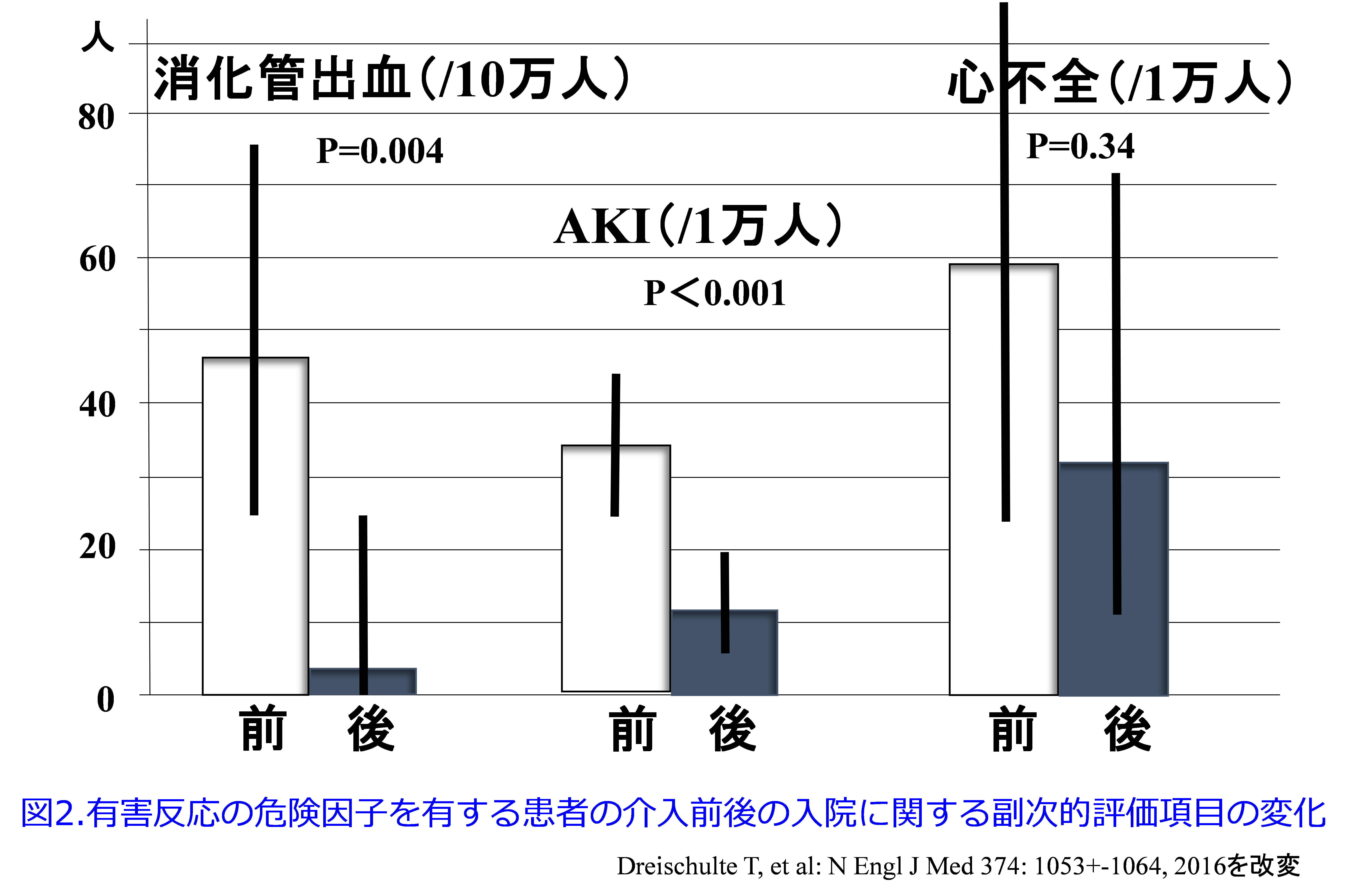
また、規定したハイリスク処方によらない潜在的な薬物関連入院に関しては消化管潰瘍や消化管出血による入院も、介入前の55.7件/1万患者年から介入期間中の37.0件/1万患者年へと、有意に減少しました(率比:0.66、95%CI:0.51-0.86、P=0.002)。心不全による入院も、707.7件/1万患者年から513.5件/1万患者年へと、有意に減少しました(率比:0.73、95%CI:0.56-0.95、P=0.02)。一方、AKIによる入院は、101.9件/1万患者年から86.0件/1万患者年へと、有意な減少は認められませんでした(率比:0.84、95%CI:0.68-1.09、p=0.19)。
この研究に参加した診療所は参加しなかった診療所よりもより意欲的でありハイリスク処方を変更する大きな能力を持っていた可能性があるなどのリミテーションはあるものの、ハイリスク処方を改善するための介入にプライマリケア専門医に対する薬剤師による教育が行われ、その他の介入もあったものの、結果として不適切処方による消化管出血やAKIなどの医原病が有意に減少できたことは大いに意義深い検討と言えます。日本では多剤投薬された患者の減薬を行うと点数が算定できるようになりましたが、まだまだ無駄な処方がされていることの裏付けかもしれません。入院を要するようなハイリスク薬処方を疑義照会によって減少させて、入院件数を減らすことに成功した薬剤師に点数が加算されるシステムが導入されれば、医薬品の安全性を担保することのできる薬剤師が誰なのかがわかる、つまり有能な薬剤師がは誰かを判断できる時代が来るかもしれません。
原著論文
Dreischulte T, Donnan P, Grant A, Hapca A, McCowan C, Guthrie B: Safer Prescribing–A Trial of Education, Informatics, and Financial Incentives. N Engl J Med. 374(11): 1053-1064, 2016
アセトアミノフェン単独で腎障害は起こさない
CKD診療ガイドラインでのアセトアミノフェンの位置づけ
エビデンスに基づくCKD診療ガイドライン2009の21項「薬物投与」の3.消炎鎮痛薬に関してはアスピリンとアセトアミノファンが腎機能に及ぼす影響を検討した臨床研究はそれぞれ異なった結果を報告しているが、エビデンスレベルが低くその優劣はつけられないとし、(中略)今回のステートメントでは「CKD患者の腎機能障害の進行に関しては、安全性が確立された消炎鎮痛薬はなく、いずれの薬剤もできるだけ少量短期間の投与とする」とされている。エビデンスに基づくCKD診療ガイドライン2013でもこの内容は21項のCKDにおける薬物投与でCQ4「 NSAIDsはCKDの進展に影響を及ぼすか?」として取り上げられたが「CKDにおいては、いずれのNSAIDsも腎機能を悪化させる危険性がある。ただし、NSAIDsによる腎機能の悪化が長期的なCKDの進展に影響を及ぼすかは、明らかでない」としているものの、いずれのNSAIDsもアセトアミノフェンも腎機能に悪影響を及ぼす危険性があり、使用は最小限にとどめるべきとほぼ同内容になっている。
当然ながら、ガイドラインであるため、個々のエビデンスの高い原著論文を対象とした結果である。私のこれまでの考えも「NSAIDsを腎虚血を起こしやすいリスクの高い患者(CKD、心不全、高血圧、糖尿病、RAS阻害薬、利尿薬服用患者など)では腎虚血から速やかにGFRが低下し、漫然投与すると週・月単位で急性腎障害になる。かたやアセトアミノフェンはGFRを低下させることはないが、大量を漫然と投与すると年単位で鎮痛薬腎症により慢性腎不全に至り透析導入が必要になる」と考えていた。ただし、これらの報告はアセトアミノフェン単独服用によって慢性腎不全を起こすという報告はほとんどないのである。これに気付いたのは現在執筆中の日本医薬品安全性学会誌第1号に「NSAIDsとアセトアミノフェンの安全性について~特に腎機能障害に着目して~」という総説のために大量の論文を取り寄せ、特に出来のいい総説を含めて精査したことによる。
そもそも鎮痛薬腎症とは?
これらの報告は鎮痛薬腎症が、オーストラリアに次いで多いと言われたベルギーのアントワープ大学腎臓高血圧内科のElsevierのグループとCCr予測式のCG式で有名なカナダのSt John’s Newfoundland記念大学内科のGaultのグループの報告がやたらと多きことに気付くが、「鎮痛薬腎症とは何ぞや?」ということから調べてみた。
元来、フェナセチン含有鎮痛薬が原因と考えられていたが、フェナセチン製造中止後も発症しており、アセトアミノフェンを含む2種類の鎮痛薬(アスピリン)とカフェイン±コデインの配合剤が原因と考えられている。米国腎臓財団、ヨーロッパ科学者グループは鎮痛薬腎症は2つの鎮痛薬を含み、ほとんどがカフェイン±コデインからなる多種類の鎮痛薬製剤の過剰服用によって腎乳頭壊死と慢性間質性腎炎を起こす進行性の腎不全であると定義した。鎮痛薬腎症は乳頭壊死・慢性間質性腎炎を起こし、腎の疝痛、顕微鏡的血尿を伴うことが多いが、タンパク尿や尿量減少を呈する症例は少ない。60~75%に無菌膿尿、再発性の泌尿器感染を伴う1)。CTによる両側の乳頭部のでこぼこした形状と石灰化を伴う腎萎縮は鎮痛薬腎症の診断の決め手となる。特に両側の乳糖部石灰化の感度(92%)、特異度(100%)は高い2)。
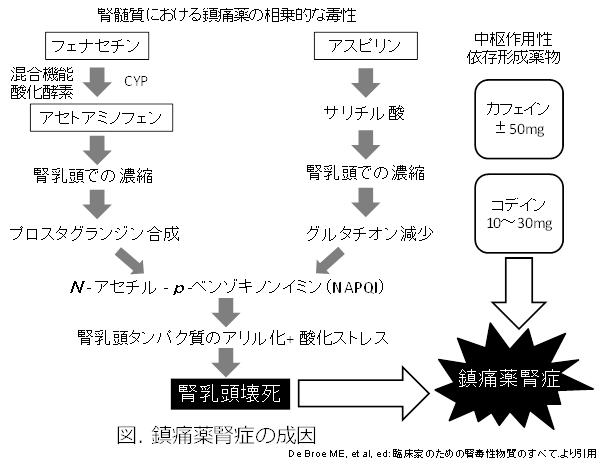
アセトアミノフェンとアスピリンの服用により皮質および乳糖部で高濃度のサリチル酸(アスピリンの活性代謝物)がグルタチオンを枯渇させる(利尿薬併用により加速)。グルタチオンはアセトアミノフェンの毒性化合物 NAPQIの不活性化に必要なため、枯渇により脂質過酸化、臓器タンパクのアリル化を起こし、乳頭壊死、石灰化することが実証されている(図)3)。
鎮痛薬を少量、毎日服用しても鎮痛薬腎症を起こすには最低5年は必要であり、5年以下では起こらない4)。頭痛を持つ女性に多く、消化性潰瘍を含む上部消化管障害を併発しやすい5)。5~55年間、鎮痛薬を連用し、50~60歳で発症するが1)、緩徐にする腎障害で慢性腎不全(GFR15~30mL/min)になるまで症状は出ない6)。フェナセチンが製造中止になっても鎮痛薬腎症が起こるのに平均22年要するため7),製造中止しても直ちには鎮痛薬腎症は減らない8)。
鎮痛薬腎症の発症率は1970年代のオーストラリアでは22%と世界一であったが9)、1990年代初頭にはオーストラリア9%10)、ヨーロッパ3%H)、米国0.3%であり、国別ではオーストラリア、ベルギー、カナダで高い。少なくとも2成分の鎮痛薬を含むOTC薬の販売禁止によってオーストラリアの鎮痛薬腎症による透析患者数を減らせることができた。
アスピリン、アセトアミノフェンの配合剤が鎮痛薬腎症を発症する
上記のことから鎮痛薬腎症にアセトアミノフェン+アスピリンの併用は必須である。上述のようにアスピリン、アセトアミノフェンの単独長期大量使用ではほとんど発症しない8)11)のであって、アスピリン、アセトアミノフェンの配合剤が鎮痛薬腎症を発症する。アセトアミノフェン単独で相対危険度3.2倍という報告12)もあるが、アスピリン服用者とフェナセチン+アスピリン+コデイン服用者のみで相対危険度が計算されている。またアセトアミノフェン年間服用量が366錠を超えると末期腎不全になるオッズ比が2.1倍に、あるいは生涯5000錠以上の服用でオッズ比が2.4倍になるという報告13)も他の鎮痛薬も含まれておりアセトアミノフェン単独の報告ではない。しかもこの報告では生涯NSAIDs服用量が5000錠以上で8.8倍になることも明らかにしている。
また驚くことに動物実験によっても鎮痛薬腎症については相反する報告があり、いまだに解明されていない14)のである。前章で示したようにアセトアミノフェン単独では鎮痛薬腎症は起こらず、アスピリンの配合が必須であり、さらに多くの鎮痛薬配合剤にはカフェイン±コデインの配合剤が多いのでこれも切り離して考えられないのである。
AAC処方・ACE処方は日本にもある。ただし鎮痛薬腎症は日本で起こるか?
となると日本で問題になるのはAAC処方であり、アセトアミノフェン+アスピリン+無水カフェインから成りOTC薬のバファリンプラスがまさにこの処方である。AAC処方にアリルイソプロピルアンチピリンを加えたものがエキセドリンA錠であり、これもAAC処方と言える。SG配合顆粒の成分はイソプロピルアンチピリン+アセトアミノフェン+アリルイソプロピルアセチル尿素+無水カフェインから成り、アスピリンは含まれていない。
もう1つ可能性がある日本のOTC薬としてACE処方がある。これはアセトアミノフェン+カフェイン+エテンザミドから成るが、エテンザミドも体内で代謝されサリチルアミドになり胃障害が少ないと言われている。AAC処方から成るOTC薬はセデスファースト、新セデス錠、ノーシン、ナロン錠・顆粒、サリドンエース、ハッキリエースなどがあります。医療用医薬品のセラピナ配合顆粒、ピーエイ配合錠などはACE処方+プロメタジンの配合された感冒治療薬である。ただしエテンザミドはあまり海外では使われていないのか情報に乏しく、PubMedで「analgestic nephropathy+ ethenzamide」で検索しても全く論文はヒットせず、薬剤性腎障害の原因になるかどうかは現時点ではわからない。

ただし上述のようにこれらの配合鎮痛薬の大量連日服用、それも最低5年は連日大量服用して50歳代~60歳代になって発症するということは日本で鎮痛薬腎症を見つけること自体が難しそうであり、本当に数年にわたりこれらを連日服用していればやめるように勧告したいが、皆保険制度の日本でこのような症例に出会うことはないのではないかとも思ってしまう。
やはり腎機能低下患者にはカロナールⓇが第一選択であり、アスピリンとの併用は避けよう
そろそろ結論に移ろう。今まで私は腎機能低下患者にはNSAIDsを漫然投与してはいけない。可能な限りNSAIDsは頓服として投与し、腎虚血リスクの高い患者(CKD、心不全、高血圧、糖尿病、RAS阻害薬、利尿薬服用患者など)には漫然投与は絶対に避けよう。そのような症例には十分量のアセトアミノフェンを使用しよう。効果がなければ外用パップ剤を併用しよう。痛みが強ければ弱オピオイドに使用もやむなし。という腎臓保護スタンスをとってきた。また米国腎臓財団が腎機能の低下した症例には優先的にアセトアミノフェンを使うことを推奨したため、優先的に投与されるアセトアミノフェンで透析導入に至るという報告はそれ自体がバイアスが強くかかっていると言ってきた。今回の調査でアセトアミノフェン単独使用は腎障害の原因にならない可能性がより強くなった。アセトアミノフェンは大量投与によって肝障害を起こす危険性があるが全般的にみて極めて安全性の高い薬剤である(表)。やはり腎機能低下した症例に推奨される鎮痛薬の第一選択薬はアセトアミノフェンであり、NSAIDsの漫然投与を避けるようやめようと声を大にして言いたい。またカロナールⓇとアスピリンの長期連日服用は鎮痛薬腎症の原因になりうることに留意されたい。
表.アセトアミノフェンの長所
 引用文献
引用文献
1)Elseviers MM, De Broe ME: Analgesic nephropathy: is it caused by multi-analgesic abuse or single substance use? Drug Saf. 1999 Jan;20(1):15-24.
2)Elseviers MM, De Broe ME: Is analgesic nephropathy still a problem in Belgium?Nephrol Dial Transplant. 1988;3(2):143-9.
3)Duggin GG: Combination analgesic-induced kidney disease: the Australian experience. Am J Kidney Dis. 1996 Jul;28(1 Suppl 1):S39-47.
4)Elseviers MM, Waller I, Nenoy D, Levora J, Matousovic K, Tanquerel T, Pommer W, Schwarz A, Keller E, Thieler H, et al. Evaluation of diagnostic criteria for analgesic nephropathy in patients with end-stage renal failure: results of the ANNE study. Analgesic Nephropathy Network of Europe. Nephrol Dial Transplant. 1995;10(6):808-14
5)Gault MH, Wilson DR: Analgesic nephropathy in Canada: clinical syndrome, management, and outcome.Kidney Int. 1978 Jan;13(1):58-63.
6)Rastegar A1, Kashgarian M: The clinical spectrum of tubulointerstitial nephritis. Kidney Int. 1998 Aug;54(2):313-27.
7)de Broe ME, Elseviers MM: Analgesic nephropathy–still a problem? Nephron. 1993;64(4):505-13.
8)Gault MH, Barrett BJ: Analgesic nephropathy. Am J Kidney Dis. 1998 Sep;32(3):351-60.
9)Nanra RS: Analgesic nephropathy in the 1990s–an Australian perspective. Kidney Int Suppl. 1993 Jul;42:S86-92.
10)Disney AP: Demography and survival of patients receiving treatment for chronic renal failure in Australia and New Zealand: report on dialysis and renal transplantation treatment from the Australia and New Zealand Dialysis and Transplant Registry. Am J Kidney Dis. 1995 Jan;25(1):165-75.
11)Barrett BJ: Acetaminophen and adverse chronic renal outcomes: an appraisal of the epidemiologic evidence. Am J Kidney Dis. 1996 Jul;28(1 Suppl 1):S14-9.
12)Sandler DP1, Smith JC, Weinberg CR, Buckalew VM Jr, Dennis VW, Blythe WB, Burgess WP: Analgesic use and chronic renal disease. N Engl J Med. 1989 May 11;320(19):1238-43.
13)Perneger TV1, Whelton PK, Klag MJ: Risk of kidney failure associated with the use of acetaminophen, aspirin, and nonsteroidal antiinflammatory drugs. N Engl J Med. 1994 Dec 22;331(25):1675-9.
14)Porter GA: Acetaminophen/aspirin mixtures: experimental data. m J Kidney Dis. 1996 Jul;28(1 Suppl 1):S30-3.
薬剤師サロン メール問合せより~CHDF時の抗菌薬投与~
【 問い合わせ内容 】
医師からの問い合わせが多く、よく困っているのがCHDF(continuous hemodiafiltration)持続的血液透析濾過)の患者の抗菌薬、特にバンコマイシンの投与量に関してです。メーカーに問い合わせをしたり、他にいろいろ調べたりしていますが、的確な回答が出来ていない現状があります。条件によって、大きな差がでてくるので一概に「この投与量を推奨します」というのは難しいと思いますが、CHDF患者の抗菌薬の投与量はサンフォードのCRRTの用量を用いればいいのでしょうか?あるいは無尿の患者であれば透析患者と同じで用量でよいのでしょうか?
【 回 答 】
透析クリアランスはCCr5~10mL/minの患者と同等
おっしゃる通り、CHDFの場合、施行条件によって、薬物除去率に大きな差がでてくるので一定の薬物投与量を提示することは困難です。米国など血流量100~150mL/minでやっている場合もあり(表1)、そんなデータを引用しては抗菌薬の除去率を過大評価し、過量投与の原因になります。
表1.血液透析とCHDFの施行条件の日本と海外の差
|
血流量(mL/min) |
透析液流量(mL/min) |
置換液流量(mL/min) |
透析時間 |
ダイアライザーの膜面積 |
||
|
血液透析HD |
日本 |
200 |
500 |
0 |
4hr×3回/週 |
大きい |
|
海外 |
360 |
700 |
0 |
4hr×3回/週 |
大きい |
|
|
持続的血液透析濾過CHDF |
日本 |
80~120 |
7~10 |
5~8 |
24hr以上 |
小さい |
|
海外 |
140~150 |
14~24 |
14~24 |
24hr以上 |
小さい |
血液透析(HD)は透析液流量よりも血流量が低いため、より小さい方のクリアランス以上は得られないので、血流量がHDクリアランスを決定する最も大きな要因になります。小分子量物質のHDクリアランスは血流量と相関します。通常の透析では分子量113と非常に小さいクレアチニンで200mL/minの血流量で回した場合、150mL/min程度のクリアランスになり、分子量がもっと小さい尿素(MW60)のHDクリアランスは180mL/min程度のクリアランスが得られます。ただし週に4時間×3回しか稼働しないため、尿素クリアランスは12.8mL/min、CCrは10.7mL/minと計算されますが、一般的な薬物の分子量は200dalton以上で、ある程度のタンパク結合を考慮すると、5~10mL/min程度のクリアランスしかないと考えられます。実際、透析患者の至適投与量はCCr10mL/min未満の患者と同じとされています。
CHDFクリアランスは無尿患者でサブラッド20L/日仕様の場合、CCr14mL/minの患者と同様
CHDF時の薬物の血液浄化法による抗菌薬の除去については、さまざまな文献がありますが、それぞれ血液浄化方法が異なり、一律にまとめることができません。欧米では透析液流量+置換液流量が20~40mL/minと日本よりもかなり高い条件で24時間以上の持続的血液透析(CHD)、CHF(持続的血液濾過)、CHDF(持続的透析濾過;これらを総称してCRRT:持続的腎代替療法 continuous renal replacement therapyと言います)が行われることがあり、末期腎不全患者であっても血清Cr値が3mg/dL未満に保たれており、βラクタム系の抗菌薬などはほとんど減量の必要がないこともあります。しかし日本のCHDFは海外に比し血流量、透析液流量ともかなり低めですので(表)、海外の文献データの至適投与量を用いると過量投与になってしまいます。ただしやサンフォードガイドではバンコマイシンのCRRTの至適用量は500mgを24~48時間毎と少な目の投与量になっており、意外と日本のCHDFに適しています。ちなみに日本化学療法学会の抗菌薬TDMガイドライン2015では「CHDF患者に初回は25-30 mg/kg(実測体重)を投与し、以降の維持量は1回500 mg(7.5-10 mg/kg)を24時間毎に投与し、適宜TDMで調節する」となっており、ほぼサンフォードガイドよりも多めの投与量が推奨されています。
またCHDFは急性膵炎など腎機能正常者に対して炎症性サイトカインを吸着除去するために行われることもあるため、常用量以上の投与量が必要なこともあります。ただし使用している置換液(サブラッドⓇBなど商品名が違っていてもOK)の量とCHDFクリアランスはほぼ一致します。20L/日なら例えば20L/日(約14mL/min)のCCrになります。なぜならサブラッドⓇを使って補液しているということは補液した量とほぼ同じかそれ以上の限外濾液量が出てきます。その限外濾液中Cr濃度は血清Cr濃度と等しいからです。血清中でCrは血漿タンパクと全く結合していない小分子量物質だから当然ですね。
それからサブラッドⓇの一部は透析液としても使いますが、日本のHDの透析液流量は500mL/minですが、CHDFの透析液流量ははるかに少ない量(7~10mL/min)なので、透析液廃液中Cr濃度と血清Cr濃度は等しくなります。ということは透析液と補液(併せて総廃液量)として1日20L使っていればクレアチニンに関しては1日当たり血清20Lを完全に浄化しているということになりますので20L/日(14mL/min)がCCrになります。ということはHDよりもCHDFのほうがクリアランスが高いため、薬物除去率も高く、抗菌薬もHD患者よりも多めの投与量が必要になります。ただし輸液スペースを確保し、溢水を防ぐため総廃液量が22LになるようなCHDFを施行すると22L/日(15.3mL/min)がCHDFクリアランスになります。つまりCHDFをやっている患者さんが無尿で腎機能が全くなかったとしてもCHDFがCCr14~15mL/minの保存期腎不全患者さんの腎機能と同じ腎機能を肩代わりしてくれているということになります。
投与設計ではCHDF患者の腎機能も考慮する
ということはCHDFによるCCrは14~15mL/minになり、その人が無尿であればCCrが14~15mL/minの人と同じ投与量をすればよいことになります。しかし患者の腎機能が無尿ではなく20mL/minであれば、34~35mL/minの保存期CKD患者と同じ投与量にすればよいということになります。つまりシミュレーションは非常に簡単で、無尿の患者さんで除水をしなければシミュレーションソフトの患者の腎機能にCCr14mL/minを代入すればよいわけです。ただし患者に残腎機能が残っておればそれを足せばよいのです。患者の腎機能が16mL/minであればこの人の腎機能はCHDFをやっている間は14+16mL/minで30mL/minにクリランスがアップしていると考えればよいのですからCCrが30mL/minの人と同じ投与量をすればよいことになります。
このようにCHDFのクリアランスを予測することはサブラッドⓇの使用量が分かれば簡単です。もしもCHDF患者がずっと同じメニューのCHDFをやっていて、患者の腎機能が安定しており、4~5日経過していれば患者の血清クレアチニン値は定常状態になっているためeGFRを算出して、あるいはCockcroft-Gault式からCCrを算出して、その値をシミュレーションソフトの意腎機能に入力してみても大過ないと思われます。
患者の腎機能の変動には要注意
ただしCHDFをやっている人の腎機能は容易に変動するからそう簡単にはいかないというのは確かです。その場合は最初の腎機能に応じた投与量にして予測血中抗菌薬濃度よりも高くなっていれば減量し、予測血中抗菌薬濃度よりも低くなっていれば増量するなどで試行錯誤するしかありませんが、腎機能が安定すれば、その時の至適投与量に当てはまる腎機能からCHDFクリアランス14mL/minを差し引いたものがこの患者の腎機能と予測されます。
CHDF施行時の薬物投与量については腎臓病薬物療法専門薬剤師テキストに古久保先生1)が書いていますし、山本武人先生2)がより詳しい総説を書いており、私も総説を最近書きました3)ので参考にしてください。
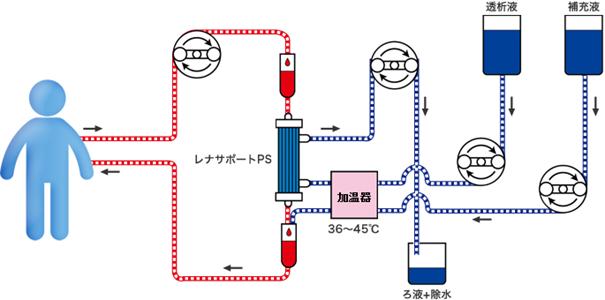
図1.CHDFの方法
CHDFクリアランスは に規定されます。透析液流量は非常に小さいため、透析液の廃液中薬物濃度は血中遊離型薬物濃度と近似し、限外濾液濾液中薬物濃度も血中遊離型薬物濃度と近似するためです。
まとめ
①CHDFのクリアランスはHDクリアランスより小さいがHDは週に12時間しか施行しないためトータルで見るとCHDFクリアランス(サブラッドⓇBを20L/minを使用した場合には14mL/min)はHDクリアランス(通常5~10mL/min)よりも高いため、透析患者の至適投与量では投与量不足になります。
②海外のCHDF(厳密にいうと国によって持続的血液浄化法CRRTのやり方は異なる)は日本に比べクリアランスが大きいため、海外文献やサンフォードガイドを参考にすると日本のCHDF患者では過量投与になります。
③通常、日本では1日20Lの補液が使われているということは患者が無尿で除水も行っていなければ20L/日、つまり14mL/minのCCrの保存期腎不全患者への至適投与量と同じ投与量にすればよいのです。残腎機能があればその腎機能に14mL/minを加えたものがCHDF施行中の患者の腎機能としてシミュレーションソフトに代入してもよいです。
④抗菌薬のタンパク結合率が90%以上と高い、あるいは分布容積が2L/kg以上と大きければ血液透析HDでは除去できません。しかしCHDFでは組織に分布した薬物がゆっくりと除去される可能性があるため、分布容積が2L/kg前後の薬物でも除去される可能性があるかもしれませんが、タンパク結合率が90%以上と高い薬物はやはり除去できません。
参考文献
1)山本武人, 他: CRRT中の薬物投与量 抗菌薬の投与設計を中心として. INTNSIVIST 2: 329-345, 2010
2)古久保 拓: 透析患者の薬物投与設計⑤透析方法による薬物除去の違い. 腎臓病薬物療法専門・認定薬剤師テキストP219-225, じほう, 東京, 2013
3)平田純生: 急性血液浄化施行中の投薬管理. 急性血液浄化法徹底ガイド第3版, 救急・集中治療 26(3, 4): 471-479, 2014
こんな問題出していいのか!:第100回薬剤師国家試験(2015年)

今年の国家試験を見ていてとんでもない問題が出ているので驚きました。す。それは問334です。じっくり見てください。
第100回薬剤師国家試験問題(2015年
問334
65歳男性。体重72kg。非弁膜症性心房細動との診断で下記の処方薬を服用していた。数日前から、めまい、ふらつき、冷汗、手の震え、軽度の意識障害にて昨日入院となった。本日病室を訪問した薬剤師は、下記の処方薬を日頃欠かさず服用していたことを付添いの家族から聴取した。また、カルテから入院時検査結果が血清クレアチニン値は2.0mg/dL、BUN は39mg/dL、空腹時血糖は40mg/dLであることを確認した。
シベンゾリンコハク酸塩錠100mg 1回1錠(1日3錠)
ベラパミル塩酸塩錠40mg 1回1錠(1日3錠)
ニコランジル錠5mg1回1錠(1日3錠) 1日3回 朝昼夕食後
ダビガトランエテキシラートカプセル110mg 1日1カプセル(1日2カプセル)
ニフェジピン徐放錠10mg (12時間持続) 1回1錠(1日2錠)1日2回 朝夕食後担当の薬剤師は、入院時の不快症状と検査値から薬の副作用を疑い、医師に薬剤の変更を提案しようと考えた。該当する薬剤はどれか。1つ選べ。
1 シベンゾリンコハク酸塩錠
2 ベラパミル塩酸塩錠
3 ニコランジル錠
4 ダビガトランエテキシラートメタンスルホン酸塩カプセル
5 ニフェジピン除放錠
まず血清クレアチニン値は2.0mg/dL、BUN は39mg/dLであることから明らかに腎不全。腎機能低下による有害反応は肝代謝型薬物のベラパミル塩酸塩錠、ニコランジル錠、ニフェジピン除放錠では起こりません。これで選択肢は1か4になります。だけどどちらも超ハイリスク薬です。
ただし起こった有害反応は「めまい、ふらつき、冷汗、手の震え、軽度の意識障害」しかもご丁寧に空腹時血糖は40mg/dLとくれば、問題なくシベンゾリンコハク酸塩錠が正解になるはずです。比較的やさしい問題だけど、ダビガトランエテキシラートも腎排泄でCCr<30mL/min未満の患者には禁忌です。じゃあ念のためにCCrを計算してみましょう。CCrの計算にはCockcroft-Gault式を用いればいいですね。体重は計算しやすいように72kgになっています。
推算CCr={(140-年齢)×体重×0.85(女性)}/(72×血清Cr値)
={(140-65)×72×0.85(女性)}/(72×2.0)=37.5mL/min
CCrが30以上あるから投与しても問題ない・・・・
じゃないです!腎排泄型のハイリスク薬は腎機能の推算結果だけで投与の可否を簡単に線引きしちゃいけません!
ダビガトランは2011年にワルファリン以来50年ぶりに発売された新規経口抗凝固薬ですが尿中排泄率85%と非常に高い薬物であるため、発売後半年間に、腎機能の低下した高齢者が23名出血死した超ハイリスク薬です。
添付文書を見ると腎機能正常者に比べCCr<30mL/minの重度腎障害患者ではAUCが6.3倍、半減期が13.4hrが27.2hrに延長しています。ということから「透析患者を含む高度の腎障害(クレアチニンクリアランス30mL/min未満)のある患者では本剤は主に腎臓を介して排泄されるため、血中濃度が上昇し出血の危険性が増大するおそれがあるため投与禁忌」になっています。
AUCが6.3倍になるのならCCr<30mL/minでは常用量の1/6以下の50mg/日以下にすべき薬ですが禁忌になってますが、CCrが30mL/minであれば220mg/日投与できるのです。ハイリスク薬なのに大胆すぎる投与設計なので怖い感じがしています。それとCockcroft-Gault式をよーく見直してください。これって体重が2倍になると腎機能は2倍に推算されちゃいますよね。
推算CCr={(140-年齢)×体重×0.85(女性)}/(72×血清Cr値)
つまりCockcroft-Gault式は肥満を考慮していないので図に示すように体重の影響を強く受けます。
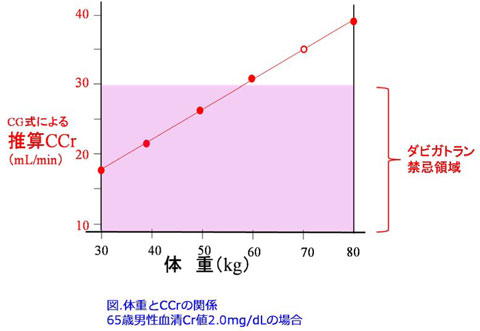
ということはこの患者の身長は不明ですが、本来は肥満患者では身長から理想体重をを算出して入力すべきです。160cmだったら理想体重は56.88kgになり、腎機能は29.63mL/minに計算され禁忌になります。150cmだとしたら理想体重は47.83kgになり、腎機能は
24.91mL/minに計算されます。非常に危ない投与になります。
処方をもう1度見直してもらえますか?相互作用は考えられないでしょうか?心房細動では当たり前のように併用されるレートコントロール薬のベラパミルが投与されています。ベラパミル錠は120mg/日をジゴキシンと併用するとおそらくジゴキシンの血中濃度は1.5倍になるため、私が薬剤師時代には、あらかじめジゴキシンの投与量を2/3に減量することを医師に提言してからベラパミルを投与してもらっていました。そうです。ベラパミルにはP-糖タンパク阻害作用があり、ジゴキシンもダビガトランもP-糖タンパク質の基質なのです。ではダビガトランの添付文書の記載を見てみましょう。
以下の患者では、ダビガトランの血中濃度が上昇するおそれがあるため、本剤1回110mg1日2回投与を考慮し、慎重に投与すること。
・中等度の腎障害(クレアチニンクリアランス30-50mL/min)のある患者
・P-糖蛋白阻害剤(経口剤)を併用している患者[「慎重投与」、「重要な基本的注意」、「相互作用」の項参照]
以下のような出血の危険性が高いと判断される患者では、本剤1回110mg1日2回投与を考慮し、慎重に投与すること。
・70歳以上の患者
・消化管出血の既往を有する患者
ご覧のように「70歳以上の患者は出血の危険性が高いため、本剤1回110mg1日2回投与を考慮し、慎重に投与すること」ということも添付文書に書かれていますが、本症例は65歳です。これも安易に線引きしていると思いませんか?それから「中等度の腎障害は220mg/日に減量」かつ「P-糖タンパク質阻害剤(経口剤)を併用している患者は220mg/日に減量」の患者には何mgにすべきでしょうか?220mg/日でよいはずはなく、これは投与禁忌と考えるべきでしょう。
さらにさらに、カナダの添付文書では日本と同じくCCr<30mL/minは禁忌になっています(なぜか米国は減量して投与可能)。ただし日本の血清Cr値は正確な酵素法により測定しているためCCrの正常値は120-130mL/minであるのに対し、血清Cr値が酵素法より0.2高いJaffe法によって測定している国のCCrの正常値は100mL/minです。すなわち海外でCCr<30mL/minで禁忌なら30mL/minをやや超えている日本の症例も明らかに禁忌と考えるべきです。
私はここで減量・投与すべきでないことばかり書きましたが、経口抗凝固薬は投与量を少なすぎて出血が起こらなければよいという種類の薬ではありません。致死的な血栓症を抑えなくては意味がありません。つまりこの薬の有効治療域は「出血と梗塞の間」なのです。多すぎても少なすぎてもダメで、上手にコントロールする必要があります。
経口抗凝固薬は超ハイリスク薬です。腎機能が低下すると同様に血中濃度が上昇するアレグラⓇやセフゾンⓇのような安全性の高い薬物とは一緒にしてはいけません。CCrが30mL/minあれば投与できる、29mL/minでは投与してはいけない、あるいは69歳だったら300mg/日、70歳なら220mg/日というような簡単に線引きができる薬でもありません。
いずれにしてもこの問題が過去問として国家試験対策用の問題集に載り、薬学生だけでなく薬剤師までもが、「国家試験に出るくらいだからダビガトランやティーエスワンⓇはCCrが30mL/min以上なら何も考えずに投与しても問題ない。相互作用も重要じゃないんだ」と思ってしまうことを予想するとぞっとしてしまいます。
ロキソニンのネット販売について思う
 2013年11月20日CKDチーム医療研究会での佐中孜先生(社会福祉法人仁生社江戸川病院生活習慣病CKDセンター長、元東京女子医科大学東医療センター腎臓内科教授)と話して
2013年11月20日CKDチーム医療研究会での佐中孜先生(社会福祉法人仁生社江戸川病院生活習慣病CKDセンター長、元東京女子医科大学東医療センター腎臓内科教授)と話して
佐中先生:「平田先生、OTC薬のネット販売、この中にはロキソニンSというNSAIDも入っているけど、どう思うかね?」
平田「まあ、離島の人もいますからね。必要性はあると思います。」
佐中先生「しかしOTC薬といっても痛みのある高齢者が毎日、ロキソニンSを3錠、欠かさず飲んだらどうなります?」
平田「高齢者だと虚血腎になり、腎機能が低下しますね。私も透析導入になった人の導入原因を探していると、腎炎も糖尿病もない、悪性の高血圧もない。なんでこの人は透析導入になってしまったのだろうと調べてみると、整形外科の処方のNSAIDを2~3か月毎日飲んだために急性腎障害になって、それが慢性化したということはよく経験しましたね。高齢者の膝関節症などで単なる痛みどめ目的で、いきなりロキソニン3錠を30日分投与して、血清クレアチニンをモニターしないのは問題ですね。」
佐中「多くの腎臓内科医や透析専門医が経験していることです。特にNSAIDを2~3か月毎日連用した人が『最近食欲がなくて全身倦怠感がある』と訴えて内科医へ受診したときには『透析しなくちゃいけない』ってことはよく経験します。」
という話をした。
高齢者だけならまだしも、高齢者でACE阻害薬やARBなどのレニン-アンジオテンシン系阻害薬や利尿薬を服用している患者(これらも腎虚血原因薬物)、高血圧患者・糖尿病を合併した患者(動脈硬化を併発し腎不全になりやすい)ではNSAIDsを連日服用すると急性腎障害になってしまう患者は必ず現れます。
1回のネット販売量を規制し、連続した購入を規制できるシステムができたとしても楽天とDeNA、アマゾンと3社から同時購入した場合、相互のチェック機能がない限り、ロキソニンSのようなNSAIDをネット販売することは、非常に危険だ。
ガスター10でも腎機能が低下している人が胃がよくならないからといって1日2錠飲むと汎血球減少を起こすことがあることはよく知られた話です。適正使用しなければ生命を脅かす可能性のあるOTC薬はほかにもあるはずです。
適切な情報も与えられずにネット販売で購入したOTC薬によって死に至ったら、楽天の三木谷社長は全責任を取ってくれるのでしょうか?
離島や無医村の人たちのことを考えると私は必ずしもOTC薬のネット販売に反対ではありません。しかし腎臓病薬物療法学会理事長として、適正な情報なしに腎機能を悪化させる薬や、腎機能の低下した方が中毒性副作用を起こす可能性のある薬をモニターできる体制ができていないまま、他社から少しずつ購入できて、結局いくらでも購入できるシステムであれば問題と考えます。「何か体調に変化があったらすぐに薬局に問い合わせてくださいね」という対面販売はやはり必要だと考えます。


