2020年9月
◆連載◆クロストリディオイデス・ディフィシル(CD)腸炎について考える 第9回 前編
1.クロストリディオイデス・ディフィシル(CD)腸炎・偽膜性大腸炎とバンコマイシンのTDM
(1)はじめに
今回は抗菌薬関連下痢症・細菌性腸炎の原因菌として最も重要なクロストリディオイデス・ディフィシル感染症Clostridioides difficile(CD)腸炎について我々の経験した症例について解説したい。これも腸内細菌叢の変化が大きく関わる疾患である。なおCDは2016年まではクロストリジウム・ディフィシルと呼ばれていた有芽胞偏性嫌気性グラム陽性桿菌で下痢、腹痛、発熱を伴うCD腸炎や偽膜性大腸炎、あるいは麻痺性イレウスや巨大結腸症発症、腸管穿孔の主要な原因菌とされ、健康成人でも日本人で10~50%前後の糞便から検出され、もともと弱毒菌で菌量が少なければ健常者には病原性はないが、菌量が増えてトキシンA、トキシンBという外毒素を産生すると、腸炎を引き起こす。傷口から感染しやすい破傷風菌 (C. tetani )、真空パックの食品内部でも増殖して食中毒の原因になるボツリヌス菌 (C. botulinum )、常在菌だが毒素を産生して食中毒の原因になり、ガス壊疽菌を起こすことがあるウェルシュ菌 (C. perfringens )などは今まで通りClostridium属である。
(2)症例1)
68歳、体重56.8kgの男性透析患者で原疾患は糖尿病。肛門周囲膿瘍のため入院し、セフォチアムに次いでクリンダマイシン+セフタジジムが投与された。第23病日に発熱、白血球数29,190/μL、CRPが20mg/dLを超え、大腸ファイバーにて著明な偽膜*(図1左)の形成、CD抗原を認めたため、抗菌薬投与を中止し、バンコマイシン(VCM)散0.5gを1日4回、経口投与された。翌日よりメトロニダゾール250mg、1日2回を経口投与後、8日目にCD抗原は消失し投与10日目には内視鏡にて偽膜形成の減少が観察された(図1中)。しかし下痢症状の改善があまりみられなかったことから、36病日(VCM投与14日)に血漿VCM濃度の測定を依頼すると51.98μg/mLと異常高値であり、便培養でCDが検出されなかったためVCMの投薬を中止して経過を観察した。37病日には58.74μg/mL(経口VCM投与後では当時の世界記録)と非常に高値を示した。 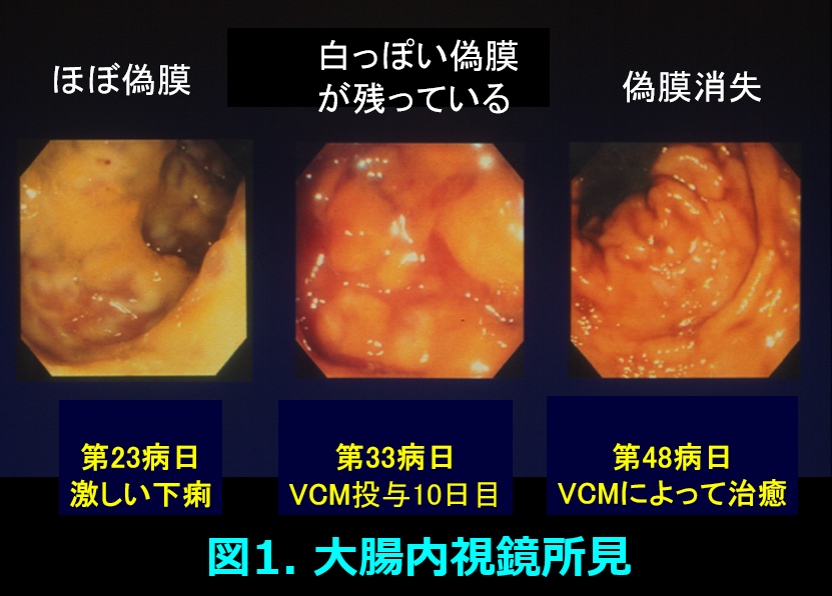 投与中止後6.56μg/mlにまで血漿濃度が低下するのに27日間を要し、この間のVCMの消失半減期は158時間であり、Vdを0.956L/kgとしてクリアランスを算出するとClearance =(ln2×Vd)/t1/2 =(0.693×0.956×56.8×1000)/158×60=3.97mL/minと透析患者のVCMクリアランスが非常に低いことも解明された。さらに158時間という半減期から58.7μg/mLという濃度は完全に定常状態に達しているわけではないが、バイオアベイラビリティ(この場合、吸収率)=Clearance×steady state serum VCM level/ VCM dose= (3.97×58.7)/{2.0×1,000,000/(24×60)}=0.1678となり、吸収されるはずのないVCMが偽膜という腸管炎症所見が強い場合、少なくとも16.78%が吸収されたと考えられた。これはCDトキシンが腸管上皮の緻密結合tight junctionを傷害してバリア機能が破綻したために、吸収されるはずのないVCMが吸収されたものと考えた。VCMの中毒反応は腎障害や聴覚障害が知られているが、腎機能の廃絶したこの症例には有害反応は見られなかった。48病日には偽膜は完全に消失した(図1右)。
投与中止後6.56μg/mlにまで血漿濃度が低下するのに27日間を要し、この間のVCMの消失半減期は158時間であり、Vdを0.956L/kgとしてクリアランスを算出するとClearance =(ln2×Vd)/t1/2 =(0.693×0.956×56.8×1000)/158×60=3.97mL/minと透析患者のVCMクリアランスが非常に低いことも解明された。さらに158時間という半減期から58.7μg/mLという濃度は完全に定常状態に達しているわけではないが、バイオアベイラビリティ(この場合、吸収率)=Clearance×steady state serum VCM level/ VCM dose= (3.97×58.7)/{2.0×1,000,000/(24×60)}=0.1678となり、吸収されるはずのないVCMが偽膜という腸管炎症所見が強い場合、少なくとも16.78%が吸収されたと考えられた。これはCDトキシンが腸管上皮の緻密結合tight junctionを傷害してバリア機能が破綻したために、吸収されるはずのないVCMが吸収されたものと考えた。VCMの中毒反応は腎障害や聴覚障害が知られているが、腎機能の廃絶したこの症例には有害反応は見られなかった。48病日には偽膜は完全に消失した(図1右)。
下痢症状は改善したが、57病日(VCM投与中止24日目)に気管支炎を発症したため、レボフロキサシン投与を行ったところ、下痢・発熱の再発がみられ、再びCD抗原が認められた(図2)。VCM再投与に至ったが、VCMの血漿濃度は一貫してCDのMICである0.78μg/mlを大きく上回っていたにもかかわらず、腸炎が再発したため、血中から腸管内へのVCMの移行は不良な可能性が示唆された。以上のことから、血液透析患者にVCM散を長期投与する際には血中漿濃度モニタリングを行う必要性があると思われた。 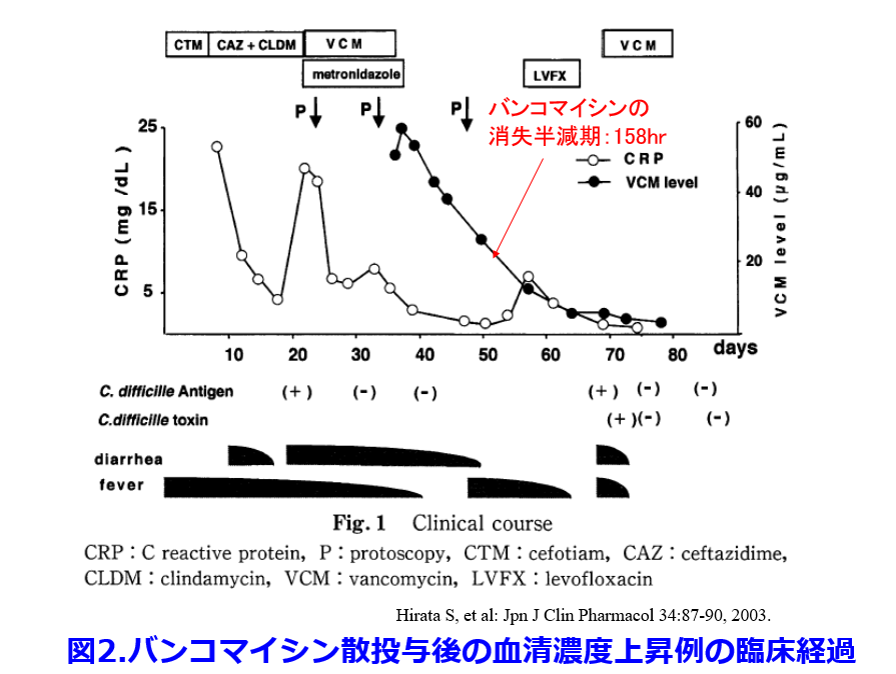 偽膜:大腸粘膜膜表面に血漿内のフィブリンや好中球、粘液などの炎症性物質が浸みだして凝固壊死して作られる膜のようなもの、わかりやすく言うとかさぶたのようなもの。CDだけでなく赤痢菌やカンジダなどによっても形成される。正常な大腸はオレンジ色に見えるが、偽膜は黄白色の扁平あるいは半球状の低い隆起をなす。
偽膜:大腸粘膜膜表面に血漿内のフィブリンや好中球、粘液などの炎症性物質が浸みだして凝固壊死して作られる膜のようなもの、わかりやすく言うとかさぶたのようなもの。CDだけでなく赤痢菌やカンジダなどによっても形成される。正常な大腸はオレンジ色に見えるが、偽膜は黄白色の扁平あるいは半球状の低い隆起をなす。
(3)その後の院内アウトブレイク
この症例が治癒後、院内感染によってCD腸炎患者は同じ病棟内で合計16名となったが、全員が発症前に抗菌薬を投与されており、抗菌薬の併用はCD感染症の治癒率を低下させることが明らかになっている2)。H2ブロッカーのファモチジン、ラニチジン、プロトンポンプ・インヒビター(PPI)のランゾプラゾールといった胃酸分泌抑制薬9名および制酸薬服用者3名で16名中12名(75%)で、同施設内の全透析患者における38.3%に比べ高かかったことから、胃酸抑制が腸炎の発症に関与している可能性が考えられた。さらにある大学に依頼したCDの遺伝子検査結果によると全員が初発の偽膜性腸炎患者と同じCDであり、16名全員が院内感染であることが判明した。
経口VCMの推奨量は0.5-1g/日の7-10日投与(添付文書用量は1回0.125~0.5gを1日4回)で、Keighleyら3)は0.125gの4回/日投与で十分な便中濃度を保ったとしている。本症例は重篤であったため、1日2.0gの投与に踏み切ったが、CD感染に対してVCMの大量投与は腸内細菌叢を崩壊する可能性があるため、少量の方がよかったかもしれない。
(4)クロストリディオイデス・ディフィシル(CD)腸炎とは
抗菌薬投与によってCDが異常増殖し、免疫能の低下した高齢者・手術侵襲・TPNによる粘膜退行・腸虚血・血圧低下などの要因が加わると激しい腸炎を発症することがある。ただし通常の状態では他の常在菌の存在がCDの増殖を抑制しているため、CDの菌数は糞便中102/g以下と少なく、毒素を産生して病原性を発揮することはない。抗菌薬の投与による菌交替現象から腸内細菌叢microbiotaが撹乱され、CDの異常増殖が起こり105/g以上になると大量の毒素を産生してCD腸炎が起こる。偽膜性大腸炎はCD腸炎の重症型であり、トキシンによる大腸の炎症粘膜に壊死白血球が集まって偽膜を形成する。CDは芽胞*(図3)を形成するためエタノール消毒でも死なないし、胃酸によっても芽胞を形成している場合は死滅せず、小腸に移行して嫌気性下になると発芽する。免疫能の低い透析患者や超高齢者の病棟では接触感染によって院内感染が起こるとCDトキシンによる腸炎によって重篤な下痢を起る患者が増える始末が悪い菌になる。 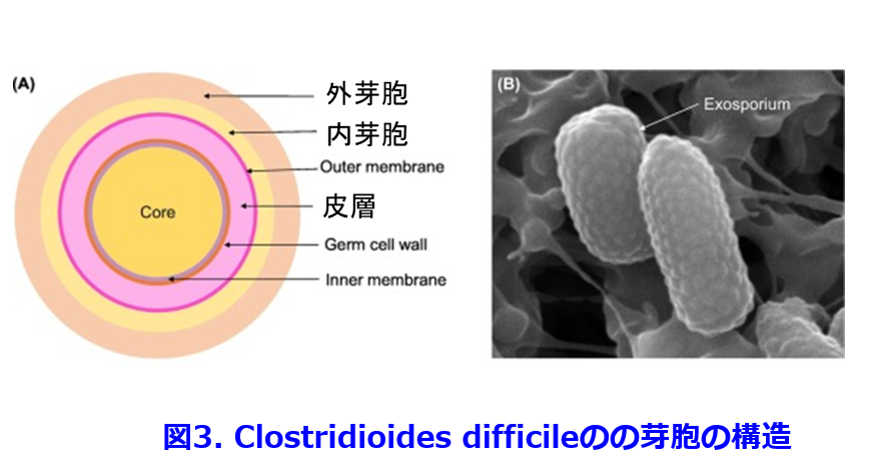 芽胞:ある種の細菌は乾燥や高温、酸や化学物質、紫外線などで環境条件が悪くなると芽胞とよばれる耐久器官を作って生きのびる。この芽胞を形成する菌で好気性の細菌をBacillus属,嫌気性の細菌をClostridium属と呼ぶ。芽胞形成菌であっても周りの環境が生存に適するようになると栄養型になって発芽し分裂増殖を始める。芽胞は代謝が行われていない仮死状態で生物活性がほとんど見られなくなる。
芽胞:ある種の細菌は乾燥や高温、酸や化学物質、紫外線などで環境条件が悪くなると芽胞とよばれる耐久器官を作って生きのびる。この芽胞を形成する菌で好気性の細菌をBacillus属,嫌気性の細菌をClostridium属と呼ぶ。芽胞形成菌であっても周りの環境が生存に適するようになると栄養型になって発芽し分裂増殖を始める。芽胞は代謝が行われていない仮死状態で生物活性がほとんど見られなくなる。
引用文献
1) Hirata S, et al: Jpn J Clin Pharmacol 34:87-90, 2003.
2) Mullane KM et al : Clin Infect Dis Sep 1; 53:440, 2011
3) Keighley MR, et al: Brit Med J 2: 1667-1669, 1978
◆連載◆吸収率の低い第3世代経口セフェムってこんなに必要? 第8回
1.腸内細菌叢の異常によっておこる様々な疾患が増えている
筆者が小学生のころの1960年代前半に友人で喘息、アトピー、花粉症を持っていることを見たことも聞いたこともなかった。そして20年後、筆者が父親になった1980年代に恵まれた2人の子はともにアトピー性皮膚炎、それが治るとアレルギー性鼻炎や喘息になったし、同学年の子供たちの約半数がこのようなアレルギーマーチになっていたように記憶している。このたった20年間に何が変わったのであろうか?食事の内容が豊かになり、内容が欧米化したことや化学物質が増えたことなどがとりざたされている。 一般的な風邪のほとんどはウイルス感染であり、抗菌薬は効果がないことからも、不要な抗菌薬の使用は避ける必要があるのだが、これらに対して経口抗菌薬を気軽に処方することも原因ではないだろうか?
一般的な風邪のほとんどはウイルス感染であり、抗菌薬は効果がないことからも、不要な抗菌薬の使用は避ける必要があるのだが、これらに対して経口抗菌薬を気軽に処方することも原因ではないだろうか?
2019年の2月に腸内細菌叢に興味を持っていたのでアランナ・コリン著「あなたの体は9割が細菌微生物の生態系が崩れはじめた」(図1)という非常に興味深い本を読んだ。第2次世界大戦後に抗菌薬が広く開発され、おかげでその当時の死亡率第1位、2位であった肺炎や結核などの感染症が著しく減少した。これは非常に喜ばしいことであったが、逆になぜか大腸がんやアレルギー性疾患や1型糖尿病やリウマチなどの自己免疫疾患、日本人には少なかった肥満やクローン病(欧米の1/10)や尋常性乾癬(日本で0.1%、世界で3%)、うつ病などの心の病なども大幅に増えたのだ(図2)。 そしてこれらのうち大腸がんを除くといずれも、なぜか若年発症の病気であり、これらに加えて生活習慣病と言われている2型糖尿病、CKD、心不全、脳卒中、高血圧、がんも増えたがこれらは小児期の過体重が原因と言われている。これらの病気の増加は欧米で始まったが、日本でも同様の現象が起こっているのはカロリー過多による肥満だけではなく、食事の欧米化によって日本人が古くから摂り続けてきた食物繊維や発酵食品の摂取不足が腸内細菌叢を変化させたことが原因ではないかと思うようになった。腸内細菌、あるいは小腸および大腸は人体における最大の免疫器官と言っても過言ではない。小腸の内側にある絨毛が未発達な場所にあるパイエル板は腸管免疫とよばれる、生体防御に関わる免疫機構において重要な働きを担っている。注意欠陥多動性障害ADHDや強迫性障害、双極性障害、統合失調症、自閉症、うつ病、パーキンソン病、認知症は免疫系の過剰反応による炎症が関係しているといわれている1)。有益な細菌を腸に加えると免疫系の過剰興奮を鎮める作用がある。
そしてこれらのうち大腸がんを除くといずれも、なぜか若年発症の病気であり、これらに加えて生活習慣病と言われている2型糖尿病、CKD、心不全、脳卒中、高血圧、がんも増えたがこれらは小児期の過体重が原因と言われている。これらの病気の増加は欧米で始まったが、日本でも同様の現象が起こっているのはカロリー過多による肥満だけではなく、食事の欧米化によって日本人が古くから摂り続けてきた食物繊維や発酵食品の摂取不足が腸内細菌叢を変化させたことが原因ではないかと思うようになった。腸内細菌、あるいは小腸および大腸は人体における最大の免疫器官と言っても過言ではない。小腸の内側にある絨毛が未発達な場所にあるパイエル板は腸管免疫とよばれる、生体防御に関わる免疫機構において重要な働きを担っている。注意欠陥多動性障害ADHDや強迫性障害、双極性障害、統合失調症、自閉症、うつ病、パーキンソン病、認知症は免疫系の過剰反応による炎症が関係しているといわれている1)。有益な細菌を腸に加えると免疫系の過剰興奮を鎮める作用がある。
もしも腸内細菌叢の変化がこのような病気を増やしているのだとしたら糖尿病、CKD、心不全、脳卒中、高血圧と言えば腎機能悪化と大きく関わってくるため、聞き流すわけにはいかない。これらの大きな原因は①食事で食物繊維を摂らなくなったから、②抗生物質が投与されて腸内細菌叢が変化したから、あるいは本書の指摘している③免疫系の発育に必要なのは古くから共生していた微生物のコロニー形成の異常 の3つに絞られるのではないだろうか。ヒトの体細胞は37兆個に対し、腸内細菌は重量では1kg程度であろうが、100~1000兆個ある。つまり、アランナ・コリンの「あなたの体は9割が細菌」の書名の意味は腸内細菌叢microbiotaを形成する細菌数が体細胞数の10倍あることを意味している。
腸内細菌叢を健全化すればO157, サルモネラ属菌、カンピロバクターなどの腸菅での細菌感染を防御してくれる。さらにプレバイオティクスである食物繊維をしっかり摂り、プロバイオティクスである発酵食品をしっかり摂取することによって、いわゆる善玉菌を増やして短鎖脂肪酸を産生し、結腸の蠕動運動を促進して大腸がんを防いでいる。男性では直腸がんが多いのに対し、女性では盲腸から下降結腸でも発症しやすいのは善玉菌の減少によっておこる便秘と関係しているからと言われている。がんの死亡率は男性の方が高いのだが、女性では第1位、男性は第3位であり、1975年以降40年で4倍以上に大腸がんは増えている(図3)。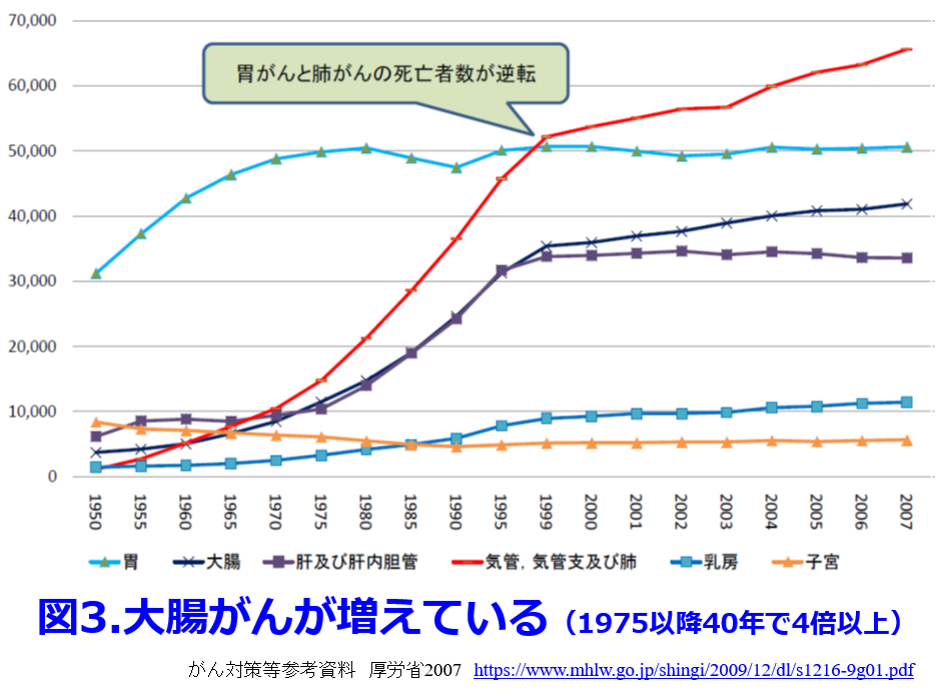 これは食事の欧米化・精製穀物の増加に伴い食物繊維摂取量が低下し腸内腐敗が進行しているためと言われている。
これは食事の欧米化・精製穀物の増加に伴い食物繊維摂取量が低下し腸内腐敗が進行しているためと言われている。
2.吸収率の低い第3世代経口セフェムはこんなにも必要?
そういえば筆者が子供の1960年ころ、大きな感染症にかかった時にはペニシリンGを臀部に筋注してもらっていた。経口抗菌薬があまり使われていなかった時代のことだ。ところが1980年代には様々な抗菌薬が登場した。抗菌薬シリーズの第1回で触れたが、第1世代よりも第2世代、第2世代よりも第3世代抗菌薬の方が薬価が高く定められており、このころはこのシリーズの第7回で述べたように薬価差が病院・製薬会社の利益になるため、製薬メーカーはこぞって第3世代の経口抗菌薬を開発し発売した。そして感染症にかかった小児に対してウイルス性疾患であり、効くはずのない風邪に対しても抗菌薬を投与したのであった。
早めに登場した経口抗菌薬の吸収率は概して高い。もともとβラクタム系抗菌薬は親水性が高いため、消化管の脂質二重層を通過できないはずだが、たまたま立体構造がアラニル-アラニンのようなジペプチド構造に似ていれば小腸上皮細胞に存在するペプチドトランスポータPEPT1の基質として認識されるため吸収される。おそらくペニシリン系のアンピシリン、アモキシシリン、第1世代セフェムのセファレキシン、セファクロルなどがこれらに相当し、これらの吸収率は概して高い(育薬に活用できるデータベース「3.薬効別分類表」にある「13.経口βラクタム系抗菌薬」参照)。そして問題となる第3世代セフェムはピボキシル基などをくっつけて脂溶性を高めて無理やり吸収率を上げさせたものばかりだ(図4)。 そもそも外来などの軽症例であればグラム陽性菌に効果のある第1世代抗菌薬が最も使う頻度が高いはずなのに、なぜこんなにたくさんの第3世代セフェムが必要なのかも理解できない。これらの第3世代セフェム系抗菌薬は吸収率が不明のものや、わかっていてもバイオアベイラビリティが50%以下のものが多い。これは効果が期待できないだけでなく耐性菌の増加に結びづく。吸収されなかった抗菌薬は糞便中に排泄されるが、この前に腸内細菌を殺菌してしまう。グラム陰性菌に強い第3世代セフェムだからグラム陰性菌の大腸菌も死滅するであろう。これによる腸内細菌叢の破壊が大問題なのだ。これらの抗菌薬が効かないクロストリディオイディス・ディフィシル菌Clostridioides difficile(2016年以降Clostridiumから名称変更;ミヤBMの宮入菌はClostridium butyricum のまま)を相対的に増殖させると、Clostridioides difficile腸炎や偽膜性腸炎という重症下痢症のリスクを高めることもあるが、今のところPubMed検索での報告は見当たらない。
そもそも外来などの軽症例であればグラム陽性菌に効果のある第1世代抗菌薬が最も使う頻度が高いはずなのに、なぜこんなにたくさんの第3世代セフェムが必要なのかも理解できない。これらの第3世代セフェム系抗菌薬は吸収率が不明のものや、わかっていてもバイオアベイラビリティが50%以下のものが多い。これは効果が期待できないだけでなく耐性菌の増加に結びづく。吸収されなかった抗菌薬は糞便中に排泄されるが、この前に腸内細菌を殺菌してしまう。グラム陰性菌に強い第3世代セフェムだからグラム陰性菌の大腸菌も死滅するであろう。これによる腸内細菌叢の破壊が大問題なのだ。これらの抗菌薬が効かないクロストリディオイディス・ディフィシル菌Clostridioides difficile(2016年以降Clostridiumから名称変更;ミヤBMの宮入菌はClostridium butyricum のまま)を相対的に増殖させると、Clostridioides difficile腸炎や偽膜性腸炎という重症下痢症のリスクを高めることもあるが、今のところPubMed検索での報告は見当たらない。
もっと大きな懸念は最初に書いたようにウイルス感染の風邪などに対しても、効かない経口抗菌薬を気軽に処方することによって腸内細菌叢が激変することによって今までは起こることのなかったアレルギー性疾患が増えてしまったのではないかということである。これに関しては英国ブリストル大学の報告で2歳までに抗菌薬を投与されていた小児は7.5歳になるまでに喘息(OR1.75: 95%CI 1.40-2.17)を発症する率が有意に高く、2歳までに4回以上投与された場合には、喘息(OR2.82: 95%CI 2.19-3.63)だけでなく湿疹(OR1.41: 95%CI 1.14-1.74)、花粉症(1.60 95%CI 1.21-2.10)などのアレルギー性疾患を発症するオッズ比が有意に高かったことが明らかにされている(表)2)。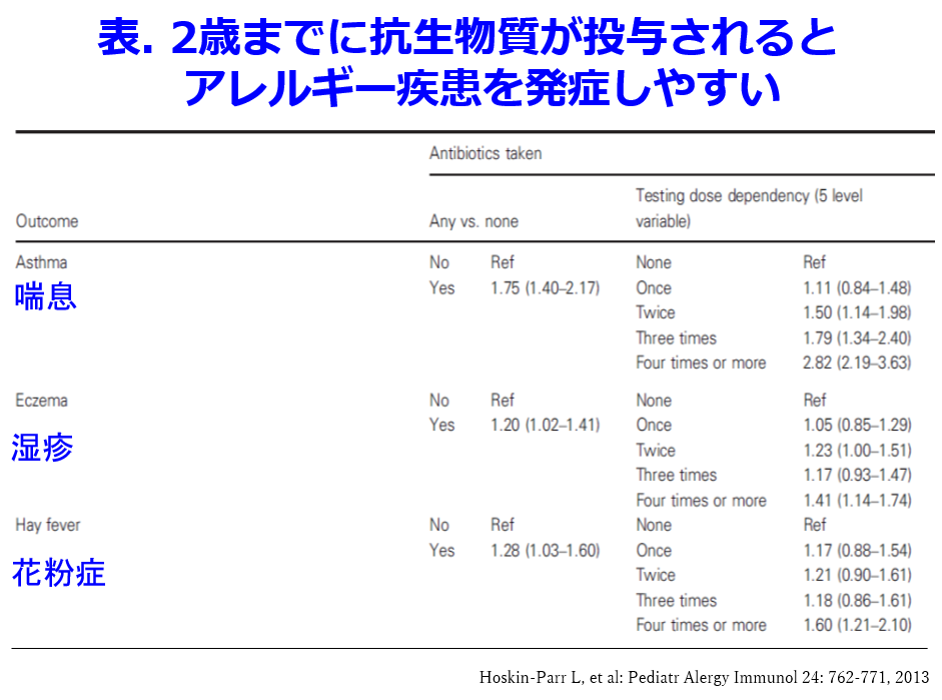 わが国でも2歳までの抗菌薬の使用と5歳におけるアレルギー疾患の有症率との間には有意な関連があり、抗菌薬を使用した群でアレルギー疾患の発症リスクが高くなることを成育医療研究センター内の出生コホートデータを使用した解析で見いだされている3)。ただし小児期の抗菌薬投与はアレルギー疾患と関与しないという報告があるのも事実だ。
わが国でも2歳までの抗菌薬の使用と5歳におけるアレルギー疾患の有症率との間には有意な関連があり、抗菌薬を使用した群でアレルギー疾患の発症リスクが高くなることを成育医療研究センター内の出生コホートデータを使用した解析で見いだされている3)。ただし小児期の抗菌薬投与はアレルギー疾患と関与しないという報告があるのも事実だ。
またピボキシル基を付けて吸収率を上げるが吸収されるセフカペン ピボキシル塩酸塩水和物(フロモックス?)、セフジトレン ピボキシル(メイアクト?)、セフテラム ピボキシル(トミロン?) 、テビペネム ピボキシル(オラペネム?)はくっついているピボキシル基からピバリン酸を生じ、カルニチン抱合されるためカルニチン欠乏によってβ酸化が行われず、もともとカルニチンの貯蔵臓器である筋肉量の少ない小児では糖新生ができないため、低血糖を起こしやすくなることに関しては非常に多くの副作用報告がある4)。これは食事摂取が少ない、あるいは抗菌薬投与期間が長い患児で起こりやすいので気を付けよう。
引用文献
1) Khansari PS, Sperlagh: Inflammopharmacology 20: 103-107, 2112
2) Hoskin-Parr L, et al: Pediatr Alergy Immunol 24: 762-771, 2013
3)Hanada KY, et al: Ann Allergy Asthma Immunol 119: 54-58, 2017
4)ピボキシル基を有する抗菌薬投与による小児等の重篤な低カルニチン血症と低血糖について. 医薬品医療機器総合機構PMDAからの医薬品適正使用のお願い 2012年4月
◆連載◆抗菌薬が効かない多剤耐性菌MRSAが出現した~抗菌薬の耐性化~ 第7回
1.第1世代~第2世代セフェムの時代
筆者が薬剤師になった1977年、第1世代セフェムのセファメジンⓇ(セファゾリン、1971年発売)が飛ぶように売れていた。この当時の外科領域感染症は黄色ブドウ球菌が主だったからグラム陽性球菌に強い第1世代セフェムはよく効いた。そして1gのバイアルが3,000円以上の高薬価であり、仕入れ値は20~30%引きであったため、比較的清潔な手術でも1日3バイアルの予防投与をすると売り上げ10,000円/日、薬価差による純利益2,000~3,000円/日で予防投与として1~3週間、退院まで処方され、多額の利益(薬価差)が病院に入ってきた。
約10年後、グラム陽性菌をターゲットにした第1世代の乱用の影響でグラム陰性桿菌の大腸菌、肺炎桿菌が起炎菌の主役になってくると、グラム陰性菌にも効力を示すパンスポリンⓇ(セフォチアム、1981年発売。パンスポリンⓇが悪いのではなくこの当時、一番売れていたイメージがあるのがこの薬ということです)などの第2世代セフェムが登場し、この薬価が3000円以上になって、セファメジンⓇの薬価は2000円程度に下げられたため、より薬価差の高く儲かる第2世代セフェムを各社比較して、薬価差の大きいものを購入して、どの病院も相変わらず、2週間程度の長期間、予防投与と称して使い、1手術当たり3万円~5万円の利益を得ていた。
2.第3世代セフェムの時代
約5年後、グラム陽性菌には弱いが陰性桿菌に超強力な第3世代セフェムが台頭し、抗菌薬市場は第3世代セフェムの販売競争で荒れに荒れた。セファメジンⓇの薬価は1000円台に、第2世代セフェムは2000円台になったため、製薬メーカー各社とも薬価3000円以上の第3世代セフェムのモダシンⓇ(セフタジジム、1986年発売)、ロセフィンⓇ(セフトリアキソン、1986年発売)など数多くの第3世代セフェムを市場に載せた。中には「第1選択薬として広く使ってください」と緑膿菌に対するMICがその当時で最も低いファースト○○という商品名を付けて、売り込んだメーカーもあった。それを感染症の可能性が決して高くはない結石破砕後の感染予防にルーチン使用を勧めたのには猛反対した覚えがある。
3.院内感染MRSAの出現
 そして1989~1990年、ついに市販の抗菌薬すべてが効かない耐性菌、グラム陽性球菌であるメチシリン耐性黄色ブドウ球菌(MRSA:写真)による院内感染が蔓延し始めたのである。MRSAは抗菌薬が効かない院内感染、つまり入院しなければ罹患しない感染症としてこの当時、大きな社会問題になった。この時、MRSAの特効薬のバンコマイシンは偽膜性大腸炎治療薬としての内服薬(見た目は注射薬と同じバイアル入りで滅菌もされていた)しか認可されておらず、適応を無視して使われた患者には効果を示し、査定を恐れて低感受性の既存抗菌薬が使われた患者は亡くなっていたのではないだろうか。この当時、働き盛りの男性が感染症に罹患し、大学病院に入院して抗菌薬投与を受けたが最終的にMRSAの院内感染症に罹患して亡くなった方の奥様の書いた手記が出版されるなど、現行の抗菌薬が一切効かないMRSA感染症がテレビ、新聞でも取り上げられて大きな話題になった。慌てた政府は1990年アルベカシン注、1991年に塩酸バンコマイシン注をMRSA治療薬として認可した。そして黄色ブドウ球菌中のMRSAの割合が諸外国が10%程度であったのに比し、日本だけが特出して60%と高い耐性化が進行した(図)。「日本でのMRSAの割合はsixty percentだ」と言っても欧米人には「sixteenの間違いじゃないの」と聞き返される始末だった。MRSAの蔓延はおそらくグラム陰性菌にはめっぽう強いが、グラム陽性菌には第1・第2世代セフェムに劣る第3世代セフェムの多用・長期投与によるものと考えられた。
そして1989~1990年、ついに市販の抗菌薬すべてが効かない耐性菌、グラム陽性球菌であるメチシリン耐性黄色ブドウ球菌(MRSA:写真)による院内感染が蔓延し始めたのである。MRSAは抗菌薬が効かない院内感染、つまり入院しなければ罹患しない感染症としてこの当時、大きな社会問題になった。この時、MRSAの特効薬のバンコマイシンは偽膜性大腸炎治療薬としての内服薬(見た目は注射薬と同じバイアル入りで滅菌もされていた)しか認可されておらず、適応を無視して使われた患者には効果を示し、査定を恐れて低感受性の既存抗菌薬が使われた患者は亡くなっていたのではないだろうか。この当時、働き盛りの男性が感染症に罹患し、大学病院に入院して抗菌薬投与を受けたが最終的にMRSAの院内感染症に罹患して亡くなった方の奥様の書いた手記が出版されるなど、現行の抗菌薬が一切効かないMRSA感染症がテレビ、新聞でも取り上げられて大きな話題になった。慌てた政府は1990年アルベカシン注、1991年に塩酸バンコマイシン注をMRSA治療薬として認可した。そして黄色ブドウ球菌中のMRSAの割合が諸外国が10%程度であったのに比し、日本だけが特出して60%と高い耐性化が進行した(図)。「日本でのMRSAの割合はsixty percentだ」と言っても欧米人には「sixteenの間違いじゃないの」と聞き返される始末だった。MRSAの蔓延はおそらくグラム陰性菌にはめっぽう強いが、グラム陽性菌には第1・第2世代セフェムに劣る第3世代セフェムの多用・長期投与によるものと考えられた。
新しく広域であればあるほど薬価が高く、病院に利益をもたらすため、新しい広域セフェムは飛ぶように売れた。感染を起こしていない手術の予防投与にも……。製薬メーカーは第1世代から第4世代まで、より広域のセフェムの開発競争を行い、予防投与にも使用を勧めた。1980年代に一番売れた薬が抗生物質だった。
4.抗菌薬耐性を防ぐために
今は売上ベスト30に入る抗菌薬は全くないので抗菌薬の新薬の開発をやめるメーカーが続出してきていることが問題になっている。この耐性化の説は証明されたものではないが、この当時の専門家が言っていたものをまとめた。このころだったであろうか、WHOが以下の警告を発した。「薬剤耐性の増加により抗菌薬は(新規を含め)その役割を失いつつある。先進国での抗菌薬の無意味な処方量の増加、発展途上国での低用量の処方のいずれもが薬剤耐性菌の増加に関与する。」今回の例は術後感染予防投与と称して1~3週間、広域のセフェム系抗菌薬の「無意味な処方量の増加」だったのであろう。 1990年以降も新たに開発されたグラム陰性菌に強い、経口抗菌セフェムは7種類もあるが、皮膚軟部感染症の主役となるグラム陽性球菌に効果的な第1世代セフェムは新規性がなく、高薬価を付けてもらえないせいか、全く現れていない。そして薬価差によって儲かるシステムを変えるため(だけではないが)、医薬分業が推進され、抗菌薬適正使用のために各病院に感染防御チーム(ICT: infection control team)が結成され、院内感染防御対策としてスタンダードプリコーションが普及した。そして術後感染予防の抗菌薬投与の主流派は狭域の経口ペニシリンあるいは経口第1世代セフェムの術前1回投与に代わった。
1990年以降も新たに開発されたグラム陰性菌に強い、経口抗菌セフェムは7種類もあるが、皮膚軟部感染症の主役となるグラム陽性球菌に効果的な第1世代セフェムは新規性がなく、高薬価を付けてもらえないせいか、全く現れていない。そして薬価差によって儲かるシステムを変えるため(だけではないが)、医薬分業が推進され、抗菌薬適正使用のために各病院に感染防御チーム(ICT: infection control team)が結成され、院内感染防御対策としてスタンダードプリコーションが普及した。そして術後感染予防の抗菌薬投与の主流派は狭域の経口ペニシリンあるいは経口第1世代セフェムの術前1回投与に代わった。
このころの私は薬剤師として臨床業務ができず、病院の利益に貢献することにしか生きがいを見いだせなかった薬剤科長であった。誰もが広域で殺菌力の強い抗菌薬が素晴らしいものと信じて疑わず、率先して薬価差を追求していたころの本当に恥ずかしい話だ。
そして世の中はというと1990年代にバンコマイシン耐性腸球菌が出現して2000年リネゾリドが発売された。2010年以降の多剤耐性アシネトバクタ―の出現には2012年になってチゲサイクリンが緊急導入された。2000年以降の多剤耐性緑膿菌の出現に対しては2015年になって製造中止になっていた古い抗菌薬のコリスチンが復活した。これらの緊急導入には日本感染症学会、日本化学療法学会、日本環境感染学会、日本臨床微生物学会の専門4学会の提言によって早期導入が実現した。
5.感染防御チームICTから抗菌薬適正使用支援チームASTの結成へ
MRSAの院内感染の蔓延という反省から院内にICTが結成され、MRSAなどの耐性化や院内感染数の把握は検査部が、カルバペネム系、第4代セフェムのセフェピム(マキシピームⓇ)、超広域ペニシリンのピペラシリン/タゾバクタム(ゾシンⓇ)などの広域スペクトルの抗菌薬の使用状況は薬剤部がまとめ、管理栄養士が栄養状態に関する情報提供するなど、チーム医療が重要な時代に入り、栄養サポートチームNSTも結成されるようになった。
そして抗菌薬がほとんど開発されなくなった今、現行の抗菌薬をいかにして耐性化を防ぐこと、つまり抗菌薬の適正使用が重要な課題となってきて、診療施設内の「抗菌薬の使用制限」と「介入とフィードバック」するプログラム(ASP)を実践するためにAST(Antimicrobial Stewardship team:抗菌薬を正しく使う手助けをするチームでICTは感染防止という予防、ASTは治療に特化)が活動するようになった。
◆連載◆高齢者の腎機能を正確に評価して抗菌薬・抗ウイルス薬を投与する 第6回
加齢とともに動脈硬化が進行して40歳代で150gの重量は80歳代では100gに委縮する(図1)1)。
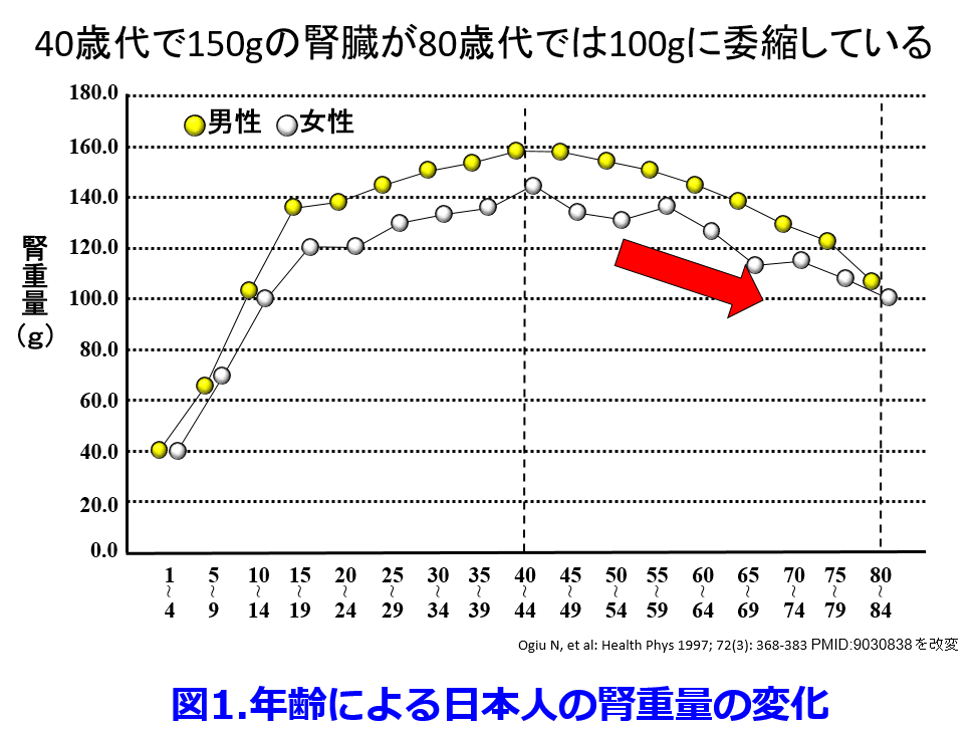
したがって加齢とともにCKDの頻度が増すため(図2)2)、
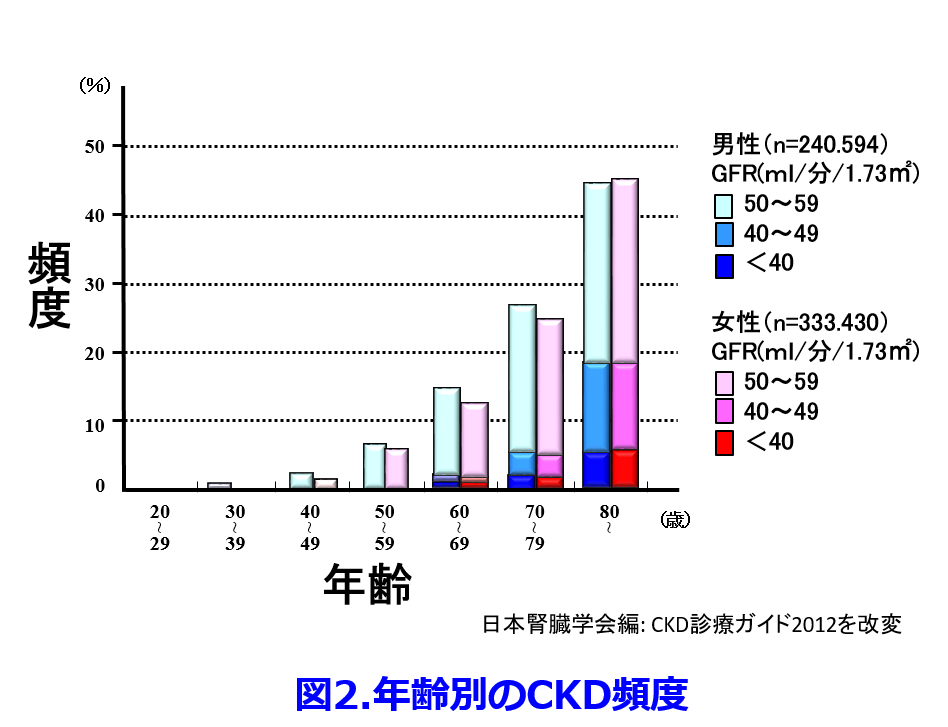
高齢者を見たら腎機能低下を疑い、腎機能が不明のまま腎排泄性ハイリスク薬を投与してはならない!また加齢とともに食欲不振、歯の喪失、疾患の合併、筋肉量減少が進行し、活動量が低下し食事量はさらに低下して慢性的な低栄養からフレイルサイクルが累進的に進行すると考えられている(図3)3)。
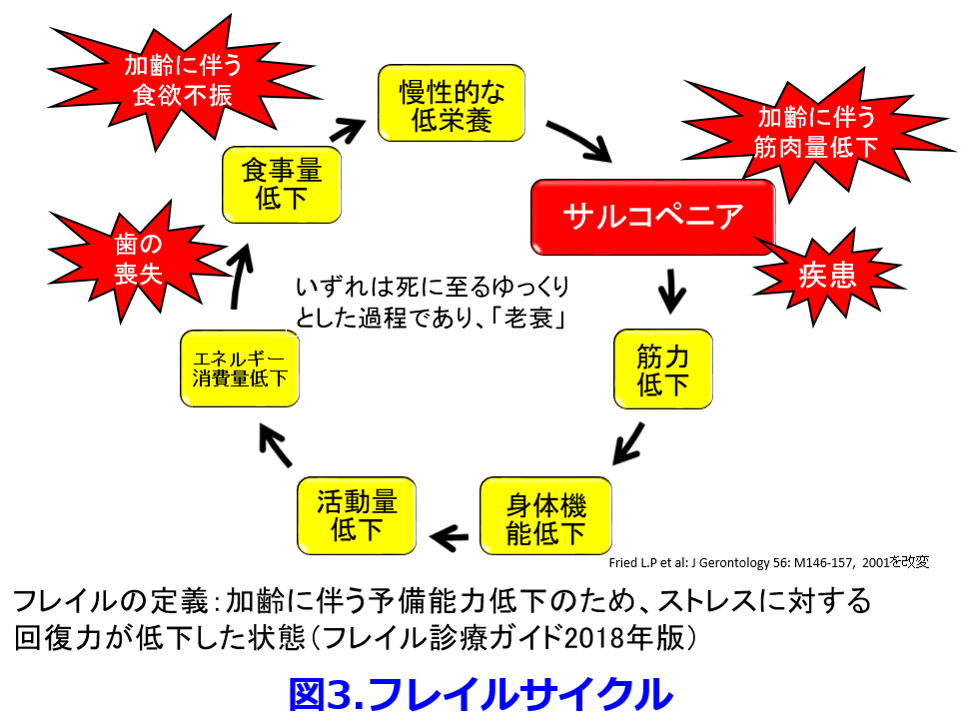
したがって加齢に伴い筋肉量が減少し、サルコペニアの割合が増える(図4)4)。
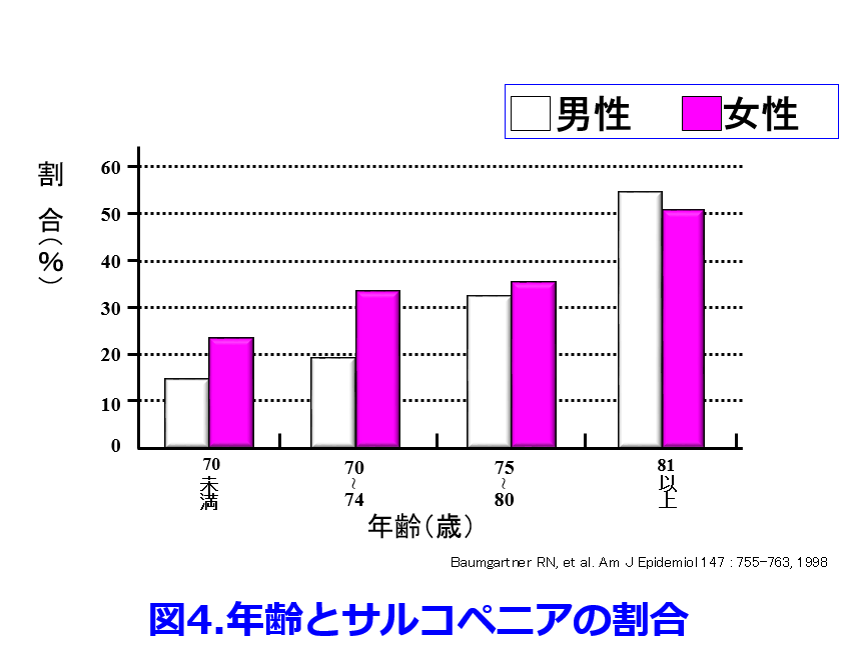
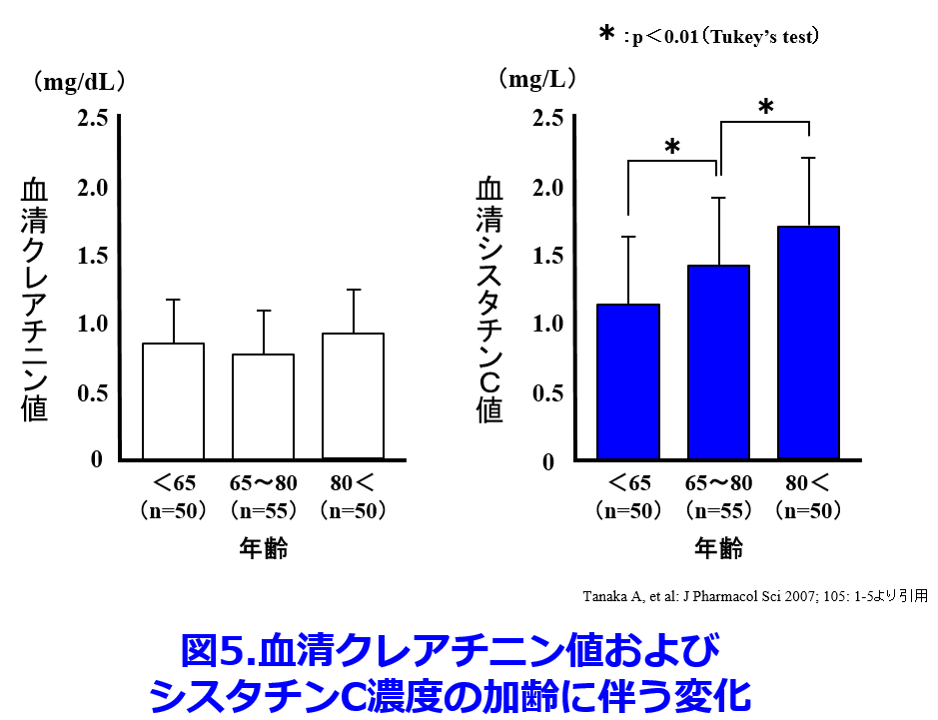
筋肉量の減少は50歳で明白になり、60歳以降に加速し、75歳以降ではさらに加速する。筋肉の機能(筋肉量と筋力)は女性よりも男性で著しく減少することが明らかになっている5)。そのため筋肉量の影響を受けない血清シスタチンC値は加齢とともに上昇して明らかな腎機能の悪化を示してくれるが、骨格筋のクレアチン由来の血清クレアチニン(Cr)は相殺されて血清Cr値は加齢とともに変化しないのだ(図5)6)。
フレイル・サルコペニアは加齢に伴って栄養状態が悪化し、免疫能の低下した高齢者は感染症にも罹患しやすい。わが国のCOVID-19による死亡者の93.5%が60歳以上であり、特に心血管疾患を合併した高齢者での死亡率が高いといわれており(図6)7)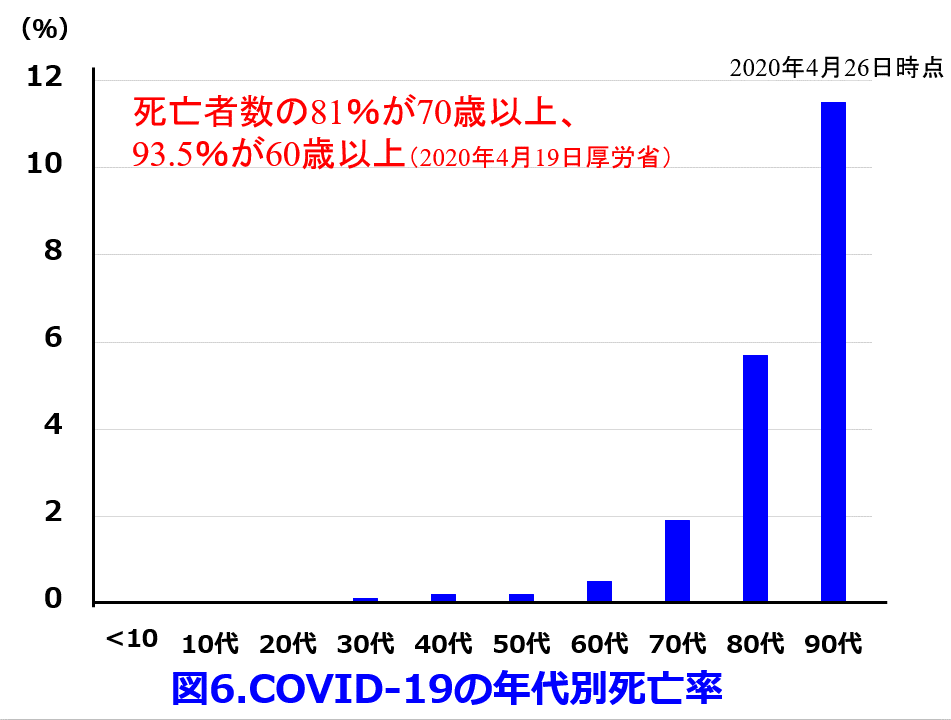
肺炎による死亡者の、なんと97%が高齢者なのだ(図7)8)。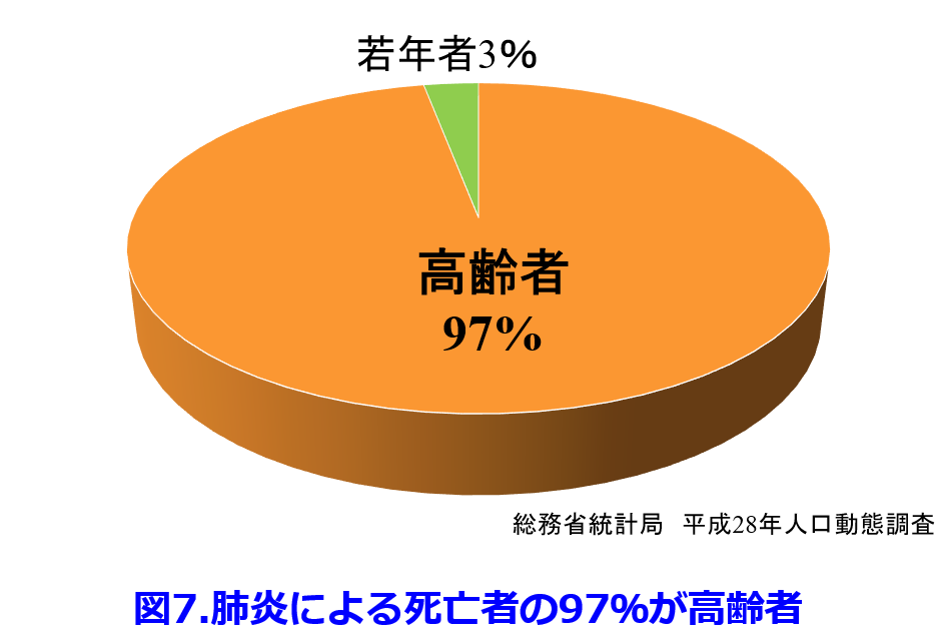 院内感染症のターゲットは栄養状態が不良のため免疫能が低下した高齢者がほとんどと考えてよい。その時に使うのが腎排泄性の殺菌性抗菌薬なのだ。フレイル・サルコペニアを伴った高齢者の腎機能評価は非常に重要だ。
院内感染症のターゲットは栄養状態が不良のため免疫能が低下した高齢者がほとんどと考えてよい。その時に使うのが腎排泄性の殺菌性抗菌薬なのだ。フレイル・サルコペニアを伴った高齢者の腎機能評価は非常に重要だ。
長期臥床高齢患者の血清Cr値が0.2~0.3mg/dLのような低値になることはふつうにみられる現象であり、血清Cr値を基にしたeGFRが200~300mL/min/1.73m2、推算CCrが150~200mL/minに推算されることがあるが、決して腎機能が極めて高いのではなく、筋肉中のクレアチン由来の血清Cr値が筋肉量の減少に伴って低下しているにすぎない9)。
このような症例にバラシクロビルやアシクロビルの常用量投与によって発症する腎後性の急性腎障害*は薬剤性腎障害の原因薬物でトップであり(表1)10)、

70歳以上、体重40kg以下、女性で多いことが2017年3月の「適正使用のお願い」で報告された11)。このような症例に対しては腎排泄ではないアメナメビルへの変更、特に夏季での飲水励行、RAS阻害薬・利尿薬・NSDAIDs尿中などの腎虚血誘引薬物を一時中止するなどの対策が必要と思われる。尿中排泄率90%のバンコマイシンを腎機能が正常と判断された後期高齢者に常用量投与するによって腎性腎障害(急性尿細管壊死)から透析導入に至る症例も珍しくない。
日本人向けeGFRは500mL+180mL以上の強制飲水可能な患者を対象にしているため(図8)2)、
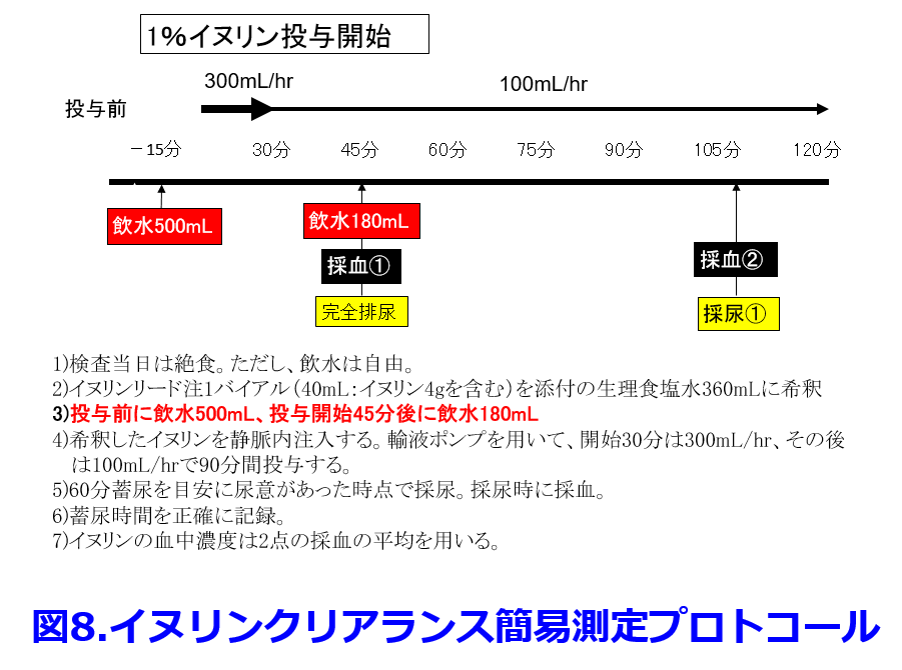
フレイル、サルコペニア症例、超高齢者が除外されている可能性が高いので寝たきり患者には適さず、腎機能がより過大評価される。推奨はしないが、寝たきり超高齢者を含んでいるため12)、eGFRよりも推算CCrの方が過大評価の程度はましである。この様な症例では筋肉量の影響を受けないシスタチンCを基にしたeGFRまたは実測CCrによる薬物投与設計が推奨される9)。シスタチンCは軽度腎機能低下も血清Cr値よりも鋭敏に反応する利点もある(図9)。
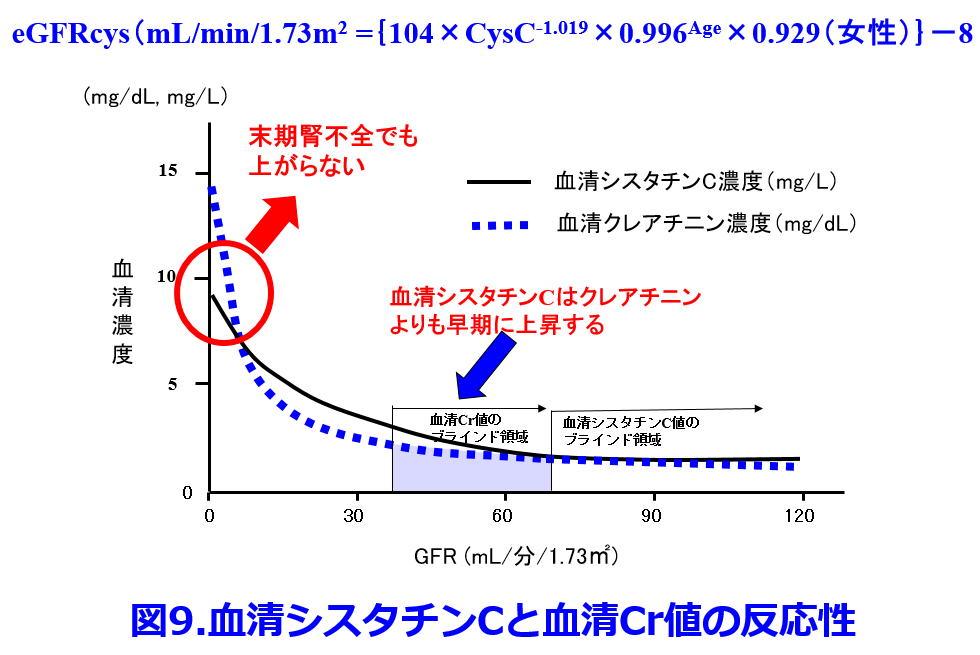
ただしシスタチンCは保険上、3か月に1回しか測定できないため、その後は血清Cr値の変動で腎機能の変動をチェックしよう。サルコペニア高齢者では血清Cr値は絶対値としては全く信用できないが、腎機能の変動を見るには安価でよいマーカーだ。
シスタチンCによるeGFRはeGFRcys(mL/min/1.73m2 )={104×CysC-1.019×0.996Age×0.929(女性)}-8の式で求められるが、この「-8」は脾臓における腎外クリアランスを示しているため、末期腎不全では特に男性では6mg/L以上に上がりにくいため、末期腎不全患者には適していないこと(図9)、甲状腺機能低下症により低下し、副腎皮質ホルモンの高用量投与によって上昇することなど、薬物の影響を受けやすいことも覚えておこう(表2)。

コラム:腎後性の急性腎障害
アシクロビル(ゾビラックスⓇ)、ガンシクロビル(デノシンⓇ)、ホスカルネット(ホスカビルⓇ)、テノホビル(テノゼットⓇ/ビリアードⓇ)などの抗ウイルス薬が圧倒的に多く、それ以外にはメトトレキサートが原因薬物になる。プリン体骨格を持つ生体内物質である尿酸のように元来腎排泄性で水溶性薬物ではあっても溶解度が低い薬物が腎糸球体でろ過された後、水が再吸収され遠位尿細管や集合管で濃縮された薬物が過飽和になって結晶が析出して尿路閉塞を起こして水腎症をきたす。腎排泄性薬物の場合、腎機能に応じた減量をし、他の腎毒性薬物の併用を避ける。注射薬の場合、生食の前投与や点滴時間の延長、経口剤の場合は水分摂取を励行することによって予防可能であり、腎障害発症後も輸液によって改善することが多い。そのため腎後性腎障害は無尿・乏尿によって速やかに気付き、輸液などによって速やかに正常に回復するため教科書的にも急性腎障害として扱われていないことがある。メトトレキサートの場合、尿のアルカリ化によって溶解度が60倍上昇するためメイロンⓇやアセタゾラミドの併用、大量輸液によるによるアルカリ利尿によって結晶の析出を防止できる。アシクロビル・バラシクロビルの場合、特に夏季に1日1.5Lの飲水を励行する服薬指導はこれらの薬物による薬剤性腎障害防止のために非常に重要である。
引用文献
1)Ogiu N, et al: Health Phys 72:368-383,1997
2)日本腎臓学会編: CKD診療ガイド2012
3)Fried L.P et al: J Gerontology 56: M146-157, 2001
4)Baumgartner RN, et al. Am J Epidemiol 147 : 755-763, 1998
5)Chen LK, et al:JAMDA (2014)
6)Tanaka A, et al: J Pharmacol Sci 105: 1-5, 2007
7)2020年4月19日厚労省
8)総務省統計局 平成28年人口動態調査
9)Nakatani S, et al: Biol Pharm Bull 42: 1350-1357, 2019
10)Hosobata K, et al: J Clin Pharm Ther 44: 49-53, 2019
11)バルトレックスⓇ錠及び顆粒適正適正使用のお願い. スミスクライン株式会社2017
12) Cockcroft DW, Gault MH: Nephron 16: 31-41, 1976

