2021年9月
◆連載◆16日目 ワルファリンとNSAIDsを併用してはいけない本当の理由
NSAIDsによる腎障害 ~Triple whammyを防げ~
16日目 ワルファリンとNSAIDsを併用してはいけない本当の理由
医師、薬剤師を含め多くの医療人が、ワルファリン服用者がNSAIDsを併用することによって重篤な消化管出血が起こる原因は、ワルファリンの抗凝固作用とNSAIDsによる胃障害・抗血小板作用による出血、つまり薬物動力学的相互作用と思っているかもしれません。これは確かにあります。また一部の薬剤師はワルファリンの蛋白結合率が99%以上と高いため、同様にほぼ90~99%以上の蛋白結合率で高用量のNSAIDsを併用することによって、ワルファリンの遊離型分率が上がるためと考えている方もいるかもしれません。
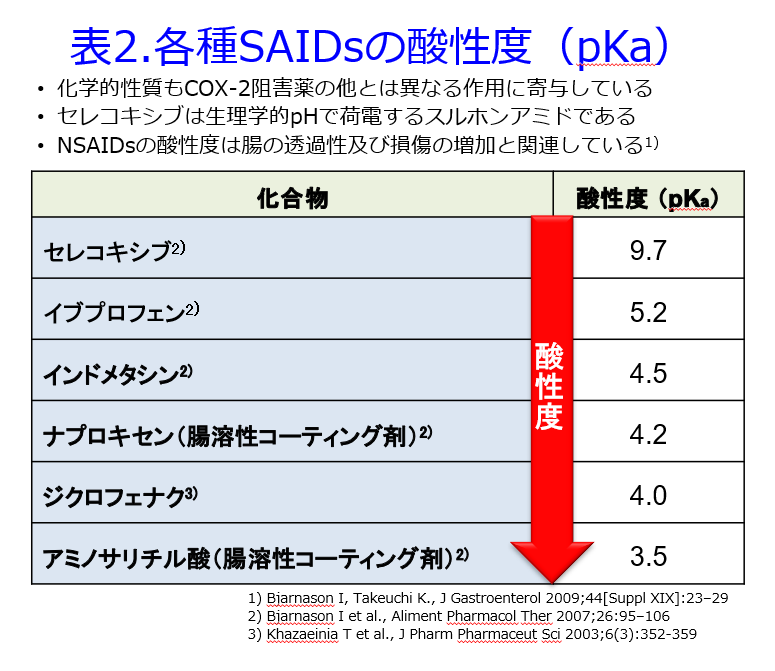
しかし現在の薬剤学的な考え方では遊離型分率が上がってもワルファリンの肝代謝が亢進し、組織移行性が高まることによる分布容積増大によって遊離型濃度は変化しないのです(当ブログの薬物動態学が苦手なあなたへ→4限目の理解度テスト5.「蛋白競合による副作用ってある?」を参照)。20世紀の薬剤学で習っていたワルファリンとNSAIDsのフェニルブタゾン(製造中止)やブコローム(パラミジンⓇ)は蛋白結合の競合といわれていましたが、現在ではフェニルブタゾンやブコロームによるCYP2C9を介するワルファリンの代謝阻害によると考えられています(表1)。ただし今もNSAIDsのピロキシカム(バキソⓇカプセル)の添付文書には、ワルファリンとの相互作用の機序について「本剤のヒトでの蛋白結合率が99.8%と高いため、ワルファリンの活性型が増加するためと考えられる。」と書かれていますが、表1の著者Rolan PEは「蛋白結合置換の相互作用、なんでこれらが臨床的に重要なの?」と述べています。

平田も病院薬剤師時代に、ワルファリン服用者にロキソプロフェンが併用されることによって、透析患者さんが消化管出血によって突然死したことを経験しました。その時のデスカンファレンスはとても沈痛だったことを覚えており、その時には薬物動力学的相互作用+蛋白結合の競合阻害を疑っていました。それ以来、透析患者のNSAIDsは胃への直接刺激の少ない坐薬の頓服処方に変更していただくことが多くなりました。
薬剤師として知っておくべきことは薬物動力学的相互作用だけでなく、NSAIDsの多くがCYP2C9で代謝され、ロルノキシカムはCYP2C9阻害薬でありS-ワルファリン濃度(AUC)を1.58倍上昇させる(ラセミ体で1.32倍)1)といったワルファリンとの薬物動態学的相互作用の問題です。イブプロフェン、インドメタシン、メフェナム酸、ピロキシカム、テノキシカム、セレコキシブもCYP2C9を阻害し、セレコキシブに関してはワルファリンの相互作用により重篤な出血の副作用を起こした報告があります2)。さらにわが国の報告では19人のワルファリン服用患者のセレコキシブ併用前のPT-INRが併用前1.53±0.43が、併用後2.18±1.01 に上昇した(P<0.01)といわれています3)。しかもセレコキシブの米国添付文書には「遺伝子型または他のCYP2C9基質(ワルファリン、フェニトインなど)の既往歴/経験に基づいて、CYP2C9のpoor metabolizersであることがわかっている、または疑われる成人患者では、推奨される最低用量の半分(変形性関節症で100mgを1日2回、関節リウマチでは100~200mgを1日2回)で治療を開始する。」と記載されていますが、わが国の添付文書には残念ながらここまで踏み込んだ記載はありません。
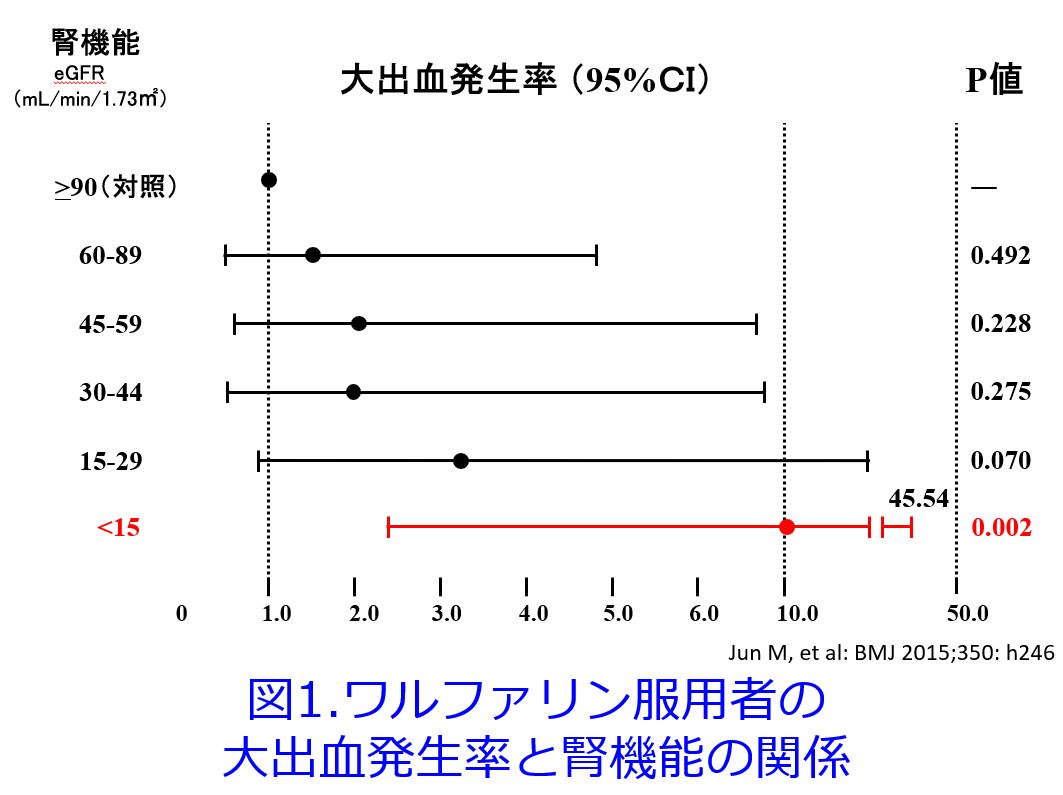
また、ワルファリン服用患者へのNSAIDsの投与は消化管出血のリスクを高めるため、極めて慎重であるべきであり、このような症例にはNSAIDsではなくアセトアミノフェンを併用していただきたいと切に思います。平田の米国での経験では、薬剤師の運営するAnticoagulation Clinicを訪れる患者さんの鎮痛療法はアセトアミノフェンばかりで、NSAIDsの処方は抗血小板薬としての低用量アスピリン併用例を除けば皆無でした。またワルファリン服用者の大出血は腎機能が悪化するほどリスクが高くなることが知られており、末期腎不全では有意に大出血発生率が上昇します(図1)4)、GFR<30mL/minではCYP2C9代謝が阻害されS-ワルファリン濃度が27%上昇し半減期が20%延長することも報告されています5)。そのためPT-INRの目標値は通常2.0~3.0ですが日本の高齢者では1.6~2.6、透析患者は2.0以下とされています。
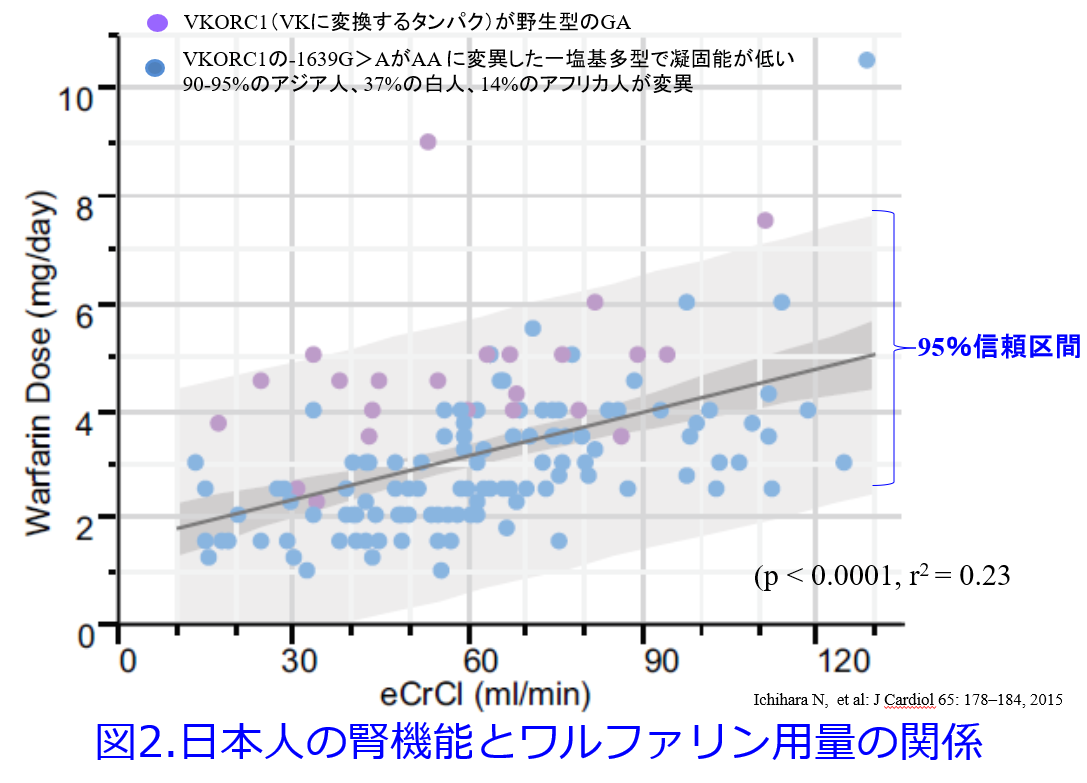
米国のAnticoagulation Clinicでは5mg/日を超えて投与されている患者さんが大半を占めていたのですが、もともと上記の理由により日本人のワルファリン用量は3.21±1.46mg/日と少なめです。この理由として最近になって日本人ではVKORC1の変異患者が多いことが明らかになっています(図2)6)。この報告ではVKORC1の遺伝子多型とともに日本人では腎機能の低下に伴い、ワルファリンの非腎クリアランスが低下しワルファリン用量を少なくしなくてはならないこと、野生型ではワルファリン用量が高めでであることを示しました(図2の紫色の〇)。
ここまでCYP2C9のことについて書いてきて、ふと気づいたのですが、イブプロフェン、インドメタシン、メフェナム酸、ピロキシカム、テノキシカム、セレコキシブなど多くのNSAIDsはCYP2C9の基質(ロキソプロフェンは不明)ですが、末期腎不全になるとCYP3A4も1A2も2C19も発現量が低下するのですが、最も顕著に低下するのがCYP2C9なのです7)。ひょっとしたら透析患者などの末期腎不全患者にNSAIDsを単回投与でなく、常用量で漫然投与すると代謝されないため、過量投与になり、中毒性副作用が起こりやすくなる、あるいはワルファリンの代謝をより強力に阻害して出血しやすくなることなどが考えられるかもしれません。これは平田の薬剤師の「気づき」です。NSAIDsの蛋白結合率はイブプロフェン99%、インドメタシン99%、メフェナム酸85-99%、ピロキシカム99%、セレコキシブ97%と極めて高いのですが、腎不全患者では尿毒素の蓄積と低アルブミン血症によって蛋白結合率が低下しますが、これによる薬効増強はないことはすでに説明しました(当ブログの薬物動態学が苦手なあなたへ4限目参照)。しかしこれだけ蛋白結合率の高い薬物の遊離型濃度を測定することは非常に難しそうです。しかも尿を濃縮して排泄することができない透析患者の血漿は夾雑物が多くて測定しにくいのです。どなたか分析技術の高い方を巻き込んで、末期腎不全患者の遊離型NSAID濃度は腎機能正常者に比し高いということを証明してもらえませんでしょうか?このネタなら英語論文になりますし、考察などは平田が協力させていただきます。
胃障害リスクはアセトアミノフェン、セレコキシブが+、他のNSAIDsは2+、そしてアスピリンは6+と評価されているのだから8)。「空腹時のNSAIDsの服用は消化管穿孔によって生命を危うくする行為」だということを知っていただきたい。透析患者の半数以上がPPIを服用するほど、胃が脆弱で、食事も満足に取れないのに痛みがあるとロキソニンⓇ錠などが処方されることが何度もあったが、胃障害の頻度が極めて高かったため、平田が薬剤師時代には特に高齢者では低用量のボルタレンⓇサポやインダシンⓇ坐薬などに変えてもらっていた。これだと胃への直接刺激を回避できるし、坐薬なので痛くないときには無理して挿入することがないので漫然投与も防げたのではないかと思う。
引用文献
1)Kohl C, Steinkellner M: Drug Metab Dispos 28: 161-168, 2000
2)Malhi H, et al: Postgrad Med J 80: 107-109, 2004
3)鈴木信也, 他:医薬品情報学18:35-241, 2016
4)Jun M, et al: BMJ 2015;350: h246
5)Albrecht D, et al: Thronm Haemost 117: 2026-2033,2017
6)Ichihara N, et al: J Cardiol 65: 178-184, 2015
7)Deri MT, et al: pharmacol rep 72: 1695-1705, 2020
8)Wells BG, et al ed: Pharmavotherapy Handbook sixth edition
◆連載◆15日目 NSAIDsのパップ剤や全身作用する貼付薬は安全?
NSAIDsによる腎障害 ~Triple whammyを防げ~
15日目 NSAIDsのパップ剤や全身作用する貼付薬は安全?
モーラスⓇテープなどのいわゆるNSAIDsの貼付薬ではどうなのか?これについてはよく質問を受けますので考察してみましょう。医学中央雑誌ではロキソプロフェン×AKIで88件ヒットしましたが(2021年8月12日の調べ、以下も同じ)、パップ剤に関しては間質性腎炎を含む報告が少数例あるのみです。ロキソプロフェンテープ×AKIは0件でロキソプロフェンパップ×AKIは0件。ただし局所パッチ剤での間質性腎炎の症例報告がありました(Int Med 53: 1131-1135, 2014)。
ではモーラスⓇで有名なケトプロフェンパップはケトプロフェン×AKIで35件(AKI症例はなし)、ケトプロフェンパップ×AKIで0件、モーラスⓇ×AKIでは34件ヒットしましたがAKIの報告なし。ケトプロフェンテープ×AKIで1件だけですがAKI症例ではなくkey wordsに入っていただけでジェネリックの製剤についてのものでした。
胃障害についてはケトプロフェン経皮製剤大量使用(20 mg×8枚/日)による小腸出血が中止後に回復した報告がありますし1)、NSAIDs小腸による障害に関しては酸分泌抑制薬の併用は無効です2)。2年にわたり治癒が遷延した胃潰瘍が,ケトプロフェン経皮製剤(40 mg×4~6枚/日)の使用中止により2か月後に治癒したという症例があります3)。モーラステープの経皮吸収率はインタビューフォームによると69.7 %という、経口投与以上ではと思わせる高さです。テープを何枚も貼付すると内服薬カプセルの常用量である50mg連続投与時のAUCよりも高くなり、胃への直接刺激がないだけでもましではなく、胃潰瘍の原因になるということです。ロコアⓇテープでも出血性胃潰瘍の学会報告はあります。
ではロコアⓇテープなどの経皮吸収型NSAIDsで腎障害は起こりうるのか?インタビューフォームから血中濃度の推移を見てみましょう。図1に40mg単回投与時のエスフルルビプロフェン貼付薬と錠剤のフルルビプロフェンの血中濃度推移を示しますが、これは実は軸の幅が異なりますし、S体とラセミ体の違いがあります。
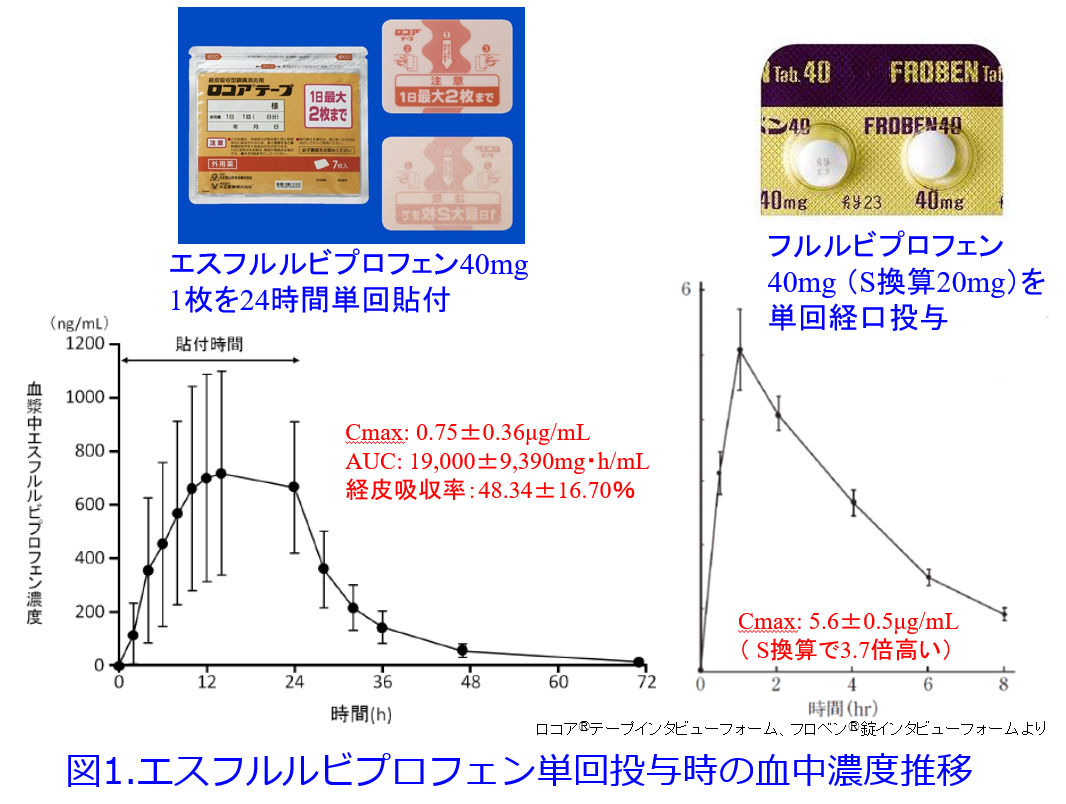
図2はエスフルルビプロフェン換算にした経口剤のY軸の血中濃度、X軸の時間のスケールを貼付薬に合わせたものですが、経口剤ではピーク濃度が高く、消失が早く、かたや貼付剤のピーク濃度は低く消失が遅いのが分かりますが、AUCはロコアⓇテープ2枚貼付時の全身曝露量がフルルビプロフェン経口剤の通常用量投与時と同程度に達します。
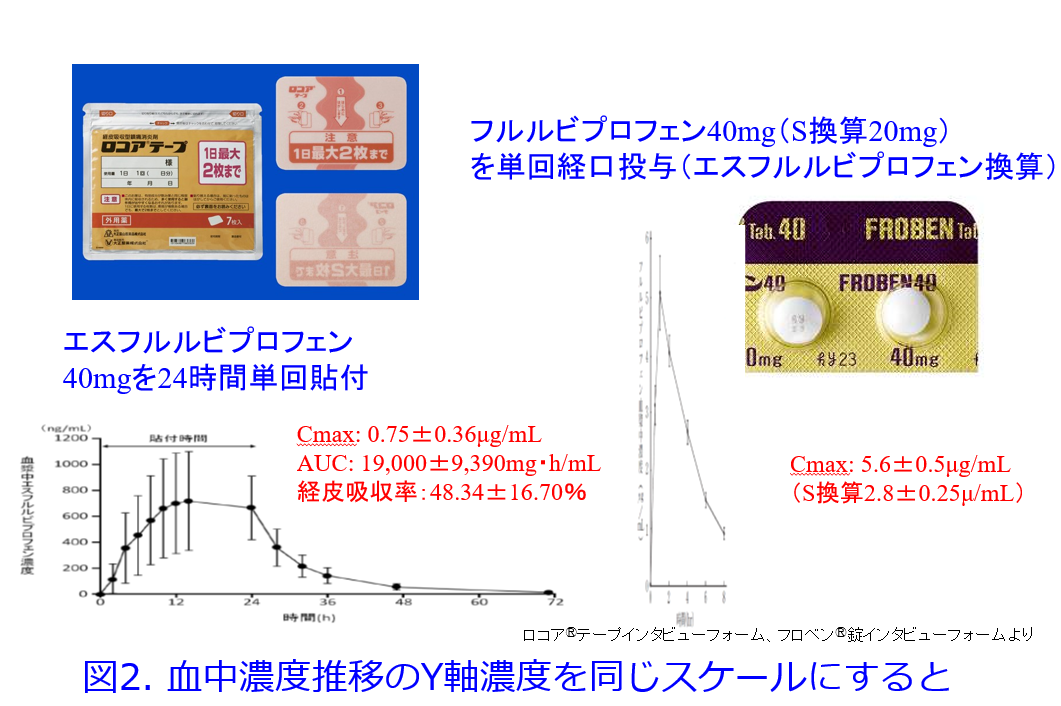
これまでの報告の多くで長時間作用型のNSAIDsはAKIを起こしやすいのではということに焦点を当てた検討はされていますが、短時間型のNSAIDsがAKIを起こしにくいという明確なデータはあまり見たことがありません。ロコアⓇテープによるAKIの報告は地方学会レベルの発表が1報、地域の医学雑誌に1報あります。
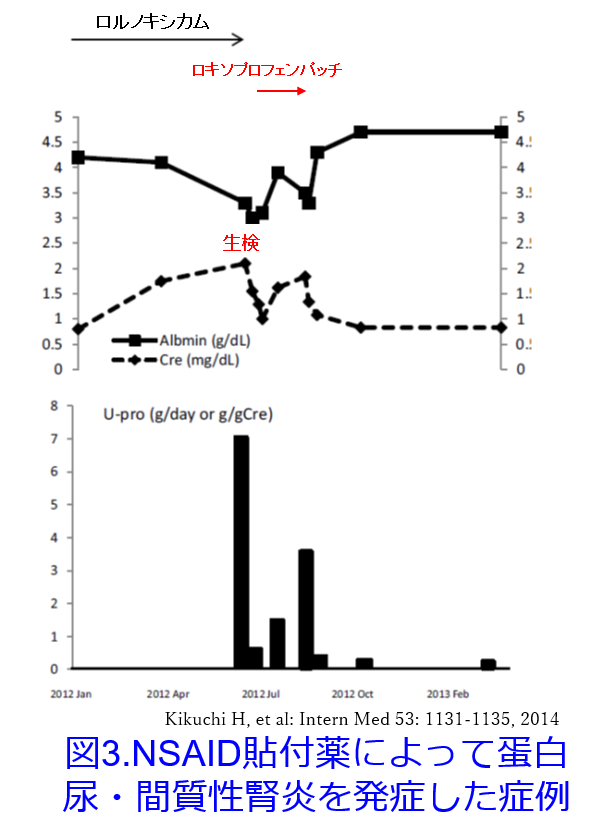
PubMed検索では「Esflurbiprofen patch×AKI」、「Ketoprofen patch AKI」では全くヒットしませんでしたが、「Loxoprofen patch×AKI」で76歳の女性でロルノキシカム投与によりネフローゼレベルの蛋白尿を伴う微小変化型の腎炎・間質性腎炎を発症した報告があります4)。ロルノキシカムの投与によってネフローゼを発症したのですが、中止により改善傾向だったところ、ロキソプロフェンパッチを投与すると、アルブミン尿が再燃し腎機能が悪化したという報告です。ただしステロイドなどの治療なしで投与中止のみによって回復しています(図3)4)。
ロキソニンⓇパップ2枚を反復投与した時の活性体AUCは内服の37.6%、Cmaxは約20ng/mLとロキソニン錠活性体trans-OH体のCmax850ng/mLのわずか、2.3%しかありません。しかし特にアレルギー性の間質性腎炎、免疫系を介した蛋白尿など用量依存的でないAKIは無視できないように感じました。
例えば免疫チェックポイント阻害薬(ICI)を用いると免疫系が賦活化され、T細胞の免疫寛容の破綻を反映する尿細管間質性腎炎、糸球体障害による蛋白尿が起こりやすくなることが話題になっています。場合によっては透析をしてでもがんを治すべきか、がんが悪化してでも透析導入を避けるべきか、非常に苦しい選択を迫られることがあります。ICIによるAKIはNSAIDs、PPIの併用によって発症率が高くなるという報告もあり5)6)、特にNSAIDsが問題になっています。平田自身は局所作用する外用NSAIDsはAKIを起こしにくく、安心と思っていましたが、ICI投与時には、この考えは正しいとは言い切れません。報告はあまりされていないものの、外用であってもアレルギーや免疫系を介する腎障害に関しては、やはり安全とは言えないのではと思っています。13日目の図3のNSAIDsによる腎障害の③免疫反応が介在するポドサイト障害による微小変化型ネフローゼ症候群、膜性腎症などの糸球体障害、④アレルギー性間質尿細管性腎炎の発症は濃度依存的ではないため、NSAIDsを経口から貼付薬や外用薬に変更してもAKIを起こしうると思われます。
ただし高齢者で多いのは中毒性の①輸入細動脈収縮による腎前性AKI以外にも、様々なメカニズムでAKIを発症します。②尿細管を栄養する輸出細動脈の虚血による尿細管壊死(脱水状態が持続すると重篤化します)のメカニズムですから、高齢者に関しては吸収率の低い局所作用型のNSAIDs貼付薬は経口製剤に比べると腎障害のリスクは少なくなると考えられます。
引用文献
1)Hirose S, et al: Scand J Gastroenterol 53: 120-123, 2018
2)Maiden L, et al: Gastroenterology 128: 1172-1178, 2005
3)木本正英, 他: 日本プライマリケア学会 42: 158-161, 2019
4)Kikuchi H, et al: Intern Med 53: 1131-1135, 2014
5)Cortazar VB, et al: J Am Soc Nephrol 31: 435-446, 2020
6)Shirali AC, et al: Am J Kidney Dis 68: 287-291, 2016
NSAIDsによる腎障害 ~Triple whammyを防げ~
14日目 経口NSAIDsを使うとしたら腎障害の少ないエビデンスレベルの高いものは何?
経口NSAIDsとして使うとしたら腎障害の少ないものはあるのでしょうか?プロドラッグで腎におけるPG阻害の程度が他のNSAIDsと比べ軽いといわれていたクリノリル?(腎組織において再度非活性型に変換されるため、腎機能障害が少ないとされていた)やCOX-2選択性が高いとわれていたハイペン?などが、AKIを起こさないという確たるエビデンスがないのに、メーカーに騙されて使っている医師が多かったようですが、これは今も続いているようです。COX-2選択性阻害薬のセレコキシブに関しては腎障害が少ないという報告は筆者が検索しただけでも少なくとも6報ありました。腎障害患者にはアセトアミノフェンと並んで推奨できる可能性のある唯一のNSAIDとなるかもしれません。今回はそれらの論文を精査してみましょう。
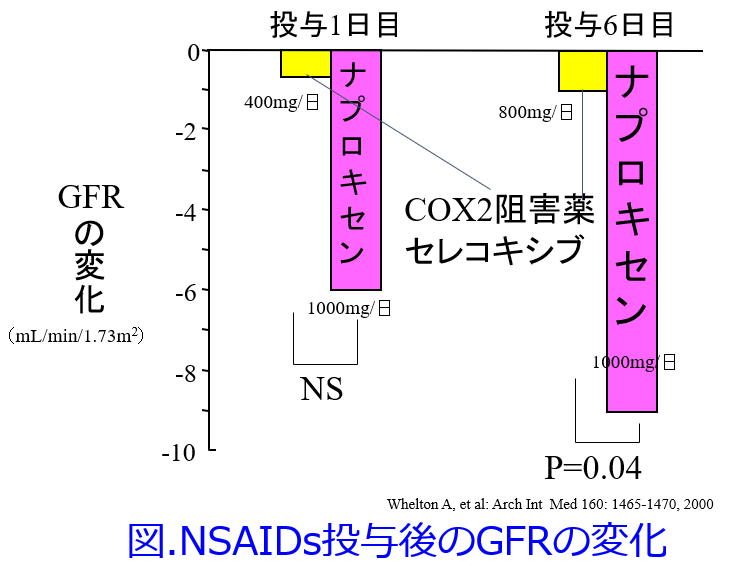
① 無作為化クロスオーバー単盲検比較試験でナプロキセン1000mg/日群に比しセレコキシブ800mg/日群では有意にGFR低下度が軽度であったが、セレコキシブ400mg/日群もGFR低下度が軽度ではあったが有意ではなかった(図)。Whelton A, et al : Arch Intern Med 160: 1465-1470, 2000
② 600人を対象にした無作為化二重盲検プラセボ比較試験でジクロフェナクでは有意な血清Cr値上昇を認めたが、セレコキシブでは差がなかった。McKenna F, et al: Scand J Rheumatol 30: 11-18, 2001
③ 腎機能の悪化リスク (2.38 rofecoxib vs 0.70 celecoxib; P < 0.01)、腎不全になるリスク(2.22 vs 1.09; P < 0.01)はrofecoxibに比し、セレコキシブで有意に低かった。Zhao SZ, et al: Clin Ther 23: 1478-1491, 2001
④ 19,163人のコホートスタディでセレコキシブはロフェコキシブに比し、末期腎不全に移行するリスクが有意に低かった。Kuo HW, et al: Drug Saf 19: 745-751, 2010
⑤ 44人の男性前立腺がん患者のコホートスタディ。セレコキシブ800mg/日の大量投与でもeGFRに変化がなかった。Benson P, et al: Clin Nephrol 78: 376-381, 2012
そして最後の論文は
⑥ 24,081人の患者を3種のNSAIDsにランダムに割り付けたPRECISION study(RCT)で重篤な腎イベントはイブプロフェン群(平均2,045±246mg/日で日本人用量の3倍以上)に比しセレコキシブ群(平均209±37mg)で有意に低かったが、ナプロキセン群(852±103mg/日)とは差なし。Nissen SE, et al: N Engl J Med 375: 2519-2529, 2016
ただし⑥の論文に関してはFunded by Pfizer(ファイザー社による資金提供で行った試験)でした。セレコキシブの平均用量は平均209±37mg(セレコキシブの最大用量は400mg/日ですが、400mgカプセルもあり、急性の痛みの管理と原発性月経困難症の治療のために、投与量は最初に400mgの後200mgを追加可能です。これは日米でほぼ共通です)でほぼ日本の常用量200mg/日と同じであったのに対し、イブプロフェンは600mg/日程度が日本の常用量なのに対し、平均2,045±246mg/日で日本人用量の3倍以上でした(イブプロフェンの最大用量は医療用で3,200mg/日、OTC薬で1,200mg/日)。これはいくら何でも明らかに日本に比しイブプロフェンの用量が多すぎなので、日本で応用できるとは思いません!しかもこの稿の①⑤の論文で使用しているセレコキシブは800mg/日と⑥のこの論文の4倍量でナプロキセンに有意差を付けてGFRの低下が軽減されたのです。⑥の大用量のイブプロフェンに比し、低用量のセレコキシブの方が腎障害が少なくなるのは当たり前ではないでしょうか。それにしても2,000mg/日を超える投与量のイブプロフェンと比較するなんて、意図的じゃないのかな・・・。日本ではイブプロフェンは比較的安全性の高いNSAIDと思われていますが、米国では日本の常用量の5倍用量以上の投与が可能なので他のNSAIDsと同じ扱いでした。イブプロフェンはマイルドなイメージで安全なのではなく、日本人用量が少なかっただけだと今は思っています。
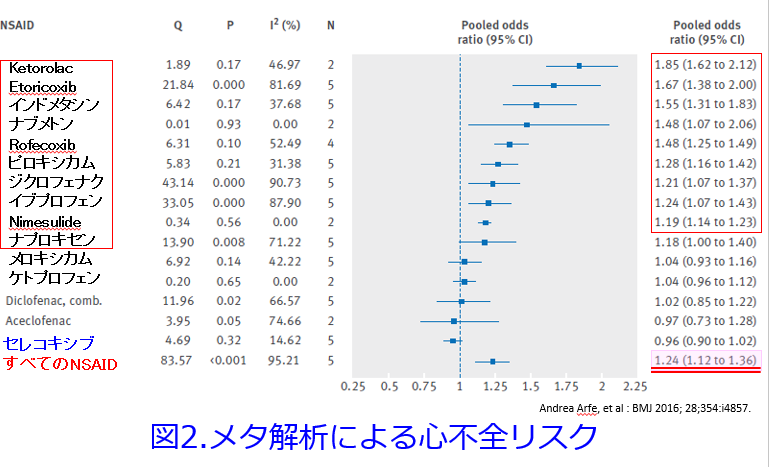
COX-2選択的阻害薬の第1号のrofecoxibは世界中で、8,000万人以上の人々使われブロックバスターになりましたが、88,000~140,000例の重篤な心臓病が発生して市場から撤退しました。しかもメーカーのメルク社はこれらのリスクに関する情報をキャッチしていながら、公表を差し控えたことが明らかになり、大問題になりました。セレコキシブも同じCOX-2選択的阻害薬ということで、疑念がかけられましたが、8,246,403人の大規模研究ですべてのNSAIDsを総合すると心不全の入院リスク入院が24%増加している中で、セレコキシブが一般的な服用量で心不全のリスクを高めたという根拠がないことが明らかになりました(図2)1)。
ジクロフェナクについてはあまり良い報告がありません。NSAIDs使用開始から30日以内のMACE(主要な心血管イベント)発症率を比較するとイブプロフェン群、ナプロキセン群に比し有意に発生率が高いという報告2)、ジクロフェナクは1日投与量の2倍で心不全リスクが2倍以上になるという報告1)、ジクロフェナク服用30日以内の心血管リスクはNSAIDs非投与群に比しすべてのMACEの発症率が有意に高く、アセトアミノフェンに比し、主要心血管病変の発症率が有意に高く、イブプロフェン、ナプロキセンに比しMACEの発症率が有意に高いことなどが報告されています3)。
引用文献
1)Andrea Arfe, et al : BMJ 2016; 28;354:i4857.
2)Schmidt M: BMJ 2018 Sep 4;362:k3426. doi: 10.1136/bmj.k3426.
3)Carter S, et al: JAMA Network Open. 2018;1(3):e180756. doi:10.1001
◆連載◆13日目 NSAIDsの腎障害は腎前性腎障害(腎虚血)だけじゃない
NSAIDsによる腎障害 ~Triple whammyを防げ~
13日目 NSAIDsの腎障害は腎前性腎障害(腎虚血)だけじゃない
~ 4種類のAKIと1種類の慢性腎不全 ~
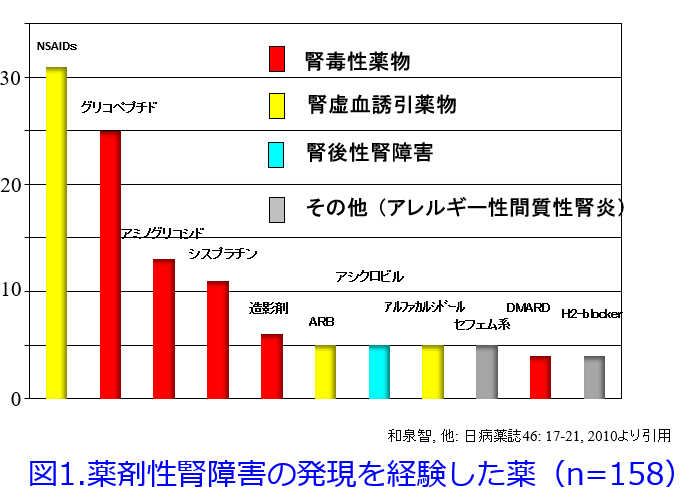
薬剤性AKIの原因薬物のワースト3はほとんどの報告でNASIDs、抗菌薬、抗がん薬で、その中でもNSAIDsは抗菌薬と常に1位、2位を争うほど薬剤性AKIの原因薬物として頻度が高いのです(図1)1)。
ただし高齢者を対象とすると脱水による腎虚血を来たしやすいためNSAIDsが薬剤性腎障害の原因薬物のトップになります2)。腎機能が低下しているCKD患者ではレニン‐アンジオテンシン-アルドステロン系(RAAS)や交感神経系が亢進して腎機能の低下を食い止めています。これにより糸球体過剰濾過が起こり、腎の仕事量増大によってネフロン数は経時的に低下する状態にありますが、PGI2やPGE2やヒト心房性利尿ペプチド(hANP)などの血管拡張物質によって腎機能の悪化を食い止めているのです。
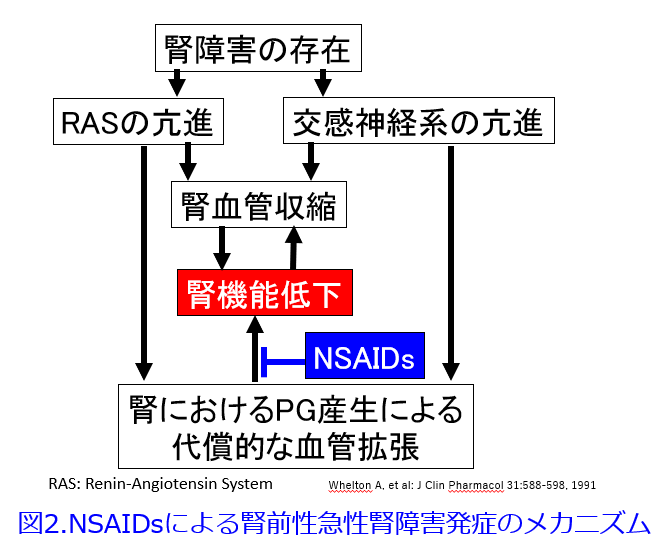
NSAIDsによる薬剤性腎障害のメカニズムはシクロオキシゲナーゼ(COX: cyclooxygenase)の阻害を介してPGの生合成を阻害する薬理作用に起因します。PGI2やPGE2は血管拡張物質ですが、これらの産生を低下させることによってNSAIDsは輸入細動脈の血管を収縮させ、腎血流の低下から、GFRの低下をもたらします(図2)3)。
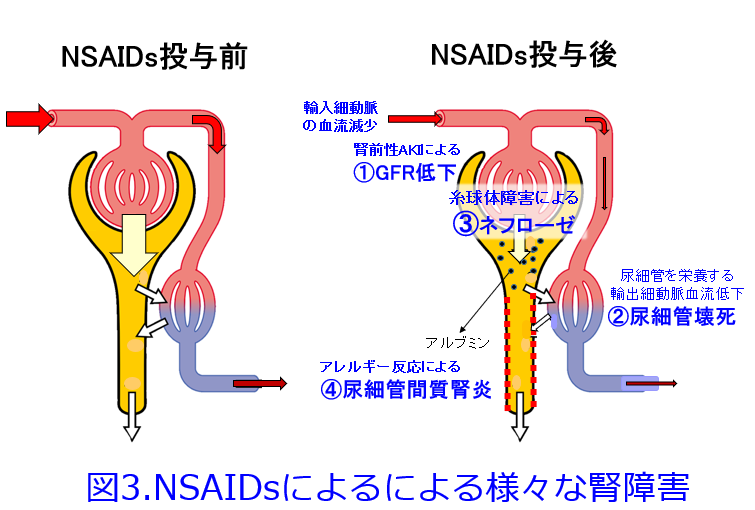
NSAIDsは上述のような①輸入細動脈収縮による腎前性AKI以外にも、様々なメカニズムでAKIを発
症します。②尿細管を栄養する輸出細動脈の虚血による尿細管壊死(脱水状態が持続すると重篤化します)、③免疫反応が介在するポドサイト障害による微小変化型ネフローゼ症候群、膜性腎症などの糸球体障害、④アレルギー性間質尿細管性腎炎(図3)、さらにこれまで紹介したAKIではなく、慢性腎不全に至るのがOTC薬のアスピリン+アセトアミノフェンなどの鎮痛薬配合剤の長期大量連用による腎乳頭壊死(鎮痛薬腎症)があります。
米国老年医学学会の疼痛治療ガイドラインでも非選択性NSAIDs、COX-2選択的阻害薬は極めて厳重に注意して投与すべきであり、特殊な症例を除いて投与してはならない(質の高いエビデンス、強力に推奨)となっています4)。高齢者の持続的な痛みに対する初期および持続的薬物療法、特に筋・関節痛に対してはアセトアミノフェンを推奨(効果および安全性に関して質の高いエビデンスがあり、強く推奨)しています5)。ただしアセトアミノフェンは肝不全には禁忌、アルコール中毒・肝障害には慎重投与で1日投与量は4gを越えないことが肝要です6)。
COX-2は炎症時に産生され、血管内皮や平滑筋、糸球体に限局して発現し、血管透過性亢進、発熱、痛みの発生に関与しているため、抗炎症作用のみを期待するにはセレコキシブ、メロキシカム、エトドラクなどの選択的COX-2阻害が望ましいことが期待されています。しかしCOX-2は例外的に腎臓と脳では構成型酵素であるためCOX-2選択的阻害薬でも腎障害が非選択性NSAIDsと同様に起こると考えられています。ただしCOX-2選択的阻害薬の中には多くの論文で、他の非選択的NSAIDsよりも腎障害を起こしにくいという報告があるものがあります。それは次回に解説させていただきます。
引用文献
1)和泉 智, 他 日本病院薬剤師会雑誌, 46: 17-21, 2010
2)Baraldi A, et al: Nephrol Dial Transplant, 13: 25-29, 1998
3)Whelton A, et al: J Clin Pharmacol 31:588-598, 1991
4)American Geriatrics Society Panel on Pharmacological Management of Persistent Pain in Older Persons: J Am Geriat Soc, 57: 1331-1346, 2009
5)Swan SK, et al: Ann Intern Med, , 133: 1-9, 2000
6)Henrich WL, et al: Am J Kidney Dis 27: 162-165, 1996
◆連載◆12日目 Triple whammyによる脱水を早期発見せよ
NSAIDsによる腎障害 ~Triple whammyを防げ~
12日目 Triple whammyによる脱水を早期発見せよ
Triple whammyによる腎機能の悪化は脱水の早期発見で悪化を食い止めることが可能です。ではどうやってこれらの腎前性AKIの診断をしているかというと、血清クレアチニン値の上昇、尿量の減少はすべてのタイプのAKIの診断基準ですが、最も正確な腎前性AKIのマーカーは尿中Na排泄分画(FENa: fractional excretion of sodium米国人はフィーナと発音する)が1%未満、あるいは尿中Na濃度の低下、
尿浸透圧の上昇などで鑑別できるという検査です(表1:このような一覧表はこのブログのカテゴリ→育薬に活用できるデータベース→薬剤性腎障害で印刷も可能です)。
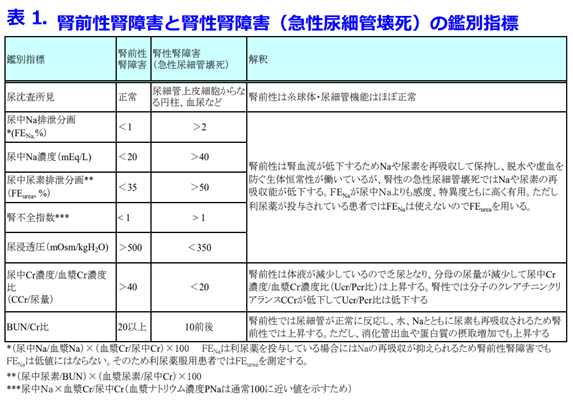
尿中Na排泄分画=(尿中Na/血漿Na)×(血漿Cr/尿中Cr)×100 で示されますが、Triple whammyには利尿薬が含まれますので、Naの尿中排泄が増えるのが当然ですから、利尿薬併用者では特異度の高いFENaが信頼できないためFEurea(尿中尿素排泄分画:35%未満で腎前性、50%以上で腎性腎障害を疑う)を測定しますが、このような尿検査は腎臓内科以外ではあまりやりません。
そのためより簡易な腎前性AKIのマーカー(脱水のマーカー)としてはBUN/Cr比>20が使いやすいと個人的には感じております。通常はBUN/Cr比は10程度ですが、脱水になると20を超えます。ではCrに比べて尿素濃度だけが上がるのはなぜだかわかりますか?Crは尿細管からわずかに分泌されますが、再吸収されないため、生体内物質で最も優れた腎機能マーカーですが、尿素もCrと同様に窒素老廃物として尿中に排泄されますが、再吸収されてしまうのです。脱水時に腎臓は尿量を減らして、脱水を防ぎます。その時にCrは全く再吸収されませんが尿素は水・Naとともに再吸収されるため、Crは上がらないのに、BUNのみ上がってBUN/Cr値が通常、10だったのが20を超えてしまうということで、BUN/Cr>20が脱水のマーカーとなるのです。
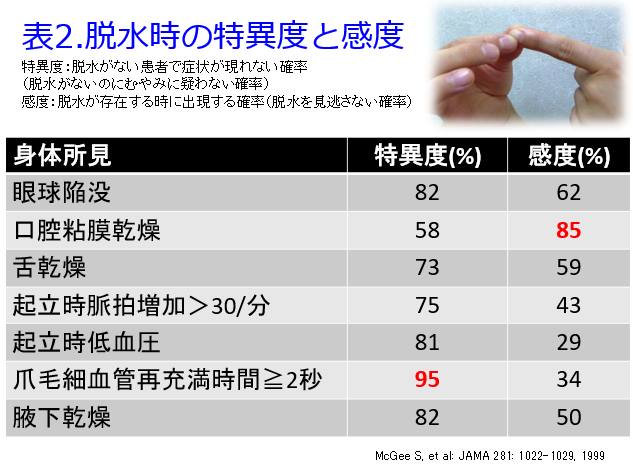
病院薬剤師であれば検査値で脱水が分かるため、医師に輸液を依頼すれば済むことですが、検査データの得られない保険薬局で脱水を早期にキャッチする方法をご存知でしょうか?一番簡単な方法は爪毛細血管再充満時間≧2秒です(3秒という人もいますが原著論文では2秒だったと思います)。これは片方の人差し指を5秒間圧迫すると、つめの色はピンク色から白色になりますが、圧迫を解除しても2秒以上白色のままだと特異度95%で脱水を疑えます。そして口腔内を観察させていただくと、唾液がなく口腔粘膜乾燥があれば感度85%で脱水が疑われるので、この2つを組み合わせると非常に高い精度で脱水を発見できます(表2)1)。
もともと大災害や大事故などの時に大量の救急患者が押し寄せた時に、どの患者をICUに入れるかを決める簡易な判断として、爪毛細血管再充満時間≧2秒を使っていたそうです。これが2秒以上だと循環機能が低下しているため優先的にICUに入れるというトリアージに有用だとされています。この簡単な検査をMcGeeが脱水に使えることを明らかにしました1)。もっと簡単なのは体重減少や血圧の低下ですので、保険薬局には体組成も測定できる体組成計や血圧計を置いておくべきでしょう。
著名な輸液の専門家は皮膚の張り(ツルゴール)の低下が脱水の良いマーカーになることで推奨しています。手の甲をつまんでピラミッドを作ると速やかに元に戻るのですが、脱水をきたすとピラミッドがそのままになります(図)。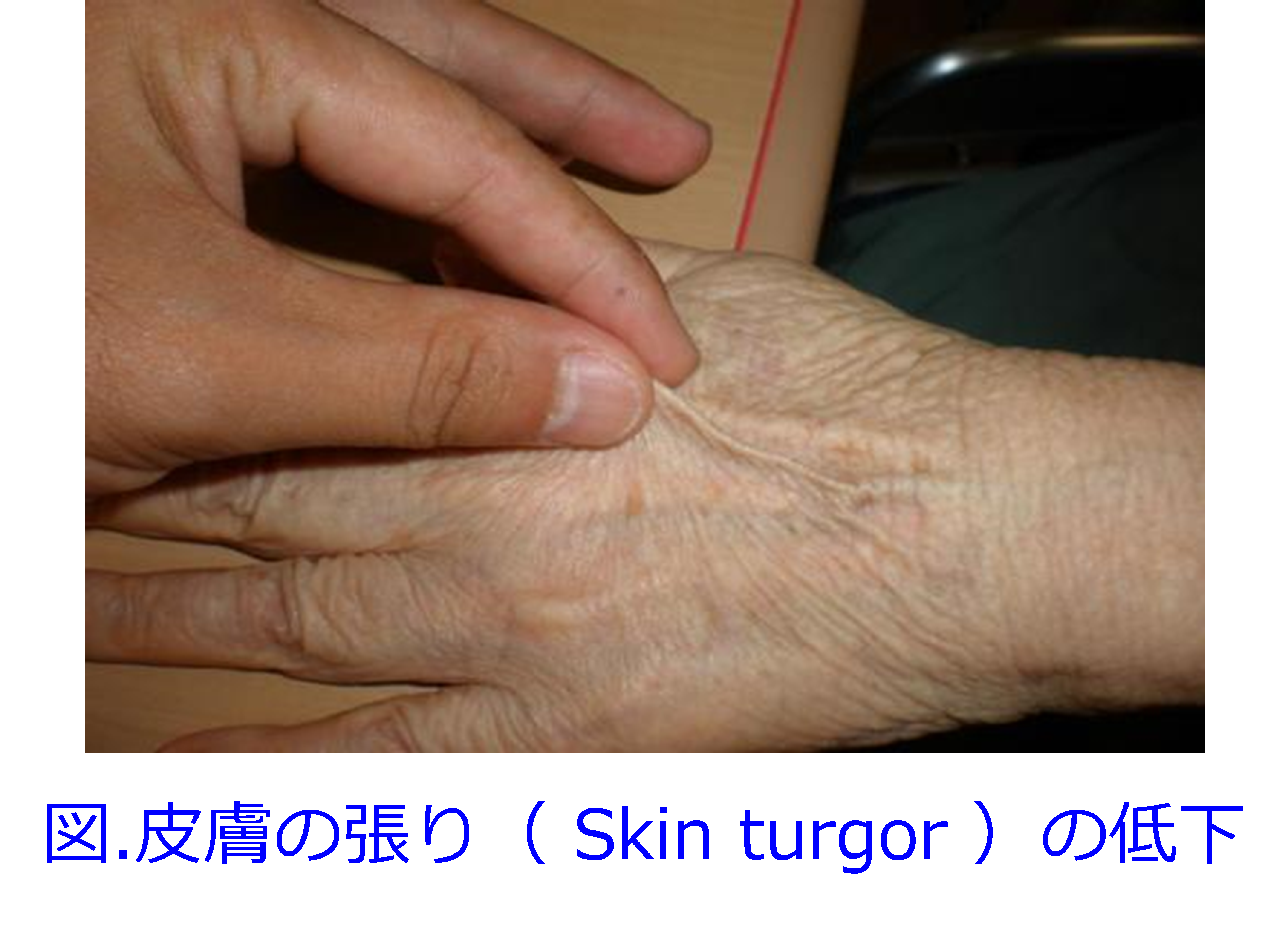 ただし高齢者はしわが多いのでもともとツルゴールが低下している方もいるそうですが、これらの簡単な脱水の見分け方は、患者さんやその家族の方に覚えていただいてもいいのではないかと思っています。
ただし高齢者はしわが多いのでもともとツルゴールが低下している方もいるそうですが、これらの簡単な脱水の見分け方は、患者さんやその家族の方に覚えていただいてもいいのではないかと思っています。
脱水になりやすいリスクを持っている患者さんはもともと腎機能が低下しているCKD患者、高血圧患者、糖尿病患者、高齢者で起こりやすく、脱水状態(下痢・嘔吐、夏季の発汗、発熱、感染症、食べられない、起立性低血圧、腋下乾燥、口腔内乾燥、急激な体重減少)、そして薬剤についてはTriple whammyなど、詳しくは1日目の表. NSAIDsによる腎前性急性腎障害の危険因子が参考になります。
引用文献
1)McGee S, et al: JAMA 281: 1022-1029, 1999
第6回 薬剤師塾 開催案内
第6回 基礎から学ぶ薬剤師塾 10月5日(火)18時から20時(予定)の申し込みを始めます。
第6回のテーマは「NSAIDsの腎障害 ~アセトアミノフェンに腎障害はある?~」です。現在ブログ「平田の薬剤師塾」で連載中のテーマについてですね。
RAS阻害薬+利尿薬+NSAIDsのTriple Whammy処方はとても危険ですが、RAS阻害薬と利尿薬はそれなりの有用性があります。しかしNSAIDsに関しては痛みを抑える以外で何ら得をすることのない薬だと平田は考えています。では腎障害だけじゃなくってどんな副作用が怖いの?どうやって痛みを抑えるの?外用薬は安全?NSAIDsの中で一番、胃障害や腎障害の少ないものは何?代替薬のアセトアミノフェンは本当に効くの?アセトアミノフェンは危なくないの?について考えてみたいと思います。
参加を希望される方は 申し込みフォーム に記入のうえ、送信してください。

薬剤師塾への参加者はどなたでも構いませんが、ぜひ学会発表を目指している方に参加していただきたいと思います。そしてその先には原著論文を書き、海外の学会で発表し、英語論文をまとめて博士号を取るんだというような大きな夢を持つ人になっていただきたいと思います。300名まで参加可能ですが、最近の登録者数は200名を超えていますので、早めに登録してください。
NSAIDsによる腎障害 ~Triple whammyを防げ~
11日目 薬剤師の服薬指導でTriple whammyを防げれば
無駄な医療費78億円セーブできる?
再びTriple whammyに関する論文について触れさせてください。降圧薬のユーザー487,372人のコホートを平均5.9年追跡して、2,215例のAKIが確認されたというカナダのLapiら1)の報告によると、利尿薬のみを対照とすると、利尿薬+NSAIDsのDouble whammyでは有意なリスクになりませんでした。RAS阻害薬のみを対照とするとRAS阻害薬+NSAIDsのDouble whammyでも有意なリスクになりませんでした。しかし利尿薬+RAS阻害薬のDouble whammyを対照とするとNSAIDsを加えたTriple whammy処方だと有意にAKIリスクが上昇することを明らかにしました(図1)。
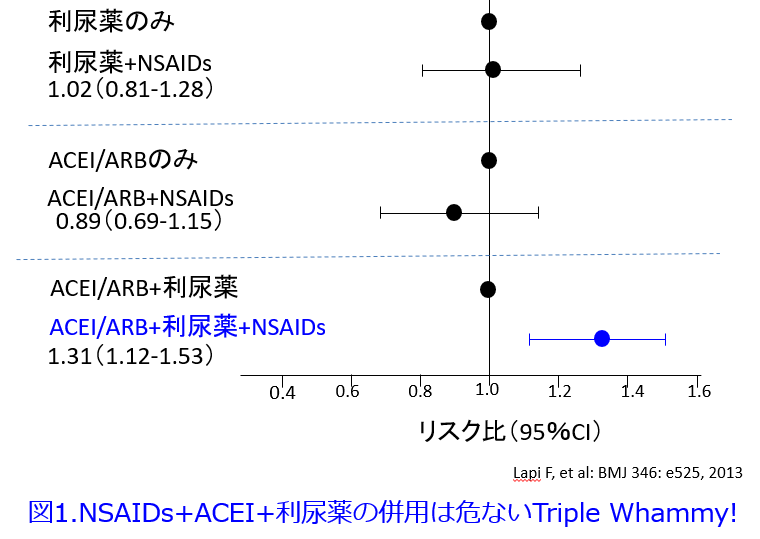
さらにNSAIDsの半減期の長短には関係しませんが、特にNSAIDs投与開始30日までが最も高いリスク(レート比1.82, 95%CI: 1.35-2.46)が観察されました。降圧薬には心血管系の利点がありますが、NSAIDsと同時に使用する場合は警戒が必要だと結んでおります。
ただし、それ以前にNSAIDs単独でAKIを発症するという報告も多くみられます。英国で386,916人を対象とした報告によると2)、NSAIDsを服用していない患者さんを対象とすると、心不全があるだけで急性腎不全になるリスクが有意に高く、NSAIDsの服用者は3.34倍、相対危険度が上昇し、心不全患者がNSAIDsを服用すると7.63倍になりました。高血圧だけではリスクは上昇しませんが、NSAIDsの服用は3.69倍、相対危険度が上昇し、心不全患者にNSAIDsが投与されると6.18倍になりました(図2)。
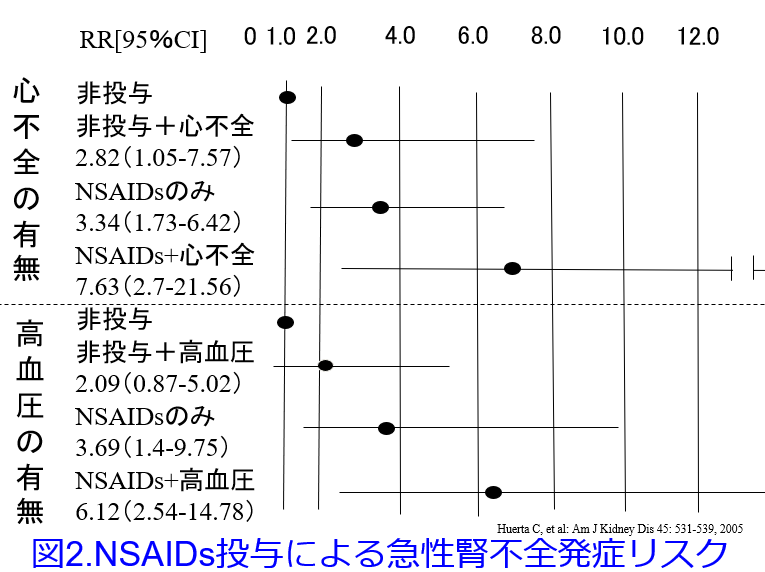
ちなみに利尿薬服用者は2.77倍(1.49-5.12)、ACEI服用者は3.46倍(2.05-5.85)、NSAIDsと利尿薬の併用の相対リスクは11.6倍(95%CI: 4.2-32.2)と心血管に作用する薬物の中で最大のリスクを示しました。
スペインの15,307名の外来患者のコホートによってTriple whammy処方のどの組み合わせが危ないのかについて検討した報告によると3)、NSAIDsやRAS阻害薬単独ではAKIリスクは有意に上昇することはないものの、この報告においても利尿薬は単独でも有意なAKIリスクになり、RAS阻害薬やNSAIDsが加わることによってリスクは増し、Triple whammy処方では8.82倍(95%CI: 2.59-4.45)に急上昇しました(図3)。
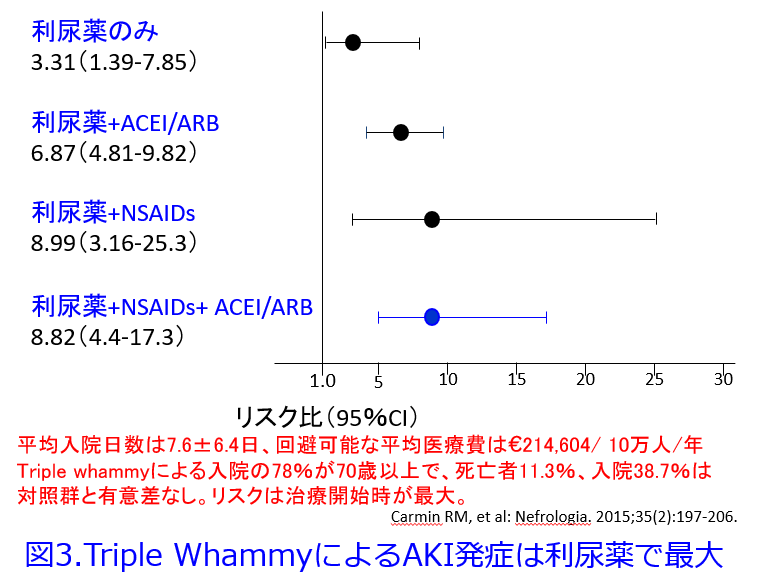
またTriple whammyによる入院は85エピソード38.7%で、死亡者は11.3%に上りました。 患者の78%が70歳以上 で、平均入院日数は7.6±6.4日、回避可能な平均医療費は214,604ユーロ(1ユーロ130円で計算すると約2,790万円)/ 10万人/年と推定されたそうですが、これは日本の70歳以上の数2,791万人(2020年, 人口の22.2%)に当てはめると 77.87億円/年 という膨大な額が副作用に充てられていると予測されます。しかも日本の夏は過酷な猛暑で高齢者の熱中症による入院がとても多いことを考え合わせると、80億円以上になるかもしれません。
薬剤師のまともな服薬指導によってTriple whammyの弊害はかなり防げるはずだと思うのは平田だけでしょうか?77億円以上も日本の医療費を節約できた。それは薬剤師のおかげだったといえる日が来ることを切に期待しております。
引用文献
1)Lapi F, et al: BMJ. 2013 Jan 8;346:e8525. doi: 10.1136/bmj.e8525.
2)Huerta C, et al: Am J Kidney Dis 45: 531-539, 2005
3)Carmin RM, et al: Nefrologia 35:197-206, 2015
◆連載◆10日目 イナーシャになっていませんか?
NSAIDsによる腎障害 ~Triple whammyを防げ~
10日目 イナーシャになっていませんか?
数年前から、薬剤師の間で、ナラティブ・ベイスト・メディスン(Narrative-based Medicine:物語に基づいた医療)、つまり患者さんとの対話を通じて、病気になった理由や経緯、病気について今、どのように考えているかなどの患者さん個人個人が持つご自身の「物語」から,医療者が病気の背景や人間関係を理解して、患者さんの抱えている問題に対して全人的(身体的、精神・心理的、社会的)にアプローチしていこうとする臨床手法が浸透しつつあります。ナラティブ・ベイスト・メディスンは患者との対話と信頼関係を重視し、サイエンスとしての医学と人間同士の触れあいのギャップを埋めることが期待されています。
なかなか治療目標を達成できていなくても、決して患者さんを責めることなく、やさしく接して心を開くことはとても大切で、医療人は「優しい人」以外の方がなってはいけない職業だと個人的に思っています。でもそれと「甘さ」「妥協」とは違うと思うのです。「収縮期血圧が180mmHgだったのが今回、160になったからよかったですね。頑張りましたね」とか「HbA1c、いつも10%以上だったのが9%代になってよかったですね。」というのは本当に良かったのでしょうか?コントロールが悪かったために重篤な合併症が起こった、あるいは死に至ったとしたら取り返しがつかないことになのに・・・・。
臨床イナーシャ clinical inertiaって知っていますか?この用語は高血圧治療ガイドライン2019で僕は初めて目にしました(図)。
そして山口県での糖尿病の講演会の時に一緒に講演してくださった糖尿病学会理事の先生が糖尿病でもイナーシャが問題だとおっしゃっていました。そして2021年6月のベルリンでのERA-EDTAというヨーロッパの腎臓・透析・移植学会でも糖尿病の世界で医療者のイナーシャが問題になっていることを報告していました。Clinical Inertia(臨床的な惰性)とは、治療目標が達成されていないにもかかわらず、治療が適切に強化されていないこと。患者さんの問題を認識していながら、それを解決する行動を起こすことができずに医療人の惰性によって患者の症状が悪化するのが問題だということです。血圧・血糖・脂質が高くても、「これまでより頑張っているから」ではなく医療者は達成すべき目標のために行動を起こす必要があるのです。これこそ患者さんのことを思ってのことなのです。
皆さんは降圧薬が処方されたときに「血圧を下げる薬です」+ひとこと言ってますでしょうか?
さらに「血圧を下げる薬です」+あなたの目標血圧は・・・・と言ってますでしょうか?
「血圧を下げる薬です」+「最近の血圧はどれくらい?」を患者さんに聞いてますでしょうか?
皆さんはDM患者さんに「最近のHbA1cはどれくらい?」を聞いてますでしょうか?
蛋白尿のないCKDの患者さんに対して目標血圧は「診察室血圧で上が140未満、下は90未満で大丈夫です。家庭血圧では上が135未満、下は85未満が目標です。血圧が下がりすぎたら受診してくださいね?」と指導していますでしょうか?
蛋白尿のない糖尿病の目標血圧はCKDと違って130/80未満だということをDM患者さんに指導していますでしょうか?
蛋白尿のあるCKDや糖尿病の第1選択薬は蛋白尿を抑えてくれるRAS阻害薬が最適です。だけど利尿薬や活性型ビタミンDが併用されていたら、「特に夏は汗をかくので多めの水を飲んでくださいね、もしも体調不良で体重が急激に減ったり、血圧が下がりすぎたり、しんどい時にはこれらの薬はいったん飲むのをやめて受診してくださいね。これらのことは処方医の先生と話し合ったうえで了解を得ていますので」、という服薬指導をしていますでしょうか?
Triple whammy処方によって腎障害のリスクの高い患者さんにはNSAIDsをアセトアミノフェンに変更、NSAIDsを頓服に変更、NSAIDsを処方するなら利尿薬をやめる、他剤に変更するなどの疑義照会を行い、NSAIDsを処方せざるを得ないのなら、「痛くないときには飲まない方がいいです」と指導していますでしょうか。
わが国の高血圧患者は4,300万人で降圧目標を達成できているのは1,200万人のみです。これによって脳卒中・心筋梗塞・心不全・腎不全は高い頻度で発症しています。高血圧や糖尿病を甘く見てはいけません!わが国で明らかな糖尿病患者は1,000万人、23.4%が未治療、予備軍の4割が未治療と言われています。糖尿病や脂質異常症の分野でもイナーシャが問題視されています。薬剤師に優しさは不可欠です。でも優しい薬剤師と思われたいためにイナーシャになってはいけないと思うのです。
◆連載◆9日目 降圧薬処方に対して薬剤師らしい服薬指導やってる?
NSAIDsによる腎障害 ~Triple whammyを防げ~
9日目 降圧薬処方に対して薬剤師らしい服薬指導やってる?
高齢者の腎機能を悪化させるのはTriple whammyだけじゃありません。高血圧の是正も重要なのです。糖尿病性腎臓病、CKD患者の目標血圧はご存知でしょうか? 各患者様に単に「血圧の薬です」「血糖値を下げる薬です」とだけ言って渡していませんか?これって服薬指導といえますか。薬剤師だったら1歩踏み込んで、指導しなきゃいけないと自覚していますでしょうか?
忙しすぎる?時間がない?患者さんが聞いてくれない?患者さんは医師の前ではいろんなことを訴え、いろんなことを学んでますよね。なんで薬剤師の前では「時間がないから早くして」としか言わないのでしょうか?こんなおかしな状態を1つ1つ薬剤師自身が変えようと思わない限り、何も変わりません。何度も何度も挫折しながらでも、繰り返すことによって少しずつでも変えていこうと思いませんか?薬剤師がまともな情報を発信し続けたら、少しずつ患者さんの薬剤師に対する見る目も変わってくるはずです。少なくとも「できる薬剤師だな」と感じた患者さんはその薬剤師を頼りにしてくれるようになるはずです。
高血圧治療ガイドライン2014 1)では糖尿病と蛋白尿陽性のCKD患者のみの目標診察室血圧が130/80mmHg未満であったのが、5年後の高血圧治療ガイドライン2019 2)では、ほとんどの疾患で実質上130/80未満になりました。従来通り高めの目標値になったのは75歳以上の高齢者(併存疾患の降圧目標が収縮期130未満の場合、忍容性があれば130未満)、両側頸動脈狭窄や脳主幹動脈閉塞あり、または未評価の脳血管障害患者と蛋白尿陰性のCKD患者のみになったのです(表)。

この中で後期高齢者は従来の<150/90から下げられたので、特殊な脳血管障害患者を除けば、2019年のガイドラインは蛋白尿陰性のCKD患者だけが高い血圧管理の140/90未満が推奨されたといってもいいでしょう。日本だけではありません。欧州のガイドラインもわずかな例外を除いて130/80mmHg未満が推奨されていますが、日本も欧州も高血圧の定義は140/90mmHg以上のままです。しかし米国では高血圧の定義そのものが130/80未満になりました。
ではどうしてこのようなガイドラインが大幅に変更されたのかというと、50歳以上で収縮期血圧(SBP)130~180mmHgで、心血管疾患リスク因子 を一つ以上有する9,361例 (糖尿病と脳卒中は除外)を対象にしたSPRINT studyの結果によります。この研究では目標SBP140mmHg群を対象として、目標SBP<120mmHgの群(厳格降圧群)では全死亡のハザード比が0.73に低下した、つまりすべての死亡者数が27%も厳格降圧群で減少したという結果によります(図1)3)。
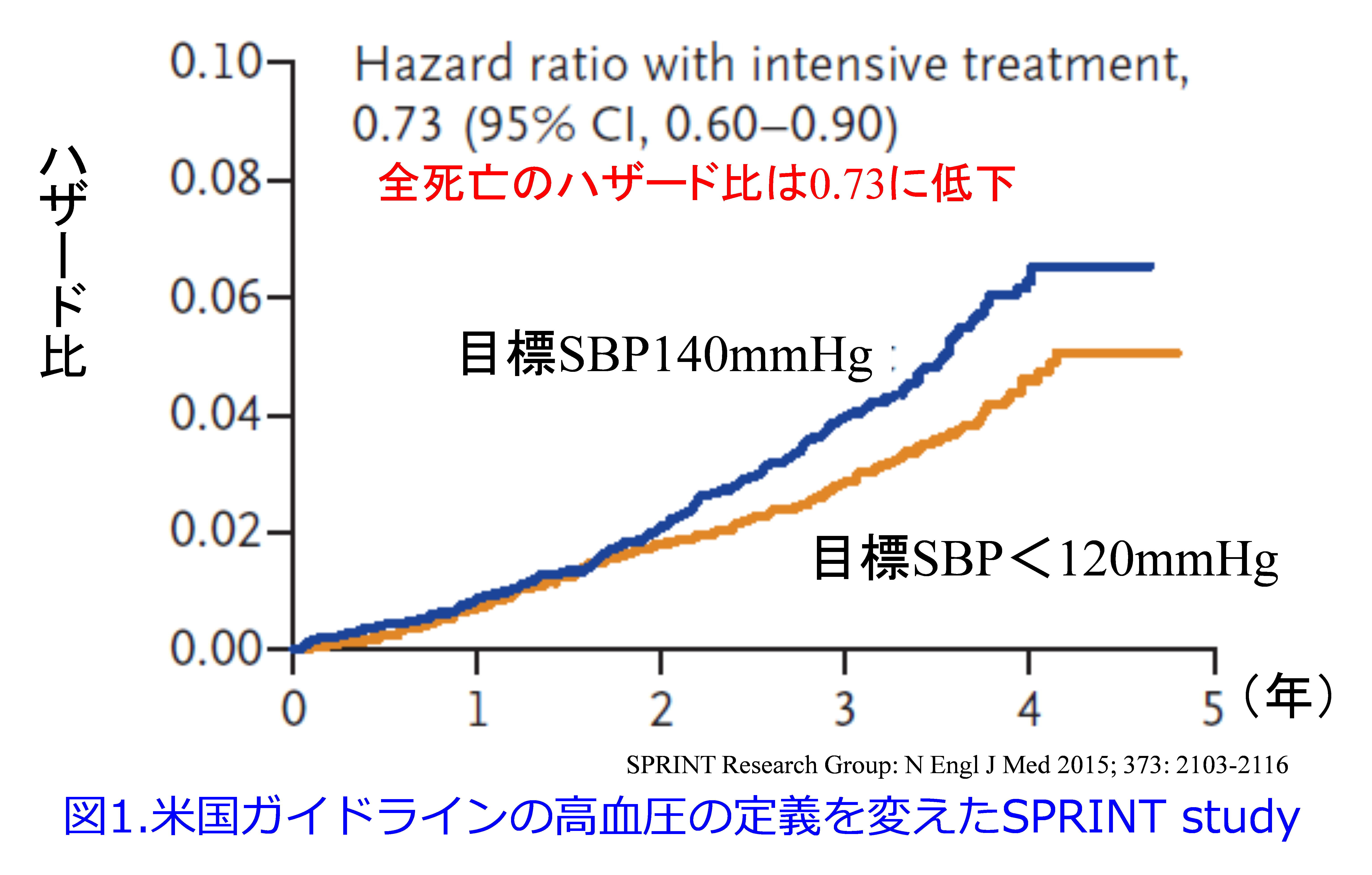
心不全が38%低下、心血管死は43%低下など患者さんの予後を大きく改善し、これらが有意に低下したため目標SBP140mmHgの持続は倫理的に問題ということで5年間の予定が中央値3.26年で早期終了しました。
ただし非CKD患者で30%以上eGFRが低下する腎機能の悪化は厳格降圧群で3.49倍に増加したのです。図2 4)はeGFRが60mL/min/1.73m2以上の非CKD患者6,662例を対象にしたSPRINT studyのサブ解析を示しますが、3年後の心血管病(CVD)インシデントは厳格降圧群で29%低下したものの(図2左)、CKDになるインシデントは逆に厳格降圧群で3.53倍増加してしまったのです(図2右)。
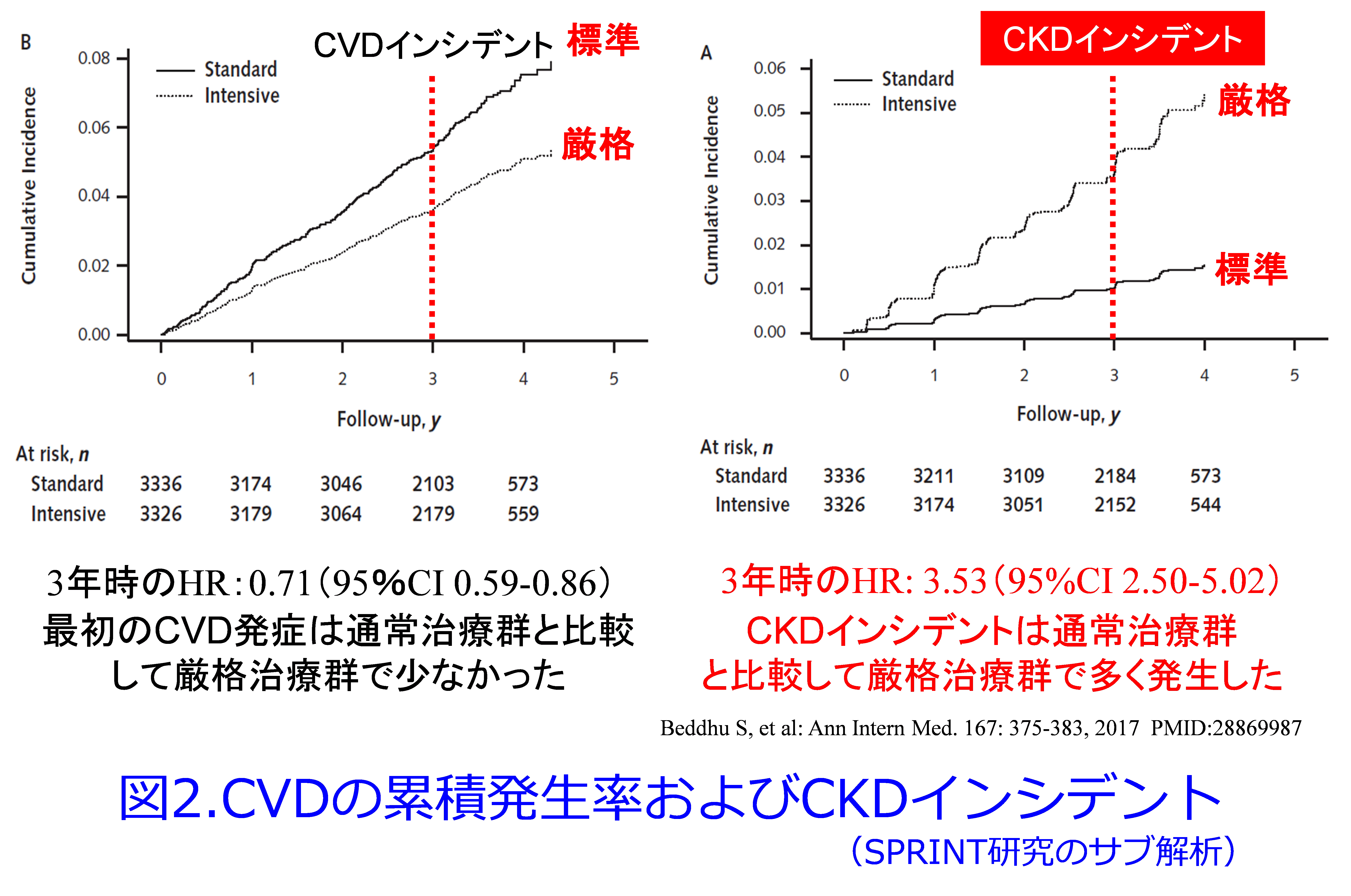
じゃあなんで米国だけ高血圧の定義まで変えたのかというと、米国では腎機能の悪化よりも心血管病変の改善による利益の方がはるかに高かったからじゃないかと思います。米国は肥満大国でがんよりも心臓病による死亡者が多い国ですから、CKDという病気は透析導入の原因疾患としてよりも、透析導入になるまでに心血管病によって死亡するリスクの方がはるかに高いからだと思います。片や日本ではCKDはいまだに慢性腎不全による透析導入が大問題なのです。だから米国では腎機能悪化のリスクよりも、心血管疾患減少というベネフィットをとって厳格降圧は絶対にいいんだということで130/80未満になったのだと平田は愚考します。
ということで、今回は血圧についてでした。全身血圧が高いということは動脈硬化を起こして細動脈の内腔が狭まるし、糸球体内圧も高くなって、蛋白尿が漏れ出て腎機能を悪化する原因になります。動脈硬化性疾患である糖尿病性腎臓病の目標血圧は130/80mmHg未満、CKD患者の目標血圧は蛋白尿(+)なら130/80mmHg未満ですが、蛋白尿(-)なら140/90mmHg、つまり蛋白尿がなければ過度の降圧はメリットよりもデメリットの方が大きいので、例外的に高めに設定されたという理由が分かっていただけたかと思います。
もう1度繰り返します。各患者様に単に「血圧の薬です」だけ言って薬を渡していませんか?これって服薬指導のうちに入りませんよね。薬剤師だったら1歩踏み込んで、何のためにこの降圧薬をのまなくちゃいけないのか?目標血圧はいくらなのかをきちんと指導していただきたいと強く思います。これによって心血管疾患の発症、腎機能の悪化を抑えられるかもしれないのですから。
引用文献
1)日本高血圧学会: 高血圧治療ガイドライン2014
2)日本高血圧学会: 高血圧治療ガイドライン2019
3) SPRINT Research Group: N Engl J Med 373: 2103-2116, 2015
4) Beddhu S, et al: Ann Intern Med 167: 375-383, 2017
◆連載◆8日目 利尿薬の利点・欠点
NSAIDsによる腎障害 ~Triple whammyを防げ~
8日目 利尿薬の利点・欠点
~Triple whammy処方のシックデイ対策、していますか?
利 点
エビデンスに基づくCKD診療ガイドライン2018 1)ではCKDステージ全域でサイアザイド系利尿薬・ループ利尿薬は、浮腫を呈するなど体液過剰の症例に推奨されています。またサイアザイド系利尿薬は血清Ca濃度を上げるため、高齢者に高頻度で見られる骨折リスクを予防効果が報告されています2)。さらにALLHAT試験ではHFpEF(拡張不全)による心不全入院率はアムロジピン群,リシノプリル群に比べてサイアザイド系利尿薬のクロルタリドン群で有意に減少しています3)。だから利尿薬は日本での処方率は低くても第1選択薬から離れないのだと思います。
欠 点1)
後期高齢者でCKD ステージG4~G5 では脱水や虚血に対する脆弱性を考慮し,Ca拮抗薬を推奨するとされています。またサイアザイド系・ループ利尿薬ともに低カリウム血症に十分注意が必要であるとされており、アルドステロン阻害薬は高カリウム血症などの副作用の懸念からCKD患者への投与の際には慎重を要するとされています。またサイアザイド系はステージG4~G5 では効果が減弱します。
利尿薬+RAS阻害薬+NSAIDsのTriple Whammy処方は腎機能悪化のリスクが上昇する恐れがあり、腎機能悪化のリスクがさらに上昇する可能性が高いため、CKDステージ3b以降では、お薬手帳などを参照して、できるだけ避けるべきであると記載されています1)。
CKD患者ではAKIを発症しやすいため、発熱・下痢・嘔吐などがあるとき、ないしは食思不振で食事が十分摂れないような場合(シックデイ)にはRAS阻害薬、NSAIDs、利尿薬のTriple Whammy処方は休薬することが提唱されています。特に高齢者では飲水不良や嘔吐・下痢、発汗過多などによる脱水や過度の塩分摂取制限には注意する必要があると記載されています1)。KDIGOガイドライン4)ではAKIを防ぐために利尿薬の投与を推奨していません。
上記のようにRAS阻害薬にも利尿薬にも欠点はありますが、様々な利点もあります。しかし痛みを抑える以外に、NSAIDsに何らかの利点があるでしょうか?NSAIDsの副作用についてはすでに論じたように、胃障害、出血、肝障害、腎障害、アスピリン喘息、高血圧をはじめとした心血管病変の悪化など非常に多彩ですから、低用量アスピリンを除き、痛みを抑える以外のメリットは感じられません。抗炎症作用があるって?本当に抗炎症作用があるなら慢性炎症にNSAIDsは有効でしょうか?整形外科の先生方に聞いてみるとNSAIDsを疼痛緩和(痛み止め)以外の目的で使っている方は皆無でした。だからTriple whammy処方の中で、RAS阻害薬、利尿薬はベネフィットがある限り、うまく使っていきましょう。でもベネフィットのないNSAIDsはできるだけ飲んでもらいたくない。これから医師と協議して以下の服薬指導を実践していただきたいと考えます。
医師と協議して実践していただきたい薬剤師の服薬指導
②NSAIDsは痛くなければ飲まなくてよいという服薬指導ができるよう、医師と協議する
③脱水や薬剤性腎障害を助長する処方にNSAIDsが併用されていたら、アセトアミノフェンへの変更を提案する疑義照会
④腎機能が不明、あるいは分かっていても、過大評価されているサルコペニア患者や発汗しやすい夏季の高齢者へのバラシクロビル処方を胆汁排泄型のアメナメビルへの処方変更を提案する疑義照会
⑤夏季には発汗による脱水を防止するため、飲水励行させていただくよう医師と協議する(溢水のためループ利尿薬が投与されている症例を除く)
⑥食事が摂れなかったり、発熱や下痢・嘔吐が続いている、血圧が低い、急激な体重減少などの脱水症を引き起こしやすい状態である体調不良時には糖尿病と同様にシックデイ・ルールを確立して、NSAIDs、RAS阻害薬、利尿薬、活性型ビタミンDなどの腎前性の薬剤性AKIの原因薬物を一時休薬する服薬指導をさせていただくよう医師と協議する
⑦溢水のためループ利尿薬が投与されている症例では1日で体重〇kg減少したら服用をやめる、さらに1日で〇kg減少すると「飲水を促す」服薬指導させていただくよう医師と協議する
⑧腎機能悪化時にメトホルミンや炭酸リチウムの服用を中止するよう、服薬指導する統一したシックデイ・ルールについて医師と協議する
NSAIDsによる腎障害については実は多彩なのですが、これについては11日目以降に解説します。
引用文献
1)日本腎臓学会: エビデンスに基づくCKD診療ガイドライン2018.
2)van der Burgh, et al: Bone. 2020 Sep;138:115475.
3)Davis BR, et al: Circulation 118: 2259-2267, 2008
4)KDIGO Clinical Practice Guideline for Acute Kidney Injury 2012

