2021年11月
臨床で使用可能な薬物除去率予測式の構築④
※次回連載予定「SGLT2阻害薬による心腎保護作用と適正使用」のための
SGLT2阻害薬に関する事前クイズ(解答・解説付き) にご協力ください!
村上らによる透析による新たな薬物除去率予測式の改訂11)
Urataらによる簡易式は静注製剤のみによって構築されていたため、筆者の指導学生であったMurakami11)はこれに信頼性の高いバイオアベイラビリティのデータの備わった経口薬を含め、これまでに重要と言われてきたPBR、1/Vd、MWに加え、新たなパラメータとしてインタビューフォームの多くで記載されているn-オクタノール/水分配係数(O/W係数)の導入を検討したが、フィット性はUrataの示した3項目が最大であったため、断念した。再びMW、PBR、fe/Vdを用いるUrataの方法を踏襲して、新たな透析除去率の予測式の構築を試みた。これまでの簡易式の問題点として医薬品インタビューフォームに記載されているデータは①透析前後の濃度変化率で示されている可能性があること、②尿細管分泌や尿細管再吸収の寄与する薬物はfeの精度が低くなる可能性がある、といった問題点があることに着目した。
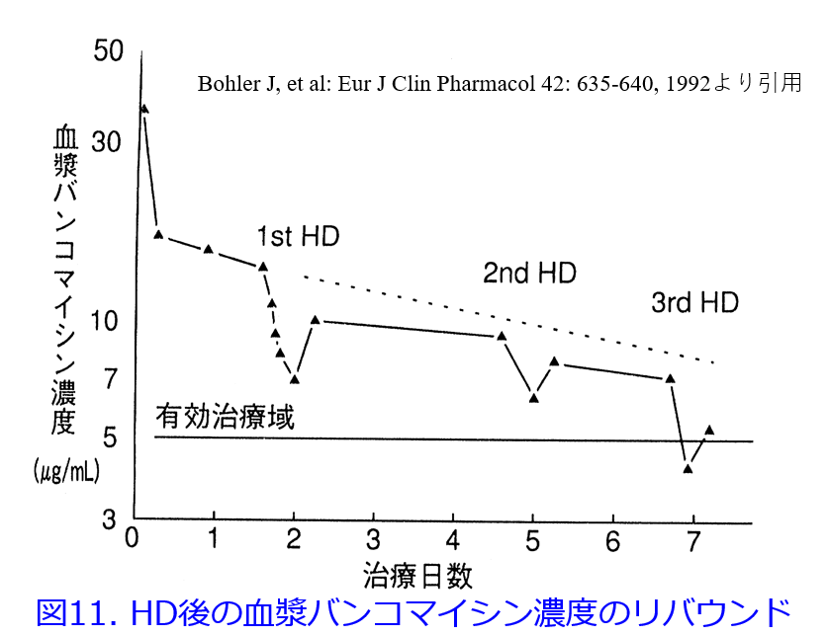
インタビューフォームには薬物の透析性について透析前後の血中濃度変化率を「透析による除去率」として記載されているものがあるが、「薬物の透析性」とは透析前後の血漿薬物濃度変化率ではなく、体内から薬物がどれだけ除去されたかを示す値である(図10)。透析終了直後から数分から1~2時間後にはすべての薬物でリバウンド現象が起こるため、濃度変化率では過大評価されてしまう(図11)。我々はこれらの問題点を考慮し、尿細管分泌や尿細管再吸収の寄与する薬物、および透析による除去率であれば越えるはずのない限界値、maximum dialysis rate by hemodialysis (MDR)を超えているため、濃度変化率と思われるデータを除外した。
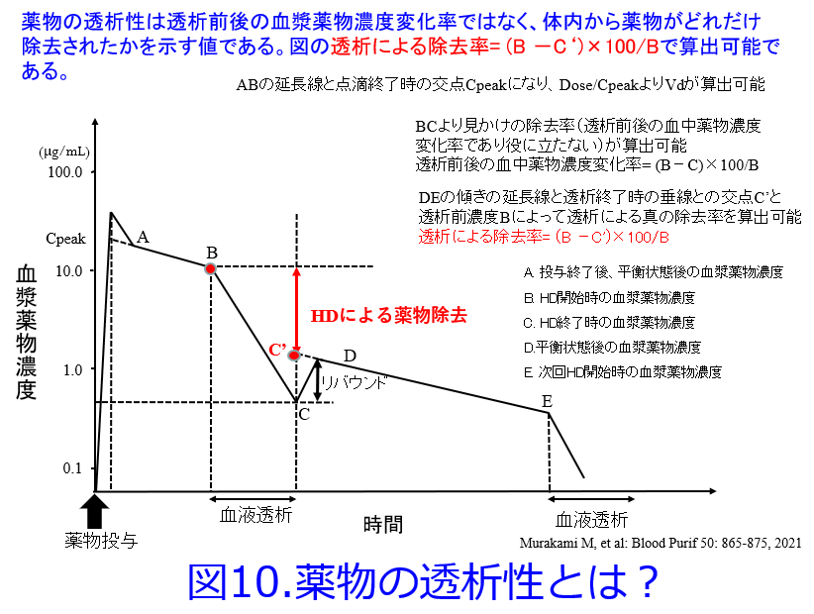
ここで初めて用いたMDRの概念は日本透析医学会の統計調査における透析患者の平均体重54.9kg、2015年版慢性腎臓病患者における腎性貧血治療のガイドラインを参考としてヘマトクリット値30%の患者についてリバウンド現象を考慮して、日本の標準透析条件 (QB = 200mL/min、QD = 500mL/min、週3回で1回4時間) で施行されたときに遊離型薬物の最大値、つまり、透析による除去率であれば越えるはずのない限界値、MDRを式(2)によりそれぞれの薬物について算出し、これらを超える薬物は血漿濃度変化率であるか、透析後のリバウンドが考慮されていない薬物として除外したのである。
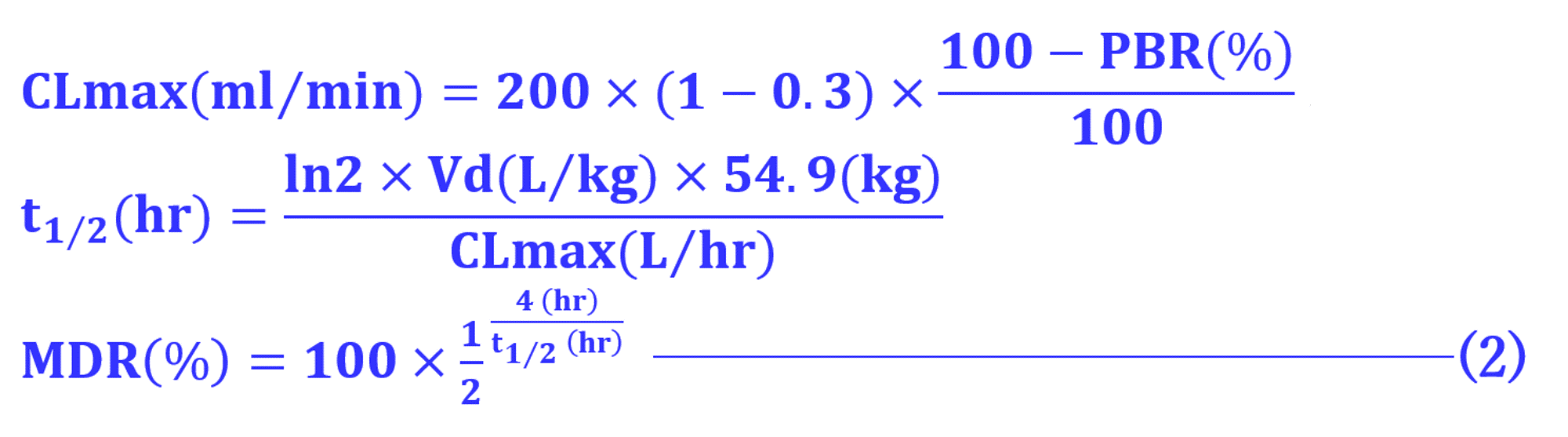
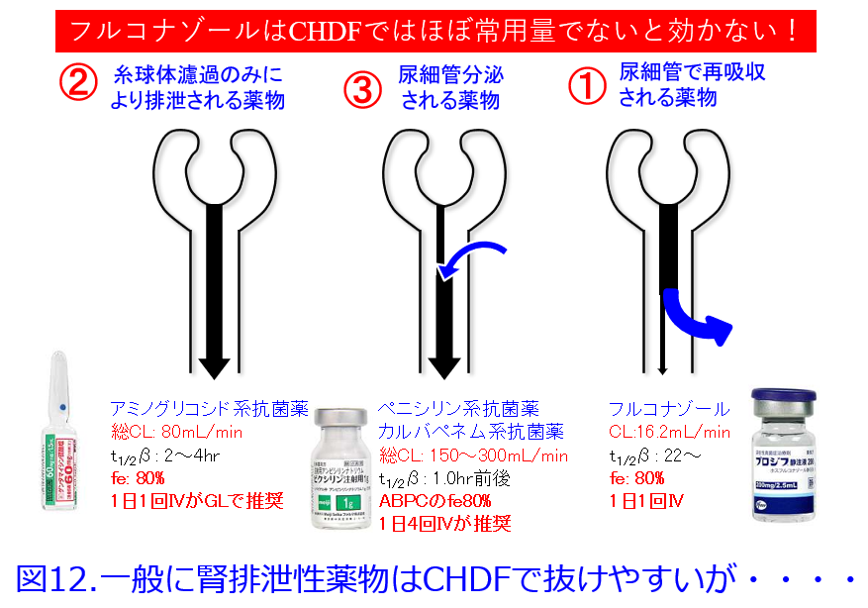
さらに我々はO/W係数を用いても予測性が向上しなかったことから、やむなくUrataの方法と同じ親水性を表すパラメータとしてfeを用いたのだが、feは糸球体濾過のみによって排泄される薬物の予測性には問題ないものの、尿細管分泌される薬物や再吸収される薬物は糸球体濾過量を反映しないことに着目した。つまり脂溶性の薬物で、通常は腎排泄されない薬物であっても尿細管分泌されるようなプラミペキソールやフロセミドのような薬物や、親水性であってもフルコナゾールのように尿細管で再吸収される薬物のfeは80%と高いものの、再吸収されるため腎CLは極めて小さいので、正確な親水性のパラメータになりえず、透析性が極めて高い(図12)。この理論に基づき、医薬品インタビューフォームあるいは文献上で尿細管分泌や尿細管再吸収の寄与することが明らかな薬物、つまり尿細管トランスポータの基質になる薬物も除外した。
まず浦田の方法と同様に訓練データを用いて透析による薬物除去率(実測値)を目的変数、様々な薬物動態パラメータ・物理科学的データを説明変数として、ステップワイズ法による重回帰分析を行い、最終的にlogMW、PBR、fe/Vdが透析による薬物除去率と独立して相関しており、Urataらの簡易式(rs = 0.75)に比し、より高い相関性を示した(R=0.911、P=2.2e-16)、作成した予測式は以下の通りとなった(平田・浦田・村上式: Hirata, Urata, and Murakami formula: HUM式)。
透析による薬物除去率(%)=
-17.32×[logMW(Da)]-0.39×[PBR(%)]+0.06×[fe(%)/Vd(L/kg)]+83.34 (3)
テストデータを用いて予測値と臨床報告値の相関性の検定を行ったところ、高い相関性を示した (R=0.93, P=1.87e-6) 。また、ME、MAE、RMSEはそれぞれ-3.34(95%CI: -10.03, 3.35)、9.59、16.48であった(図13)。

引用文献
11) Murakami M, Narita Y, Urata M, Ichigi M, Nakatani S, Fukunaga F, Kondo Y, Ishitsuka Y, Irie T, Kadowaki D, Hirata S: Revised Formula for Predicting Hemodialyzability of intravenous and oral drugs. Bllod Purif 9: 1-11, 2021
臨床で使用可能な薬物除去率予測式の構築③
※次回連載予定「SGLT2阻害薬による心腎保護作用と適正使用」のための
SGLT2阻害薬に関する事前クイズ(解答・解説付き) にご協力ください!
浦田基樹らによる透析による薬物除去率を予測する簡易式の構築10)
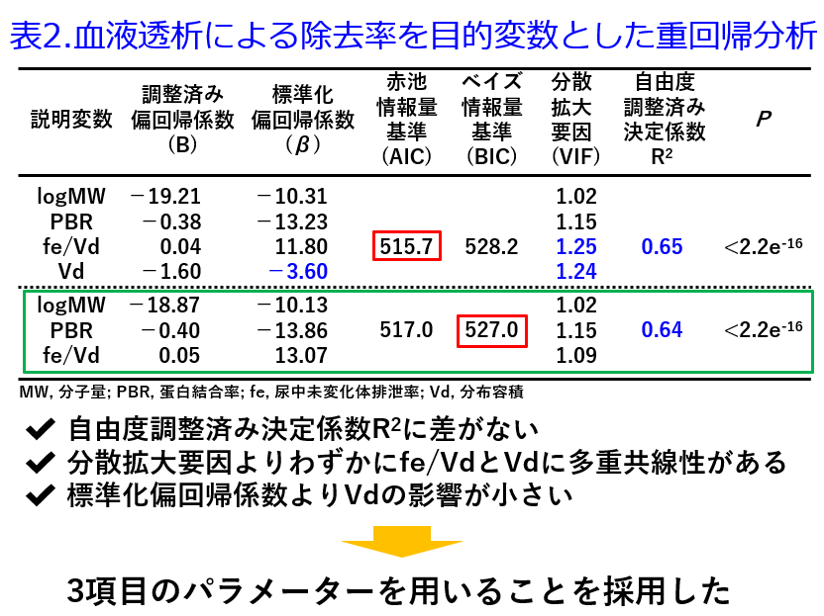
2018年当時、筆者の属する熊本大学生命科学研究部大学院博士課程に在籍していたUrataら10)は成人の透析による除去率ならびに、全ての薬物動態パラメータが抽出された90品目の注射薬を対象として薬物の透析性の予測式作成を試みた。Spearmanの順位相関係数の検定より透析による除去率と有意な相関を示すパラメータは、尿中未変化体排泄率fe(rs = 0.67)、PBR(rs = −0.53)、Vd(rs = −0.32)、1/Vd(rs = 0.32)、(100−PBR)/Vd(rs = 0.61)、fe/Vd(rs = 0.68)、fe*(100−PBR)/Vd(rs = 0.78)、fe *(100−PBR)/ (Vd*logMW) (rs = 0.79)であった。ベイズ情報量基準(BIC)を用いたステップワイズ法による重回帰分析の結果、BICを最小とするパラメータは、logMW(B=−18.87)、PBR(B=-0.40)、fe/Vd(B=0.05)の3項目であったので(表2)、回帰式としてこの3項目のパラメータを用いることを採用し、透析による薬物除去率を予測する以下の簡易回帰式が作成された(図9)。ここで特筆すべきはfe/Vdの採用である。前述したとおりVdが大きければいかなる血液浄化法でも除去不能であるが、Vdが小さいと除去可能かというとそうではない。例えばワルファリンは脂溶性薬物であり、PBRが99%以上と極めて高い。そのためアルブミンにトラップされて血管外に出ていけないのでVdは0.15L/kgと小さい。Vdは小さいものの、PBRが極めて高いため、透析クリアランスは血流量200mL/minの場合、透析クリアランスは2mL/minにもならない低値であり、当然、血液透析では全く除去できない。Vdを補正する何らかの親水性・疎水性を表すパラメータで修飾する必要があったが、Urataはfeを選び、fe/Vdを採用したところが、素晴らしいアイデアであったと思える。Urataの作成した式は以下のとおりである。
透析による薬物除去率(%) =
-18.87×logMW(Da)−0.40×PBR(%)+0.05*fe(%)/Vd(L/kg)+90.78 ―(1)

簡易回帰式より導いた予測値とインタビューフォーム値は有意な正相関(rs = 0.75)を示した。Mean prediction error (ME)、mean absolute prediction error (MAE)、root mean squared error(RMSE)はそれぞれ0.59(95%CI: −5.10, 6.28)、8.29(95%CI: 4.66, 11.93)、7.07であった。この薬物除去率予測式は当時としては世界で最高の精度であった。というよりもこのような試みはほとんど検討されていなかったのが事実だが、R2=0.64では、簡易式の域を出ることができず、臨床に用いるにはもう少し高い精度のものが必要と思われた。
引用文献
10) Urata M, Narita Y, Fukunaga M, Kadowaki D, Hirata S: A simple formula for predicting drug removal rates during hemodialysis. Ther Apher Dial 22: 485-493, 2018
NSAIDsによる腎障害 目次
『NSAIDsによる腎障害 ~Triple whammyを防げ~』の目次です。
2日目:NSAIDsはTriple Whammyの1つ(その1)
3日目:NSAIDsはTriple Whammyの1つ(その2)
4日目:NSAIDsはTriple Whammyの1つ(その3)
5日目:NSAIDsはTriple Whammyの1つ(その4)
6日目:NSAIDsはTriple Whammyの1つ(その5)
7日目:Triple Whammy の片割れ、RAS阻害薬の利点・欠点
11日目:薬剤師の服薬指導でTriple whammyを防げれば
12日目:Triple whammyによる脱水を早期発見せよ
13日目:NSAIDsの腎障害は腎前性腎障害(腎虚血)だけじゃない
14日目:経口NSAIDsを使うとしたら腎障害の少ないエビデンスレベルの高いものは?
15日目:NSAIDsのパップ剤や全身作用する貼付薬は安全?
16日目:ワルファリンとNSAIDsを併用してはいけない本当の理由
17日目:米国で見た「Tylenol is not an NSAIDs」 というテレビCM
28日目:腎機能低下患者にはセレコキシブかアセトアミノフェンか?
29日目:(最終回)整形外科医のNSAIDs処方の実態と抗炎症作用
臨床で使用可能な薬物除去率予測式の構築②
※次回連載予定「SGLT2阻害薬による心腎保護作用と適正使用」のための
SGLT2阻害薬に関する事前クイズ(解答・解説付き) にご協力ください!
血液透析で除去されにくい薬物
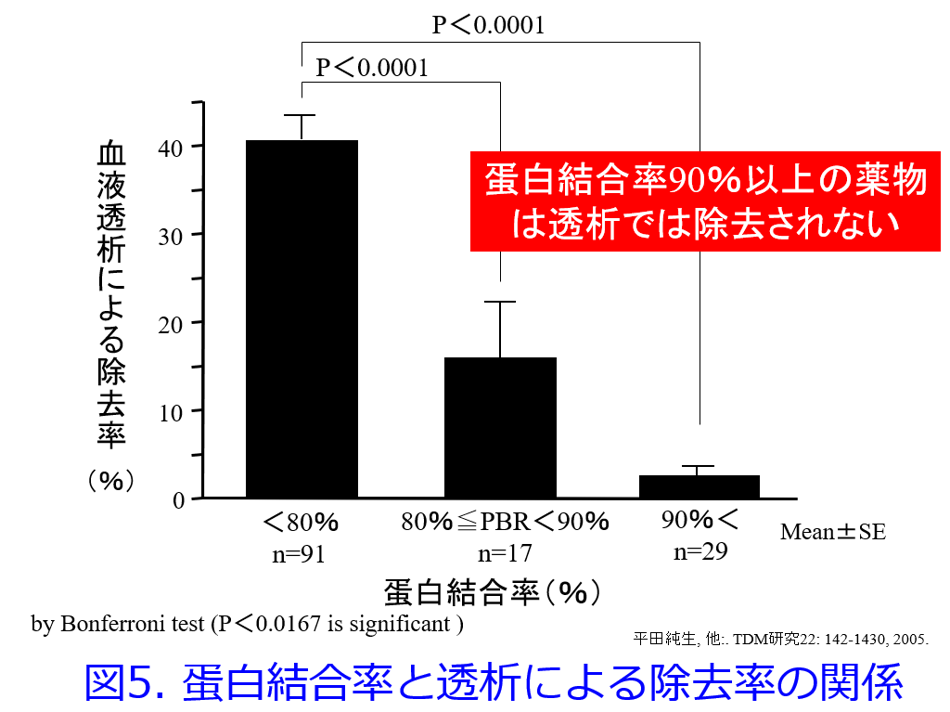
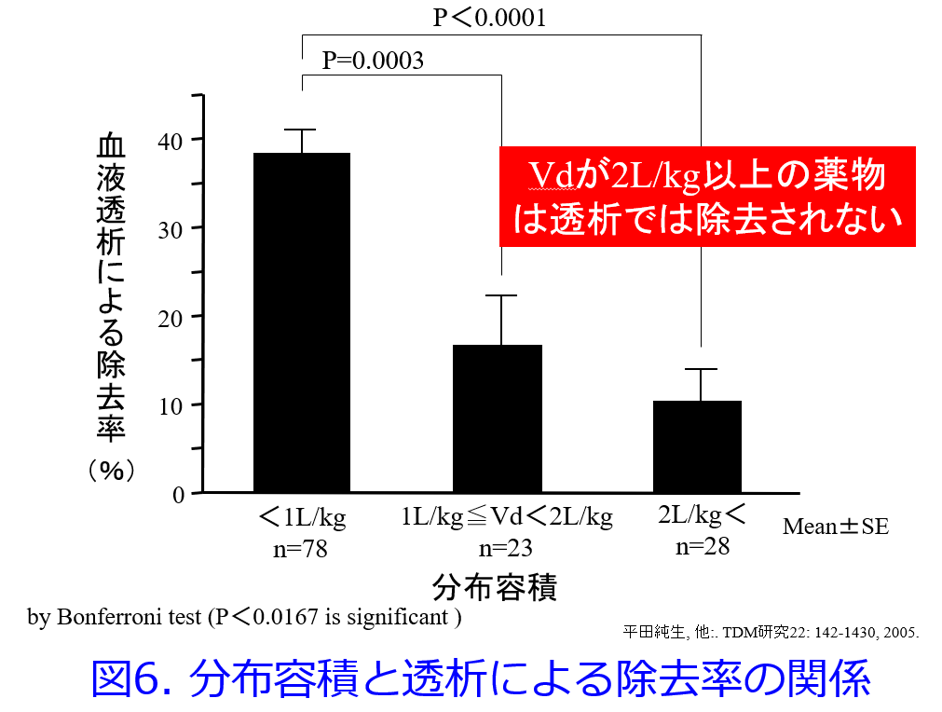
1997年に筆者は血液透析で除去されにくい薬物の共通点はPBRの高い薬物、脂溶性の高い薬物、腎排泄性の低い薬物、Vdが大きい薬物、分子量の大きい薬物であると推測した7)。さらに2004年に筆者は血液透析による除去率とVdの関係は図4に示すように双曲線を描くため8)、直線回帰では1/Vdの方が相関性は高くなるというKellerら6)の報告を確認した。そのうえで、①PBR>90%以上の薬物は血液透析によって除去されない(図5)、②Vd>2.0L/kgの薬物は除去されにくい(図6)、③PBR>80%かつVd>1.0L/kgの薬物は除去されにくい(図7)ことを明らかにした9)。
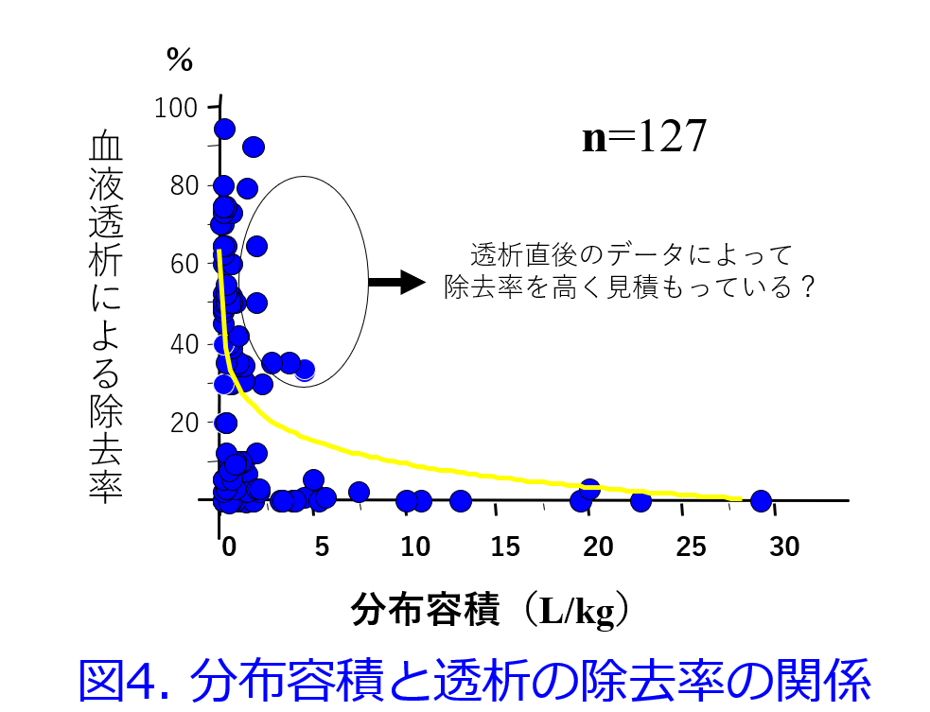
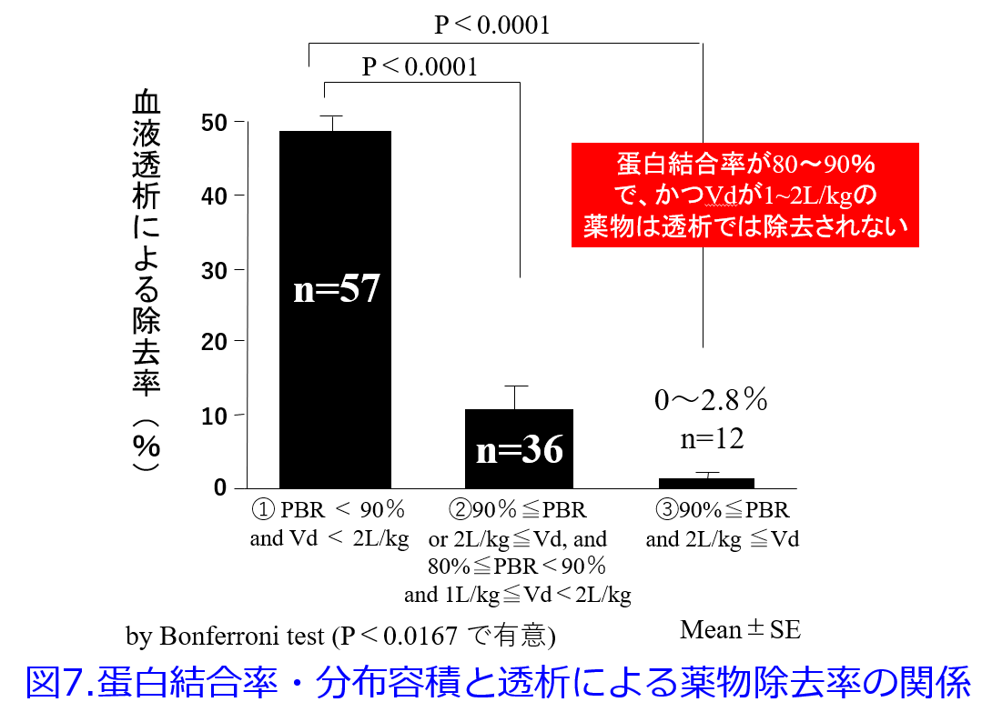
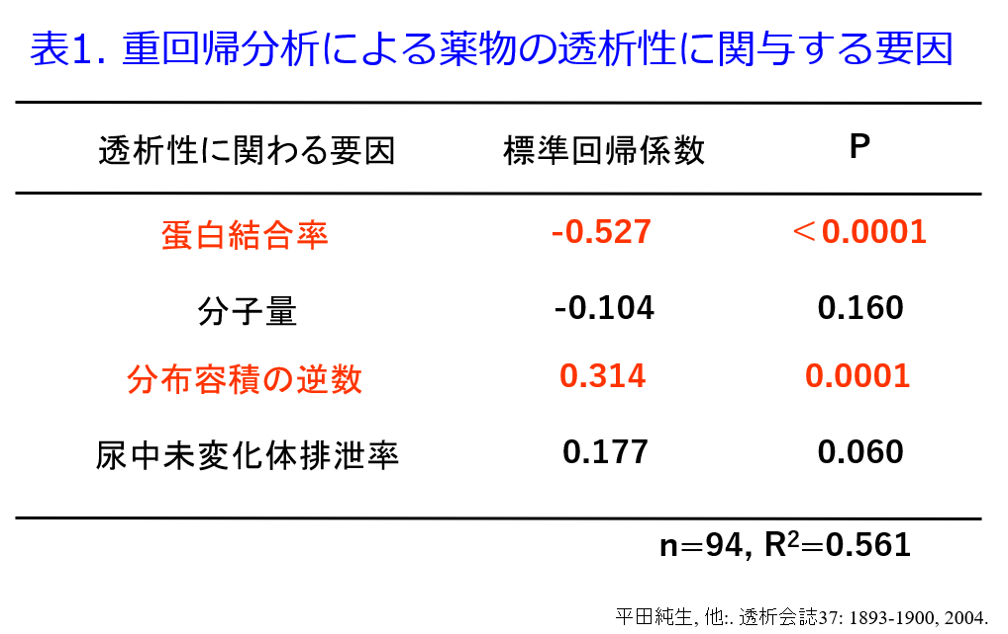
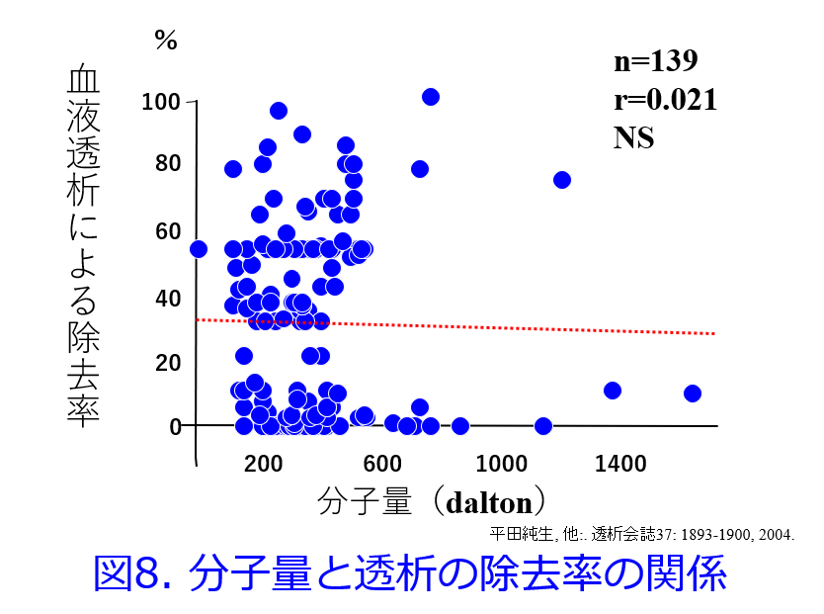
重回帰分析を行うとPBR、1/Vdは薬物の透析性に関与する有意な因子になったが、分子量は有意な因子ではなかった(表1)8)。分子量と除去率の間に相関性は認められなかったものの(図8)、分子量の大きい薬物(MW>2,000)は除去されにくく、アルブミン以上の分子量の薬物(MW>60,000)は全く除去されないことは予測できた。これらの取り組みによって透析によって抜けるか抜けないかを定性的に示すことはできるようになったが、透析による薬物除去率が何%で、透析後に薬物をどれだけ追加すべきかを推算する式、つまり定量的に推算できる薬物除去率推算式については、その後の浦田基樹博士、村上鞠奈氏の貢献が大きい。
引用文献
6) Keller F, Wilms H, Schultze G, Offerman G, Molzahn M: Effect of plasma protein binding, volume of distribution and molecular weight on the fraction of drugs eliminated by hemodialysis. Clin Nephrol 19: 201-205, 1983
7) 平田純生, 金 昌雄, 上野和行, 田中一彦: 薬物の透析性. TDM研究 14: 277-287, 1997
8) 平田純生, 和泉 智, 古久保拓, 太田美由希, 藤田みのり, 山川智之: 血液透析による薬物除去率に影響する要因. 透析会誌37: 1893-1900, 2004
9) 平田純生, 和泉 智, 古久保拓, 太田美由希, 藤田みのり, 山川智之: 血液透析による薬物除去率に影響する要因. TDM研究22: 142-1430, 2005
臨床で使用可能な薬物除去率予測式の構築➀
※次回連載予定「SGLT2阻害薬による心腎保護作用と適正使用」のための
SGLT2阻害薬に関する事前クイズ(解答・解説付き) にご協力ください!
薬物の透析性
透析で除去されやすい薬は透析後に補充投与しないと効かなくなる。例えばアミノグリコシド系の抗菌薬は細胞外液のみに分布し、アルブミンなどの蛋白質にほとんど結合しないため、透析で半分以上が除去されてしまう。当然、濃度依存性の抗菌作用を示すこの抗菌薬の殺菌力は期待できなくなってしまうであろう。βラクタム系抗菌薬も細胞外液のみに分布するが、蛋白結合率(PBR)は薬によってさまざまだ。汎用されているカルバペネム系抗菌薬のメロペネムのPBRはほぼ5%足らずで、ほぼアミノグリコシド系と同様、半分以上は透析で抜ける。ただし第3世代セフェムのセフトリアキソンやセフォペラゾンのPBRは90%なので、ほぼ除去できないので透析後の追加投与は必要ない。グリコペプチド系のテイコプラニンのPBRは90%と高いだけではなく、分子量が1,564~1,894Da(6種の薬物の混合物である)と大きいため、主に拡散の原理によって生体内物質を除去する血液透析では全く除去できない。
薬物の透析性予測式なんて、必要ないと思っている方もいるかもしれないが、体中から抜けた薬物を抜けた分だけ補充する必要があるとすれば、「抜けやすい」「抜けにくい」だけではなく明確に何%抜けるという精度の高い予測式があれば、それは有用なものになるであろう。たとえば抗がん薬を透析患者に投与された報告は極めて乏しい。投与量も論文によって実にさまざまだ。そして透析による除去について体系的に言及した論文はさらに少ない、というかほとんどない。抗がん薬の場合、効きすぎれば、当然、有害反応が起こるであろうし、効かなければがんの悪化によって生死を分けるかもしれないのに、透析によってどれくらい除去されるかどうかについて分かっているものは、シスプラチンなど特殊な抗がん薬を除いてほとんどない。
米国では麻薬の濫用が大きな問題になっており、オピオイドの透析性についてはかなり探求されている。横紋筋融解症やQT延長といった重篤な副作用の多いメサドンに関しては、PBRが89.4%で分布容積(Vd)が1~8L/kgであることから、動態的に見て透析では抜けないことは明らかである(後述)。透析で抜けないという報告が古くからすでに複数あり1)2)、最近の報告ではメサドンの1日投与量の2.3%(範囲、1,25-3,70%)であったという報告3)や古い報告でも1%しか抜けないという報告4)があるにもかかわらず、メサドン専用の透析性の予測式を作ったという報告もあるが5)、ほとんど臨床的な価値はないと思う。
ある種の薬物の透析性は論文になりやすいのだ。例えばAという新薬の透析性については検討がされていなければ、動態的には除去されないことが分かり切っていたとしても、医師が査読をすると「新規性がある」とみなされ、容易にアクセプトされる。そしてCHDならまたノイエス、CHDFの報告は初だからノイエス、CHFでもノイエス、CVVHDFでもノイエスとみなされアクセプトされる。もっとひどい文献だと、知りうる限り最大の分布容積の薬物「アミオダロンによる透析性」についての英語論文の査読を依頼されたことがあるが、本来、筆者は教育的な配慮からrejectしない方針であるが、さすがにこれは「透析で全く除去されないことは動態的に明らかなことなのに、数名の透析患者で頻回採血を行って透析性を調べた」ことは倫理的に間違っているということですぐさまrejectしたことがある。このように薬物個々の報告、様々な血液浄化法での報告もまた、あまたとあるが、このような報告を待たなくても、あるいは文献を検索しなくても、1つの予測性の高い式ができれば、有用なことは間違いないのだが、これに関する報告は極めて少ないのが現実なのだ。
薬物の透析性に関わる因子
1983年にKellerらがPBR, 分布容積の逆数(1/Vd), 分子量を基に薬物の透析性の予測式を作成したが、R2=0.27と低く、臨床では全く使えないものであった6)。ただしこの報告により薬物の透析性に関わる因子はPBRと分子量以外にも、Vdが重要であることが明らかにされた。
Vdは薬物の組織移行性を表す指標で、前述のようにアミノグリコシド系の抗菌薬やβラクタム系抗菌薬は親水性であるため細胞膜の脂質二重層を通過できないので細胞外液のみに分布する。細胞外液が体重の20%であるためこれらの薬物のVdは0.2~0.3L/kg(重症感染症では炎症によってアルブミンが間質液に漏出するため0.3L/kg近くになる)となるが、PBRが90%のセフォペラゾン、セフトリアキソンはアルブミンにトラップされているため、間質液内濃度は血清濃度の1/10になるので、Vdは0.2L/kg以下になる(図1)。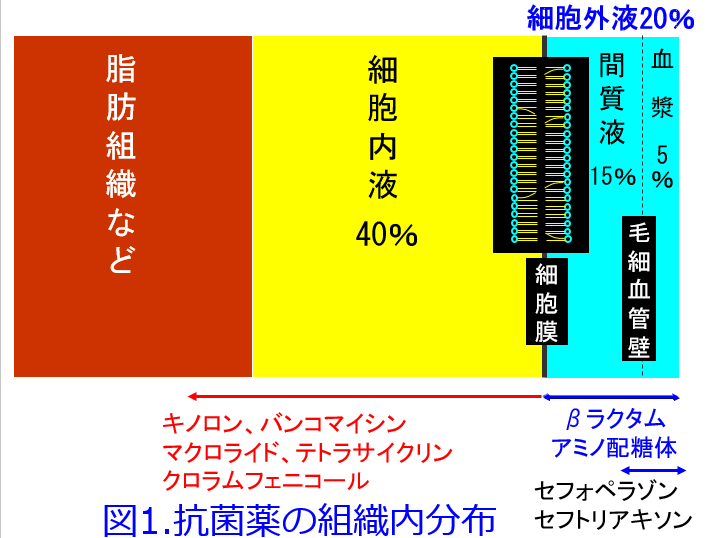
尿素や炭酸リチウムは分子量が100Da以下の水溶性物質であるため、脂質二重層の細孔を自由に行き来できるため(図2)、細胞内液・細胞外液に均等に分布する。そのためこれらのVdは体内水分量に等しい0.6L/kgになる。
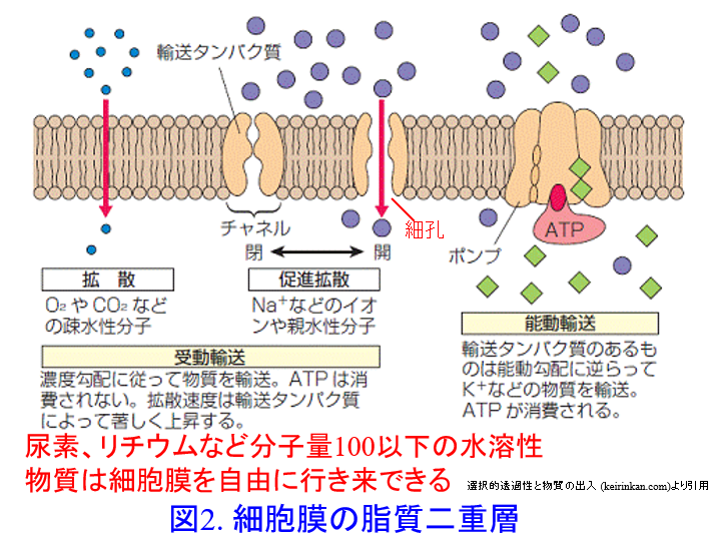
では強心配糖体のジゴキシンはどうだろうか?ジゴキシンはNa+-K+-ATPase阻害薬であるためこの酵素が多く存在する心筋や骨格筋に高濃度で分布し、心筋では血清濃度の30~70倍、骨格筋には10~20倍の高濃度で分布するため、血清濃度は相対的に低くなる。Vd=体内薬物量/血清濃度で表されるため、ジゴキシンのVdは4~8L/kgと高い。血清及び間質液、つまり細胞外液を中心に浄化している血液透析だが、ジゴキシンは体内総量の4%しか細胞外液には存在しない(図3)。また組織から細胞外液へのジゴキシンの移行速度が透析による除去速度に比し極めて遅いため、Vdの大きいジゴキシンは透析では除去不可能だ。PBRが高くても活性炭による血液吸着や血漿交換によって除去可能であるが、Vdが大きい薬物は透析だけでなく、いかなる血液浄化法によっても除去されにくいのである。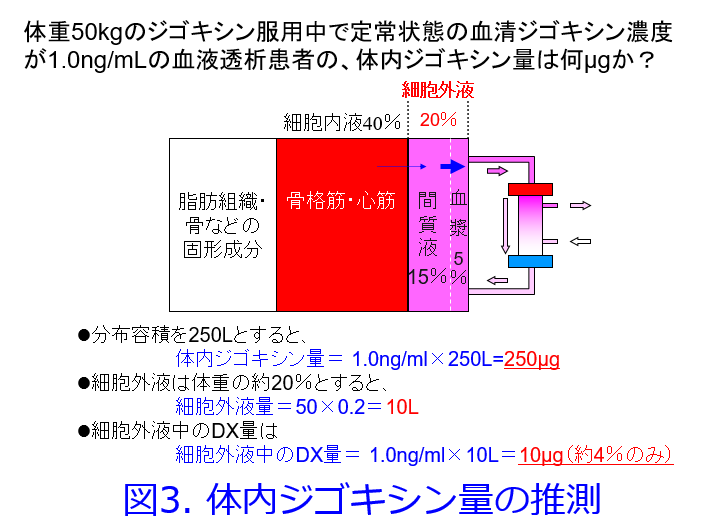
引用文献
1)Furlan V, et al: Methadone is poorly removed by haemodialysis. Nephrol Dial Transplant 14: 254-255, 1999
2)Perlman R, et al: Intradialytic clearance of opioids: methadone versus hydromorphone. Pain 154: 2794-2800, 2013
3)Opdal MS, et al: Effects of Hemodialysis on Methadone Pharmacokinetics and QTc. Clin Ther 37: 1594-1599, 2015
4)Kreek MJ, et al: Methadone use in patients with chronic renal disease. Drug Alcohol Depend 5: 197-205, 1980
5)Linares OA, et al: In silico ordinary differential equation/partial differential equation hemodialysis model estimates methadone removal during dialysis. Daly AL. J Pain Res 8: 417-429, 2015
6)Keller F, Wilms H, Schultze G, Offerman G, Molzahn M: Effect of plasma protein binding, volume of distribution and molecular weight on the fraction of drugs eliminated by hemodialysis. Clin Nephrol 19: 201-205, 1983
◆連載◆29日目 (最終回)整形外科医のNSAIDs処方の実態と抗炎症作用
NSAIDsによる腎障害 ~Triple whammyを防げ~
29日目 (最終回)
整形外科医のNSAIDs処方の実態と抗炎症作用
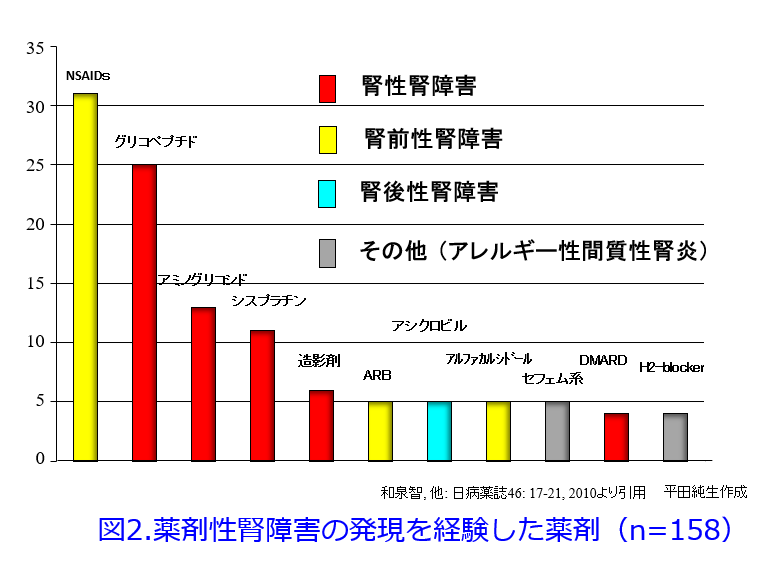
「NSAIDsはよく処方するんだけど、実は僕は腎障害を起こした経験が1度もないんだ」、「NSAIDsは確かによく処方するけど、これによる腎障害ってほとんど報告がないよね」って整形外科の先生方から、聞くことがあります。でも薬剤性腎障害原因薬物のどの調査でも腎障害原因薬物の薬効群では抗菌薬かNSAIDsが1位か2位で、3位は抗がん薬というのは変わりません(図1, 図2:13日目の図1と同じです)。整形外科の先生はNSAIDsを高頻度に処方する科だと思いますが、ほとんど採血をしない科でもありますので、腎機能検査のオーダーをあまり出さないのも原因と思われます。 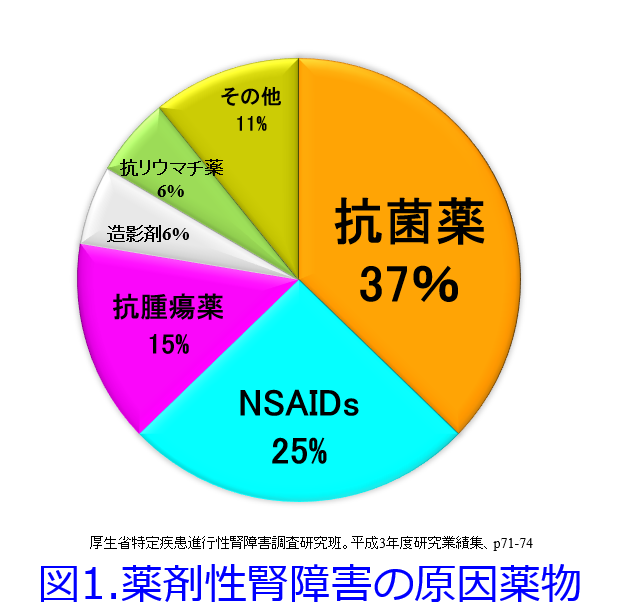
それと腎障害の初期症状は食欲不振、全身倦怠感など腎機能が高度腎機能低下など、かなり悪くなってから発症する尿毒症症状であるため、このような症状が出れば整形外科ではなく、内科を訪れるからではないでしょうか。リスクの高い高齢者では定期的に血清Cr値やBUN、電解質などを測定しなければ、早期の腎障害をキャッチすることはできません。
「高齢者にNSAIDsが連日処方されていますが、RAS阻害薬や利尿薬と併用されているのでアセトアミノフェンに変更していただけませんか?」と薬剤師が電話で疑義照会すると「NSAIDsは抗炎症作用を期待できるから処方してんのや!抗炎症作用のないアセトアミノフェンじゃあかん!」と言われることがよくあるらしいです。確かに炎症を主体とし、侵害受容器が活性化することで引き起こされる痛み、組織炎症が痛みの大きな要因になっている場合にはNSAIDsが効きやすく、NSAIDsは薬物療法の治療の重要な柱となります。ただし慢性炎症による痛みを訴える高齢者に上部消化管障害や腎機能障害、心血管病リスクの高いNSAIDsを1日3錠、毎食後30日分の漫然投与を繰り返すのはいかがなものでしょう?
実際には多くの整形外科の先生方からは「痛み」に対するによる対症療法としてNSAIDsを処方していると聞きます。変形性膝関節症に対してX線画像上の膝関節内側の最小関節スペース幅(radiographic medial minimum joint space width: mJSW)の変化の関連を評価した報告では、NSAIDs使用群では非使用群に比べて、その後のmJSWの損失が有意に増加しました(回帰係数-0.042、95%CI:0.08~-0.0004, P=0.048)。つまり関節軟骨の変性・破壊が進行することが明らかにされています1)。「抗炎症作用を期待しているからNSAIDsでなきゃ」って、いったい何だったのでしょうか?
この連載11日目で解説しましたが、Triple whammyの回避によってかかっていた可能な平均医療費は日本の70歳以上の数2,791万人(2020年, 人口の22.2%)に当てはめると77.87億円/年という膨大な額が副作用に充てられることが予測されます2)。そしてRAS阻害薬や利尿薬には生命予後改善や腎機能悪化速度を遅延するなど複数のベネフィットがあるのですが、NSAIDsに限っては痛みを抑える以外になんら得をすることがなく、飲めば飲む程、高齢者にとってはとても副作用が怖い薬なのです。
健康な男性に対して使用する場合、NSAIDs生涯2,500錠以上投与しても慢性的な腎障害は起こらない3)。65歳未満に対して使用する場合、NSAIDsによって末期腎不全に至るのは生涯で5,000錠以上内服した時である4)、のような報告もあり、NSAIDsの漫然投与は高齢者が問題であって、若年者へのNSAIDsの投与はほぼ問題ないと考えます。
高齢者にNSAIDsを30日分という漫然処方を、せめて頓服にしていただけないものか、あるいはこの処方内容なら、薬剤師は処方医のところに行って「痛くなければ飲まなくていい(本当は痛くないときには飲まない方がいい)」という服薬指導をさせていただくよう、薬剤師は医師と協議していただくとよいのではないでしょうか。変形性膝関節症は加齢とともに有病率が上昇し、80歳代の女性の有病率は80.7%、男性の有病率は51.4%と高く5)、腰痛はもっと多く、男性で1位、女性で2位の有訴者率を占める国民的な症状といわれているのですから6)。
② 特に夏季の飲水励行の実施はNSAIDsによるAKIを予防できるであろう。
③ Triple whammyの中で、NSAIDsだけが痛みを抑える以外の利益がないため、できるだけ頓服処方に変更していただくか、「痛くないときには飲まなくてよい」という服薬指導をさせていただくよう処方医と話し合うとAKIを予防できるであろう。
④ Triple whammyのシックデイ対策を医師と協議し、医師とともにシックデイ対策を服薬指導に取り入れればAKIを予防できるであろう。
⑤ NSAIDsの漫然処方を十分量のアセトアミノフェン(2,400mg/日以上)投与への処方変更によって鎮痛作用を確保し、かつAKIを予防できるであろう。
⑥ 経皮吸収率の高いモーラスⓇや全身作用するロコアⓇテープやジクトルⓇテープは貼付枚数が多いと中毒性副作用が起こりうる。また用量依存的ではない間質性腎炎・糸球体障害はすべての外用NSAIDsで起こりうる。免疫チェックポイント阻害薬投与時のNSAID外用薬の安易な併用には特に要注意。
⑦ 整形外科領域でもリリカⓇ、サインバルタⓇが奏功するかもしれない(イメージ的にはNSAIDsとアセトアミノフェンが先発ピッチャーで、これらが打たれたときのリリーフピッチャーのようなもの)。ただしリリカⓇは腎機能に応じた減量は必須、サインバルタⓇは重度腎障害には禁忌である。
⑧ NSAIDsでも効果ないなら1ランク上げてトラマールⓇまたはトラムセットⓇへの変更もAKIを予防できるであろう。
⑨ 一番腎障害を起こしにくいNSAIDsはクリノリルⓇやハイペンⓇではない。セレコックスⓇには(ランダム化比較試験3つを含む)も他のNSAIDsに比し、腎障害を起こしにくいという論文が6つあるが、CYP2C9を阻害するので、間違ってもワルファリンとは併用しないこと。セレコックスⓇは心不全を悪化させないNSAIDであることも魅力であるが、血中濃度の立ち上がり(Tmax)が遅いので、頓用で使いにくい。
引用文献
1)Perry TA, et al: eumatology (Oxford). 2021 Jan 27;keab059. doi:10.1093/rheumatology/keab059.
2)JAMA. 2001 Jul 18;286(3):315-21.
3)N Engl J Med. 1994 Dec 331: 1675-1679, 1994
4)Carmin RM, et al: Nefrologia 35:197-206, 2015
5)Yoshimura N, et al: Int J Epidemiol 39: 988-995, 2010
6)厚生労働省: 2019年国民生活基礎調査
※次回連載予定「SGLT2阻害薬による心腎保護作用と適正使用」のための
SGLT2阻害薬に関する事前クイズ(解答・解説付き) にご協力ください!
◆連載◆28日目 腎機能低下患者には セレコキシブかアセトアミノフェンか?
NSAIDsによる腎障害 ~Triple whammyを防げ~
28日目 腎機能低下患者には
セレコキシブかアセトアミノフェンか?~UpToDateより~
14日目にセレコキシブは他のNSAIDsに比し腎機能が悪化しにくい報告が5報、800mg/日の高用量服用でも腎機能は悪化しなかったという報告が1報あることはすでに解説しましたが、2021年10月5日の第6回「基礎から学ぶ薬剤師塾」で「セレコキシブはNSAIDsの中でも腎障害が少ないといわれていますが,RAS阻害薬+利尿薬と同時に併用した場合は,やはり中止またはアセトアミノフェンに変更するべきでしょうか?」という質問をいただきました。その時、平田は腎障害になりにくい報告が6報あり、心毒性が低いことからもセレコキシブは捨てがたいと思いました。ただし、漫然投与は避けたいと思っていますので、可能であれば頓服でと思っていたら、セレコキシブのTmaxは2時間と頓服で使うには長いことが薬剤師塾の質問で判明しました。セレコキシブは効果発現時間が長いのが欠点かもしれません。ロキソニンⓇの活性体trans-OH体のTmaxは0.79hr, カロナールⓇ(空腹時服用)も同じく0.79時間と速やかに吸収されます。セレコシブは頓服ではやや使いにくいので、少し残念!
ということでUpToDateを調べ、非選択的NSAIDsおよびセレコキシブ、アセトアミノフェンの医薬品情報について調べてみました。 驚くことにセレコキシブの扱いはまたもや他の非選択的NSAIDsと全く同じでした。
以下はセレコキシブに関する記載です。
CCr≧60mL/min
用量調節の必要なし
CCr>30〜<60 mL/min
投与量調整は必要ないが、可能な限り短期間で最小用量を使用する。NSAID以外の鎮痛薬または局所NSAIDの使用が好ましい。腎機能悪化リスクが高い患者、すなわち、体積減少、低血圧、高齢者、または腎毒性薬物の併用での使用を避ける(Baker 2020;KDIGO 2013;専門家の意見)となっている。
CCr≤30 mL/min
急性腎障害のリスクの増加による使用を避ける。NSAIDではなく、他の鎮痛薬(平田注:おそらくアセトアミノフェン、トラマドール、デュロキセチンなど)または局所的なNSAIDの使用が好ましい。しかし代替薬が有効でない場合には患者の選択では、リスクと利益を慎重に評価した後、セレコキシブの使用が考慮される可能性がある。腎機能を頻回にモニタリングをして可能な限り最短期間で最小有効量を使用すること。
非常に慎重を期して使用すべき薬剤と理解しました。
ではアセトアミノフェンはどうなっているかというと
軽度から重度の障害: 投与量調整の必要なし。静注アセトアミノフェンの添付文書では、高度腎障害(CCr≤30 mL /min)の患者では投与間隔を延長すること、1日用量を減じることが記載されています。アセトアミノフェン濃度は上昇し半減期は延長しますが、正常な腎機能患者とほぼ同等である(Berg 1990;フォレスト1982;Martin 1991; Prescot 1989)。グルクロニドおよび硫酸抱合体は腎障害患者で蓄積するが、臨床的効果は不明 (Martin 1991)。
ということでエビデンスを集約した米国の教科書的なUpToDateによると、腎機能低下時にはセレコキシブよりもやはりアセトアミノフェンを使えということでした。
※次回連載予定「SGLT2阻害薬による心腎保護作用と適正使用」のための
SGLT2阻害薬に関する事前クイズ(解答・解説付き) にご協力ください!
SGLT2阻害薬に関する事前クイズ
◆連載◆27日目 NSAIDsによる心不全などの心血管病変
NSAIDsによる腎障害 ~Triple whammyを防げ~
27日目 NSAIDsによる心不全などの心血管病変
米国のNSAIDsの添付文書には警告として以下のような「重篤な心血管病変」の記載があります。「NSAIDsは、心筋梗塞や脳卒中を含む重篤な心血管血栓症のリスクの増加を引き起こし、致命的な可能性がある。このリスクは、治療早期に発症する可能性があり、使用期間と共に増加する可能性がある。冠状動脈バイパス移植片(CABG)手術時には禁忌である。」
また同じく警告として「重篤な胃腸出血、潰瘍、穿穿」の記載もあります。「NSAIDは、出血、潰瘍、胃や腸の穿穿を含む重篤な胃腸有害事象のリスクの増加を引き起こし、致命的な可能性がある。これらのイベントは、使用中にいつでも発生し、予見症状を起こさずに発生する。高齢の患者および消化性潰瘍疾患および/または胃腸出血の既往歴を有する患者は、深刻な消化管出血事象のリスクが高い。」となっています。
これらの記載は非選択的NSAIDsでもCOX-2選択的阻害薬のセレコキシブでもまったく同じ扱いですが、消化器障害が少ないことがCOX-2選択的阻害薬の売り文句であることは皆さんご存知のことです。日本のNSAIDsの添付文書には消化性潰瘍のある患者や重篤な心機能不全のある患者には「禁忌」になっていますが、上記のような警告の記載はありません。COX-2選択的阻害薬のロフェコキシブ(商品名バイオックスⓇ)は胃障害が少ないなどの有害反応が少ないNSAIDということで、2003年世界売り上げランキングが19位の大型商品に成長しました。しかし心不全・脳卒中などの心血管系副作用が増加することが明らかになったため、2004年に製造中止になり、製造会社の米メルク社は約190の訴訟に対し、8000万ドルを支払ったそうです。その後のAPROVe試験でプラセボ群と比較した調整したハザード比は1.72(95%CI: 1.13-2.62)で、ロフェコキシブ群で有意に多いという結果でした1)。この報告では「rofecoxibの心血管毒性は選択的COX-2阻害薬に共通の作用(class effect)と考えられるため、その使用に当たっては治療におけるベネフィットと心血管リスクを適切に評価する必要があるだろう」と指摘されています。では同じコキシブ系のセレコキシブは心不全を悪化させるのでしょうか?実際に危なくないのでしょうか?セレコキシブにはどのような報告があるのでしょうか? 探っていきましょう。
2,035人を対象にしてセレコキシブの使用は心血管疾患、心筋梗塞、脳卒中、心不全による複合死亡のエンドポイントが用量増加と関連があることが報告されました2)。しかしその後、セレコキシブの心血管安全性を検証するために10倍以上の24,081人の患者を対象にしたRCTのPRECISION試験が行われ、セレコキシブの心血管リスクは対照薬のナプロキセン、イブプロフェンと比較し有意に少ないことが明らかになりました3)。
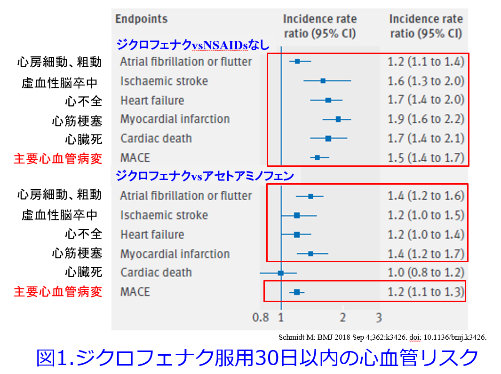
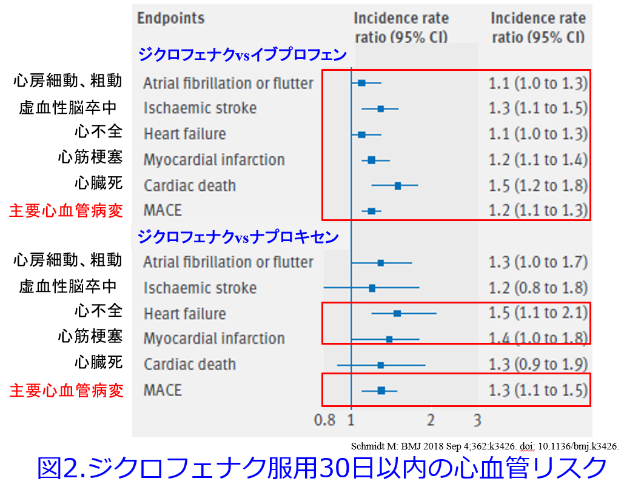
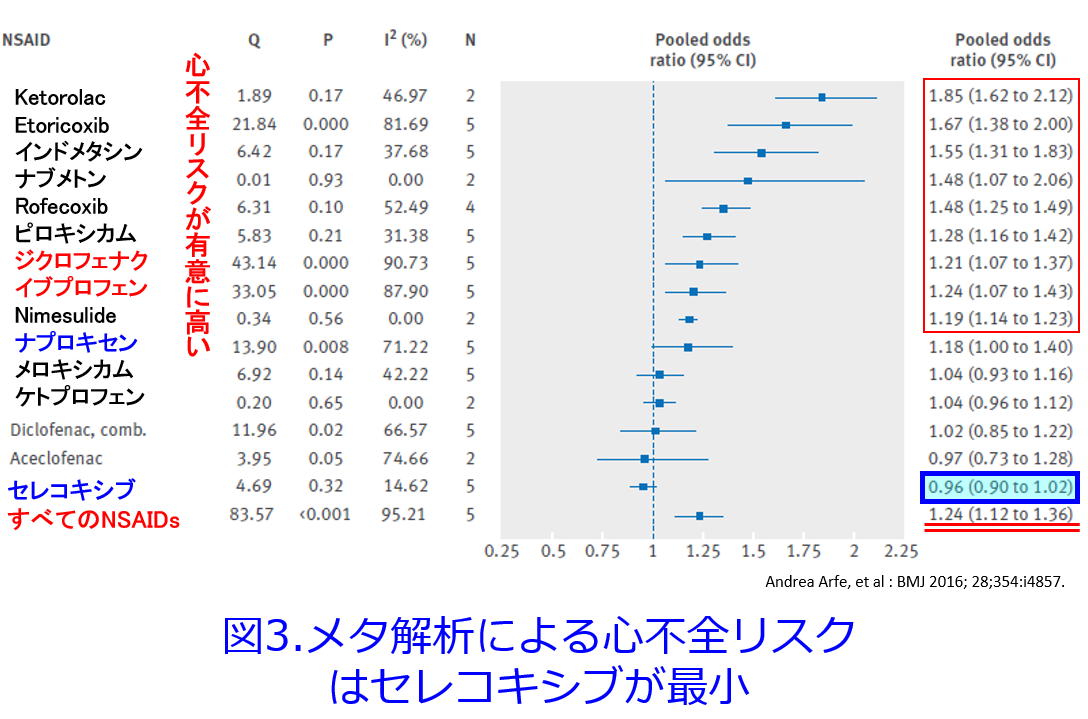
まずジクロフェナクはNSAIDs非投与群に比しすべての主要心血管病変の発症率が有意に高く、アセトアミノフェンに比し、主要心血管病変の発症率が有意に高いこと(図1)4)、ジクロフェナクはイブプロフェン、ナプロキセンに比し主要病変の発症率が有意に高いことも報告されています(図2)4)。そして9万人以上のNSAIDsによる入院患者と800万人以上を対照にしたケースコントロールスタディでは7つの非選択的NSAIDs(ジクロフェナク、イブプロフェン、インドメタシン、ketorolac、ナプロキセン、nimesulide、ピロキシカム)と2つのCOX2選択的阻害剤(etoricoxibとロフェコキシブ)に対する心不全の危険性が非服用者に比し増加しました。ジクロフェナク、etoricoxib、インドメタシン、ピロキシカム、ロフェコキシブの心不全の危険性は2倍に増加しましたが、セレコキシブが一般的な服用量で心不全のリスクを高めたというeエビデンスは認められませんでした(図3)5)。平田が思うに、図3だけでなく、多くの論文に目を通して感じたのは、NSAIDsの心毒性はロフェコキシブ>ジクロフェナク>イブプロフェン>ナプロキセン>セレコキシブの順に心不全を悪化させやすいと理解しています。図1を見るとアセトアミノフェンも心に全く影響がないわけではないことが分かり、腎にも心にも優しいセレコキシブがますます魅力的に感じられてきました。
引用文献
1)Baron JA, etal: Lancet 372: 1756-1764, 2008
2)Solomon SD, et al: New Engl J Med 352: 1071-1080, 2005
3)Solomon DH, et al: Am J Med 130: 1415-1422, 2017
4)Schmidt M: BMJ 2018 Sep 4;362:k3426. doi: 10.1136/bmj.k3426.
5)Andrea Arfe, et al : BMJ 2016; 28;354:i4857.
第8回 薬剤師塾 開催案内
第8回 基礎から学ぶ薬剤師塾 12月7日(火)18時~20時まで の申し込みを始めます。テーマは新ネタで「初めての学会発表から、博士号取得までの道」です。
学会発表、一度もやったことないけど経験してみたい、論文を書いたことないけど書いてみたい、海外留学だって公費で行かせてもらえるなら行ってみたい、博士号がとれるものなら取ってみたい。
薬学部の乱立によってコモディティ化した薬剤師が低賃金で使い捨てになる時代はもうすぐやって来ます。何もしなければ、そのまま。何も変わりません。だけど一歩踏み出すことによって人間は誰でも変われるチャンスを持っています。今一度薬剤師をやり直してみませんか?レベルの高い薬剤師を目指してみませんか?
平田はずっとこのテーマで話してみたいと思っておりました。まずは学会発表からです。
参加を希望される方は 申し込みフォーム に記入のうえ、送信してください。
薬剤師塾への参加者はどなたでも構いませんが、ぜひ学会発表を目指している方に参加していただきたいと思います。そしてその先には原著論文を書き、海外の学会で発表し、英語論文をまとめて博士号を取るんだというような大きな夢を持つ人になっていただきたいと思います。300名まで参加可能ですが、最近の登録者数は200名を超えていますので、早めに登録してください。

