わかりやすい細菌と抗菌薬の話
★わかりやすい細菌と抗菌薬の話 ダウンロード
『わかりやすい細菌と抗菌薬の話』のテキスト(PDF)ダウンロードができます。
わかりやすい細菌と抗菌薬の話 目次
『わかりやすい細菌と抗菌薬の話』の目次です。
第5回:抗菌薬のPK/PD理論~抗菌薬を有効かつ安全に使うために~
第6回:高齢者の腎機能を正確に評価して抗菌薬・抗ウイルス薬を投与する
第7回:抗菌薬が効かない多剤耐性菌MRSAが出現した~抗菌薬の耐性化~
第9回:前編 クロストリディオイデス・ディフィシル(CD)腸炎について考える
第9回:後編 クロストリディオイデス・ディフィシル(CD)腸炎について考える
第10回:薬物代謝に関わる腸内細菌~アレルギー疾患が急増した理由~
第11回:腸腎連関gut-kidney axis
~腎機能を悪化させる尿毒素Ureic toxinの蓄積には腸内細菌が関わっている~
第12回:前編 共生生物としての腸内細菌の役割~腸内細菌叢とTregの話~
第12回:後編 共生生物としての腸内細菌の役割~腸内細菌叢とTregの話~
◆連載◆共生生物としての腸内細菌の役割 ~腸内細菌叢とTregの話~ 第12回 前編
筆者は透析患者の便秘に関する研究1)2)3)やプレバイオティクスとしての作用を持つ下剤のラクツロースが腎不全モデルマウスで腎保護作用を示したという研究4)を介して腸内細菌叢microbiotaに興味を持った。今回は腸内細菌叢と腸管免疫について書きたいが、近年の免疫学の進歩は著しく、私の専門外なので、中には間違った記載や古い学説があるかもしれないことをご容赦していただきたい。
最近、腸内細菌叢の研究が盛んになりつつある。その1つの要因は20世紀までの光岡知足先生の開発した便培養法によって細菌叢の全体像が把握できるようになったことがきっかけだと思うが、日本・中国以外ではこれらの手間暇のかかる研究は発展しなかった。それが21世紀には次世代シークエンサーによる腸内細菌叢の網羅的な解析法が確立し、簡便かつ迅速に解析できるようになったことによって腸内細菌叢に関する論文数が飛躍的に増えた。それとともに単に栄養や水分吸収の場と考えられてきた腸管が、最大の免疫器官でもあることが明らかになり、腸内細菌叢が腸管の免疫応答と密接に関係していることが判明した。依然として炎症性腸疾患や過敏性腸症候群などの消化器疾患に関する論文が多いが、アレルギー疾患、糖尿病・肥満などの生活習慣病、さまざまな精神疾患に関したものが増えつつあり、腎疾患に関する論文も急増しており、腸内細菌叢とさまざまな疾患が関連していることが明らかになりつつある。
腸管を含めた消化管は外界と接触する「ちくわのような管」である(図1)。人間は1本のチューブのようなものだから消化管には外界から容易に病原体やウイルスが入り込むので、消化管はまず初めに胃酸の分泌によって外界微生物の侵入を防ぎ、それでも入ってきた微生物や異物に対して、腸管は門番として免疫機能を腸に集中*させたのだと考えるとわかりやすい。医師に掛かることなくアレルギー性疾患が消失した2つのエピソードを紹介しよう。

免疫機能を腸に集中*
腸は外界から細菌や異物が入りやすい器官であるため、何が有害で何が無害であるかを見極める重要な役割、すなわち免疫システムが必須となる。ヒトの免疫細胞の70%は腸で作られており、まさに腸は最大の免疫器官である。小腸は絨毛でおおわれているがその隙間にパッチワークのような形で点在するパイエル板(Peyer’s patch)がある(図2)。 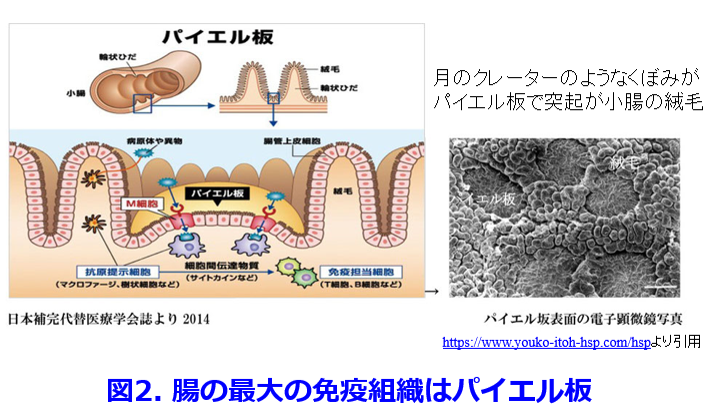 パイエル板の下には小さなリンパ節(リンパ小節)が集合しておりその表面にあるM細胞(microfold cell)が腸管内腔側からエンドサイトーシスによって細菌などの抗原を取り込んで、免疫細胞たちに情報を与える。情報を得た免疫細胞は腸管の守りを固めるだけでなく、血液に乗って全身にも運ばれて病原菌やウイルスなど敵を見つけると攻撃する「戦士」になる。抗原情報が提示されたリンパ球やマクロファージなどの免疫細胞が病原微生物や抗原となる異物を排除するとともに、外界から入ってくる異物に過剰に反応して免疫反応が暴走してアレルギーを起こさないような免疫寛容が誘導される。つまり外界から病原菌やウイルスの侵入を防ぐために病原菌を排除したり、制御性T細胞(regulatory T cell: Treg)によって免疫系の暴走を防いで過剰な防衛反応を起こさないように調節するなどのとても重要な働きをしており腸管免疫と呼ぶ。
パイエル板の下には小さなリンパ節(リンパ小節)が集合しておりその表面にあるM細胞(microfold cell)が腸管内腔側からエンドサイトーシスによって細菌などの抗原を取り込んで、免疫細胞たちに情報を与える。情報を得た免疫細胞は腸管の守りを固めるだけでなく、血液に乗って全身にも運ばれて病原菌やウイルスなど敵を見つけると攻撃する「戦士」になる。抗原情報が提示されたリンパ球やマクロファージなどの免疫細胞が病原微生物や抗原となる異物を排除するとともに、外界から入ってくる異物に過剰に反応して免疫反応が暴走してアレルギーを起こさないような免疫寛容が誘導される。つまり外界から病原菌やウイルスの侵入を防ぐために病原菌を排除したり、制御性T細胞(regulatory T cell: Treg)によって免疫系の暴走を防いで過剰な防衛反応を起こさないように調節するなどのとても重要な働きをしており腸管免疫と呼ぶ。
引用文献
1) 西原 舞, 他: 透析会誌37: 1887-1892, 2004.
2) 平田純生, 他: 透析会誌37: 1967-1973, 2004.
3) 西原舞, 他: 析会誌38: 1279-1283, 2005.
4) Sueyoshi M, et al: Clin Exp Nephrol 23: 908-919, 2019
◆連載◆共生生物としての腸内細菌の役割 ~腸内細菌叢とTregの話~ 第12回 後編
以前の連載で「吸収率の低い第3世代経口セフェムってこんなに必要?」の時に現在、アレルギーや自己免疫疾患、様々な精神疾患などが急増しているのは腸内細菌叢の変化によるのではないかと書いた。しかしそれだけなら野菜や発酵食品をたっぷりと摂れば、あるいはプロバイオティクスとなる整腸剤を毎日摂取すれば済む話であるが、そんな簡単な話ではなさそうだ。これらの現代病が増えた理由について考察してみたい。
① 抗菌薬が多用された、人だけでなく家畜にまでも
抗生物質ができたことによって日本人の死因第1位、2位であった結核、肺炎は激減し、平均寿命は飛躍的に向上した。非常に多くの人々の命を救ってくれた抗生物質が、家畜や養殖する魚介類にも使われ、そのおかげで不衛生な飼育環境ですし詰め状態で飼育しても死ななくなるし(図3)、驚くことに抗生物質を使うと成長効果があり、太ってくれるので(ということはヒトに乱用すると腸内細菌叢が変化して肥満やⅡ型糖尿病の原因になると言われている5))、餌に混ぜてどんどん使われた。その乱用のために耐性が生じ、ヒトにも効かなくなった。多剤耐性緑膿菌に切り札として復活したコリスチンも家畜に使われたため、様々な菌が耐性化して家畜には使用禁止になったのはその一例だ。抗生物質の家畜への使用によって人口がどんどん増加しても飢えることがなくなったのはよいことだが、人口よりも多い家畜の増加は中南米の放牧地の増加につながり、アマゾンの熱帯雨林が破壊された第一の原因だといわれている。
そして現在、日本では多くの抗菌薬が効くはずのない風邪などで安易に処方されている。その中でバイオアベイラビリティの低い第3世代セフェム系抗菌薬は吸収率が低い分、腸内細菌叢に対する影響も強いはずだ。プロバイオティクスは生物に対して共生的であり、そしてプレバイオティクスはプロバイオティクスの増殖を促してくれるが、抗生物質は「抗・生物質」と、読んで字のごとく生物に攻撃的だ(図4)。腸内細菌に対して攻撃的ということを腸内細菌と共生生活をしているヒトにとっても攻撃的だといえる。そして抗菌薬を使用した覚えのない人であっても家畜などに使われる抗菌薬を介して知らないうちに摂取しているかもしれないのだ。

② 食事の欧米化によって腸内細菌叢が変化した
食物繊維は消化されないため残渣となって大腸に達し、腸内細菌のエサになる。それによって腸内細菌は短鎖脂肪酸である酢酸・乳酸・酪酸などを産生して腸内を酸性にする。腸内が酸性になるとBifidobacteriumなどのいわゆる善玉菌の増殖を促進し、酢酸には強い殺菌作用があるため悪玉菌の増殖を抑え、コレステロール蓄積抑制、がん予防効果も示す。食物繊維を多く摂ると地中海食を摂っている人やベジタリアンに多いPrevotella属の腸内細菌が増えて、ダイエット効果がある。おまけに腸内細菌はビタミンB群(B1, B2, B6, B12)、ビタミンK、葉酸などのビタミンも合成してくれる。ヒトの細胞は37兆個(2013年に発表されたEva Bianconiらの論文以前は60兆個と言われていた)しかないが、腸内細菌は100~1000兆個あって、ヒトの細胞と共生しているのだ。
腸内細菌の中である種のクロストリジウム属が産生する酪酸が減少すると、小腸にあるパイエル板に潜むT細胞がTregに変わることができなくなるため、いわゆる免疫暴走が起こってしまうことが明らかにされている。免疫暴走によって潰瘍性大腸炎やクローン病などの自己免疫疾患を起こすと、共生生物である腸内細菌に害が及ぶが、そうならないようにTregが保護しているのだ6)。小腸にあるパイエル板と大腸の入り口にある盲腸・虫垂が腸管免疫に関して非常に重要な役割を担っていることも解明されつつある。このように免疫システムはヒトが疾患に罹るのを守ってくれているだけでなく、腸内細菌との重要な共生関係を維持している。
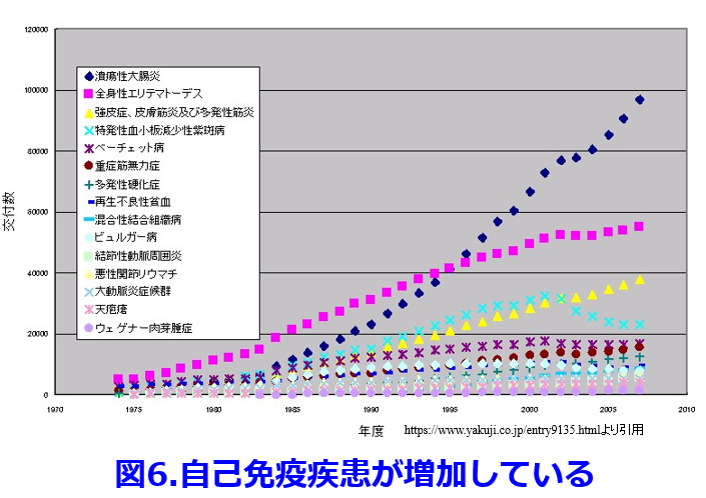
食事の欧米化によってファストフードの消費が増え、味噌・醤油・納豆などの発酵食品を摂らなくなると腸内細菌の種が蒔かれないし、そのエサである食物繊維が腸に入ってこないため、多様だった腸内細菌叢が質的にも量的にも著明に変化する。毎年平均寿命のトップを争っていた長寿王国だった沖縄の男性の平均寿命の順位が2000年以降になって下降し続けているのは、米軍基地の多い影響を受けて食事がいち早く欧米化したのが原因だといわれている(図5)。 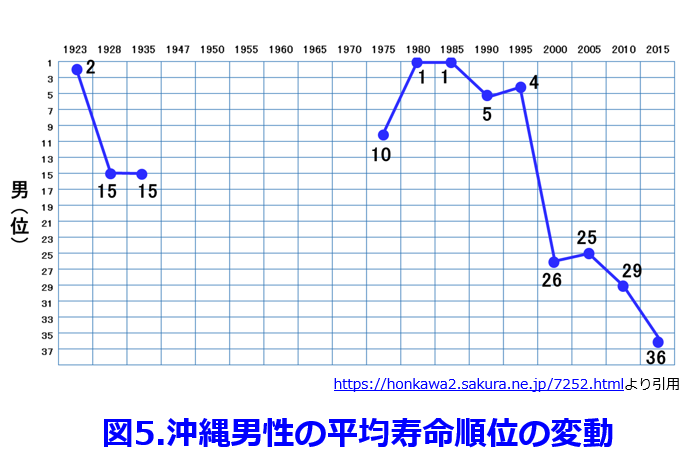 自分自身の正常細胞に対して免疫細胞が過剰に反応した結果起こる自己免疫疾患である1型糖尿病有病率は日本では0.1%で、年間2名/10万人の発症率だったのが、欧米ではもともと5倍以上の発症率であったが世界的に増加傾向にあり、現在の米国は年間10万人当たり約30名に急増し、わが国の自己免疫疾患も急増している (図6)。腸は免疫反応を抑制する働きがあるが、プロバイオティクスの投与によって有意に1型糖尿病の発症を抑制できることが動物実験で解明されている7)。さらに腸内細菌叢が産生する酪酸が自己抗体産生を抑制して最終的に関節リウマチの症状を改善することも明らかにされている8)。
自分自身の正常細胞に対して免疫細胞が過剰に反応した結果起こる自己免疫疾患である1型糖尿病有病率は日本では0.1%で、年間2名/10万人の発症率だったのが、欧米ではもともと5倍以上の発症率であったが世界的に増加傾向にあり、現在の米国は年間10万人当たり約30名に急増し、わが国の自己免疫疾患も急増している (図6)。腸は免疫反応を抑制する働きがあるが、プロバイオティクスの投与によって有意に1型糖尿病の発症を抑制できることが動物実験で解明されている7)。さらに腸内細菌叢が産生する酪酸が自己抗体産生を抑制して最終的に関節リウマチの症状を改善することも明らかにされている8)。
③ 衛生仮説(過度に衛生環境が整った)
戦後のわが国は、下水道など衛生環境が整っておらず、田畑や大自然、山と川、土壌が我々の住む環境に密接に関与していた。団塊の世代など子供の数も現在と比べて非常に多く兄弟も多かったため、多種多様な雑菌が自然に体内に入ってきていた。この環境下で腸内の免疫細胞は有害な細菌と有益な共生微生物を見分け、有害細菌に対しては鋭く攻撃するため大活躍していたのである。きちんと見分けのできる免疫細胞だったから、花粉やハウスダストなどに過剰反応してアレルギー症状や自己免疫疾患を起こすことはほとんどなかったのだ。
ところが1970~80年代になると下水道が完備し、日本の誇るウォシュレットが多くの家庭に備わって衛生環境が極めてよくなった。これらは感染症の減少につながる素晴らしいことではあるが、それと同時に都心部ではコンクリートだらけで、細菌が生息できる土壌もなくなってきた。つまり免疫細胞が菌の情報を正しくインプットできなくなった。正確に菌を見分けることのできなくなった免疫細胞は、花粉やハウスダストにまで過剰反応してアレルギー症状を起こし、ほとんどいなかった自己免疫疾患が急増した。昨日、お示しした2つのエピソードの西表島での体験、修行僧の例と同じように、農村部の自給自足生活者や兄弟が多いと(共同生活も同じ)、アレルギーは少なくなるといわれている。最近の日本は「便座シートがないと・・」という方や抗菌グッズを好んで使っている方が増えてきたのではないだろうか。衛生仮説を最初に提唱した英国のStrachan博士によると、小児の花粉症の発症は生まれ育った家族の規模や兄弟の人数と強い相関があることを示している。また小規模農家で育った子もアレルギーを起こしにくい。
④ 寄生虫がいなくなった~寄生虫は実は共生虫だった?~
アトピー性皮膚炎、気管支喘息、花粉症などのIgE抗体が関与する1型アレルギー疾患が1960年代以降、増えている(図7)。日本人は江戸時代以降、50%以上の人が回虫などの寄生虫に感染していており、私が生まれた1954年でも田畑の肥料として下肥が使われていたので、30%近くの人に寄生虫が寄生しており、年に1回は寄生虫検査をやらされたものだ。寄生虫がヒトに感染すると細菌やウイルス感染と異なり寄生虫特異的なIgE抗体だけでなく、非特異的なIgE抗体を産生する。これによって高親和性IgE受容体を覆いつくすため、スギ花粉などのアレルゲンが付着できなくなってアレルギーが抑えられていたといわれている9)。T細胞から変化したヘルパーT細胞のうち、Th1は病原菌を退治する細胞性免疫を促進する司令官であったが感染症の減少によってTh-1の活性化が起こらず、Th2はもともと寄生虫などの異物を退治する司令官だったが、寄生虫がいなくなった現在ではIgEを産生して好酸球主体のアレルギーを起こす司令官になってしまった。回虫や蟯虫などは実は寄生虫はでもあったがアレルギーを防いでいたことを考慮すれば共生虫でもあったのかもしれない。 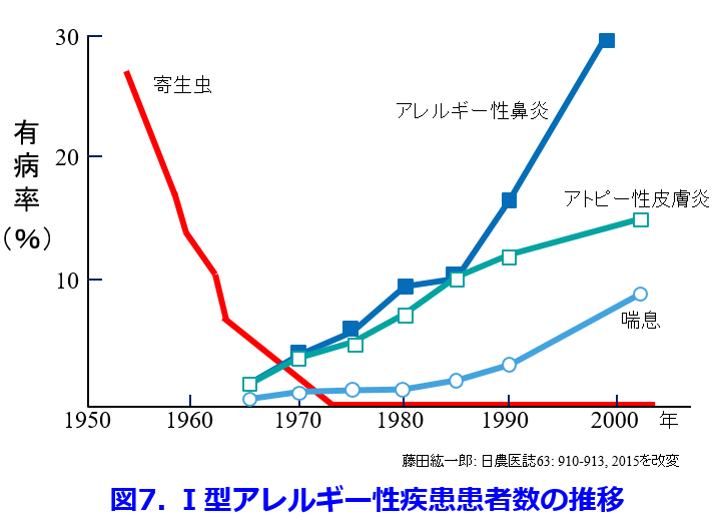 これらのほかにも大気汚染、自動車の排ガス(特にディーゼルエンジン)、水質汚染、中国から飛来するPM2.5や食品添加物などの化学物質の増加など、挙げるときりないが、①~④のような腸内細菌叢の変化、過度の衛生環境、寄生虫の消失などによって腸管に外敵が入ってこなくなると、これによって免疫システムが過剰に反応することが近年、急増している様々な疾患の原因になっている。健全な腸内細菌叢の存在によって、がん細胞が免疫逃避に使っているTregの働きで、全身の各所で過剰に活性化し暴走している免疫細胞がなだめられ、アレルギーや自己免疫疾患が抑えられていることがわかってきた。
これらのほかにも大気汚染、自動車の排ガス(特にディーゼルエンジン)、水質汚染、中国から飛来するPM2.5や食品添加物などの化学物質の増加など、挙げるときりないが、①~④のような腸内細菌叢の変化、過度の衛生環境、寄生虫の消失などによって腸管に外敵が入ってこなくなると、これによって免疫システムが過剰に反応することが近年、急増している様々な疾患の原因になっている。健全な腸内細菌叢の存在によって、がん細胞が免疫逃避に使っているTregの働きで、全身の各所で過剰に活性化し暴走している免疫細胞がなだめられ、アレルギーや自己免疫疾患が抑えられていることがわかってきた。
1960年代以来、かつて存在が受け入れられていたサプレッサーT細胞という概念は提唱されてから30年たって消失し、現在は免疫の暴走を制御している主役は大阪大学・坂口志文先生が発見した制御性T細胞、略してTregであり、人体に共生している腸内細菌とともに感染防御、アレルギー疾患、自己免疫疾患、慢性炎症、腫瘍免疫、移植免疫などをコントロールしていると考えられている。
まとめ
結腸は水分を吸収して食べかすを固形にするだけの臓器ではない。免疫系の主戦場は腸なのだ。特に回腸の最後(特にパイエル板)と盲腸・虫垂に集中している。結腸細胞のエネルギー源は腸内細菌叢の廃棄物である酢酸、乳酸や酪酸などの短鎖脂肪酸なので、結腸は腸内微生物がいないと正常に働かなくなる。腸は細菌や食物などに対して免疫反応が起こりやすい環境にある。Tregが人体に共生している腸内細菌とともに感染防御、アレルギー疾患、自己免疫疾患、慢性炎症、腫瘍免疫、移植免疫などをコントロールしていると考えられている。プレバイオティクスやプロバイオティクスは健康維持に良いことは断片的にわかりつつある。ただしこれらの摂取によって腸管免疫の破綻を介して発症する諸疾患を治癒できるという明確な理論は確立していない。ただしこれらの知見がさまざまな新薬の発見の種になることは確かだろう。
引用文献
5) Ahmad A, et al: PLoS One2019 Dec 31;14(12):e0226372. doi:10.1371/journal.pone.0226372. eCollection 2019.
6) ダニエル・M・デイビス:美しき免疫の力 人体の動的ネットワークを解き明かす. NHK出版, 2018
7)Kim TK, et al: Front Immunol. 2020 Sep 3;11:1832.doi: 10.3389/fimmu.2020.01832. eCollection 2020.
8)Takahashi D, et al: EBioMedicin. 2020 Aug;58:102913.doi: 10.1016/j.ebiom.2020.102913. Epub 2020 Jul 22.
9)藤田紘一郎: 日農医誌63: 910-913, 2015
今回の連載は抗菌薬シリーズの中に入れていますが、厳密にいうと今回は抗菌薬は出てきません。腸内細菌叢micobiotaと尿毒素uremic toxinの話、つまり「腸腎連関」の話です。ただし抗菌薬を投与すれば、腸内細菌叢は大きく変化するはずですから「抗菌薬」シリーズの中に入れさせていただきます。
1.透析患者の便秘と腸管穿孔
筆者らは以前に透析患者は便秘になりやすいことについて報告した。便秘の定義にRomeⅡによる機能性便秘の定義を用い(表1)、多重ロジスティック解析によると原疾患では糖尿病、女性が便秘に有意に影響し(表2)、 
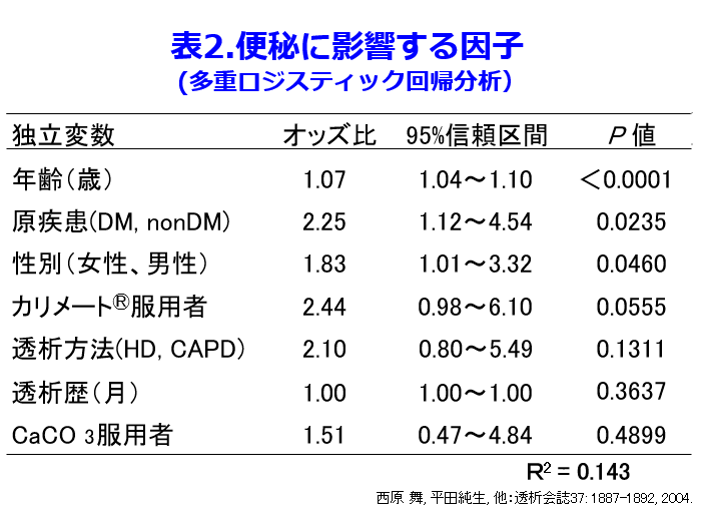 着目すべきは加齢で、50歳未満では18%の便秘発症率が80歳代になると88%と約5倍に上昇し、透析患者は、そもそも非透析患者の5倍以上、便秘しやすいことが分かった(図1)1)。
着目すべきは加齢で、50歳未満では18%の便秘発症率が80歳代になると88%と約5倍に上昇し、透析患者は、そもそも非透析患者の5倍以上、便秘しやすいことが分かった(図1)1)。 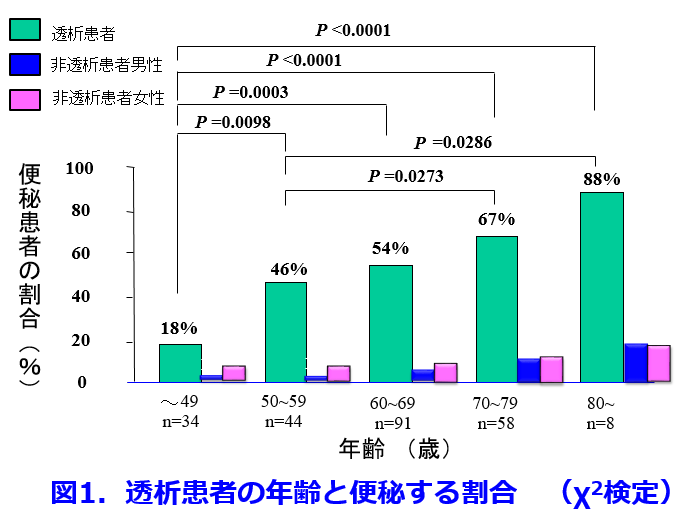 さらに虚血性腸炎を発症し開腹手術を受けた透析患者15名を対象に、虚血性腸炎疑い症例を除いた692名の透析患者と比較することによって虚血性腸炎発症因子として①陽イオン交換樹脂(Ca型血清カリウム降下薬)服用者、②昇圧薬服用者、③ヘマトクリット値の異常高値者、④水分管理不良者があることを明らかにした2)。これによって透析患者の腸管穿孔は表3に示されるようにカリウム制限による食物繊維摂取不足、カリメート?散のような便秘しやすい薬剤の投与、加齢・不動に伴う蠕動力・排便力低下によっておこる常習便秘が結腸の通過障害を起こし、血液透析時に起こる腸管虚血、腸間膜動脈の虚血、透析による除水が伴って結腸穿孔が起こることを想定している(図2)。
さらに虚血性腸炎を発症し開腹手術を受けた透析患者15名を対象に、虚血性腸炎疑い症例を除いた692名の透析患者と比較することによって虚血性腸炎発症因子として①陽イオン交換樹脂(Ca型血清カリウム降下薬)服用者、②昇圧薬服用者、③ヘマトクリット値の異常高値者、④水分管理不良者があることを明らかにした2)。これによって透析患者の腸管穿孔は表3に示されるようにカリウム制限による食物繊維摂取不足、カリメート?散のような便秘しやすい薬剤の投与、加齢・不動に伴う蠕動力・排便力低下によっておこる常習便秘が結腸の通過障害を起こし、血液透析時に起こる腸管虚血、腸間膜動脈の虚血、透析による除水が伴って結腸穿孔が起こることを想定している(図2)。 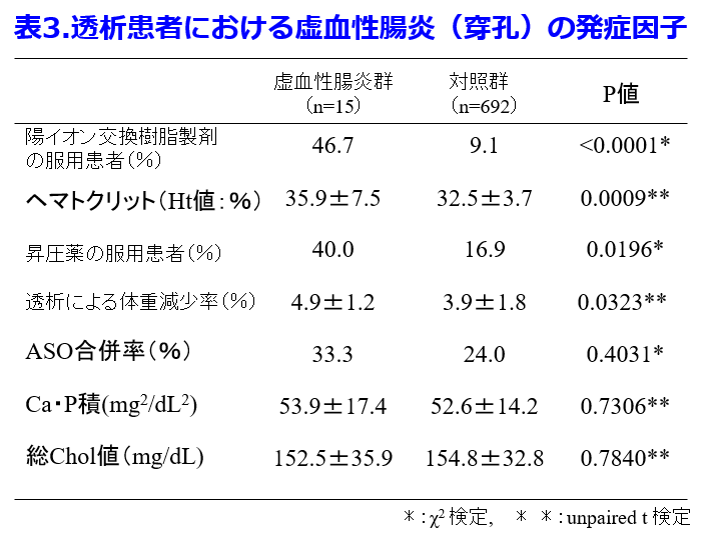
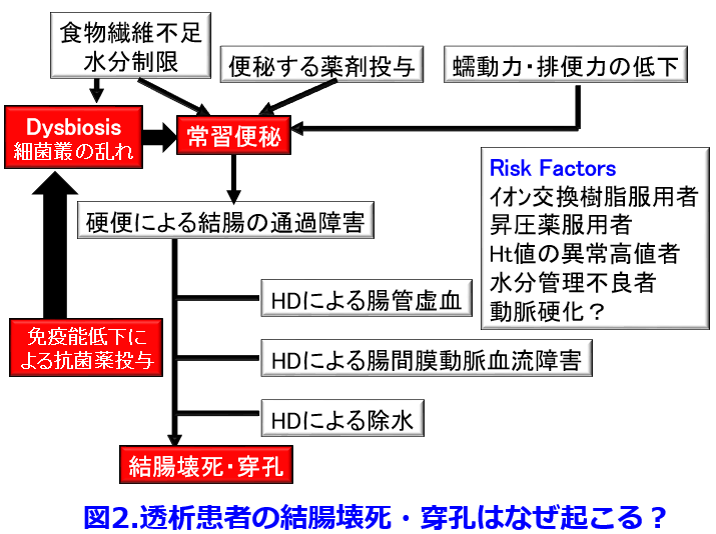 そして免疫能の低下した透析患者では抗菌薬が投与されやすいこと(最近はバイオアベイラビリティの低い第3世代経口セフェムが多用されている)、プレバイオティクスとして働く食物繊維摂取不足による腸内細菌叢の乱れが常習便秘をさらに悪化させているのではないかと考えている。
そして免疫能の低下した透析患者では抗菌薬が投与されやすいこと(最近はバイオアベイラビリティの低い第3世代経口セフェムが多用されている)、プレバイオティクスとして働く食物繊維摂取不足による腸内細菌叢の乱れが常習便秘をさらに悪化させているのではないかと考えている。
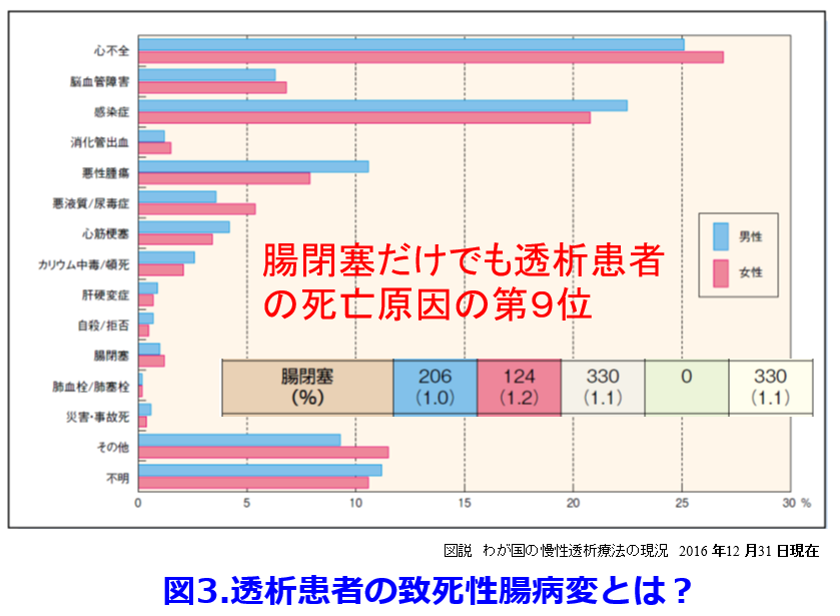
たかが便秘ではないかと考える方が多いが、2016年の日本透析医学会の統計調査によると男性206人(1.0%)、女性124人(1.2%)が腸閉塞で死亡しており、これは透析患者の死亡原因の第9位にランクされるが(図3)3)、透析患者の死亡原因病名リストには「腸閉塞」しかない。しかし透析患者の致死性腸病変は腸閉塞だけでなく、虚血性腸炎、腸管穿孔、腸管壊死など様々である。これらの病変に続発する腹膜炎や敗血症が感染症に分類されたとしたら、1年間に少なくとも330人が致死性腸疾患によって死亡していると考えてよいだろう。したがって透析患者の常習便秘は非常に深刻だ。
2.透析患者の便秘と尿毒素
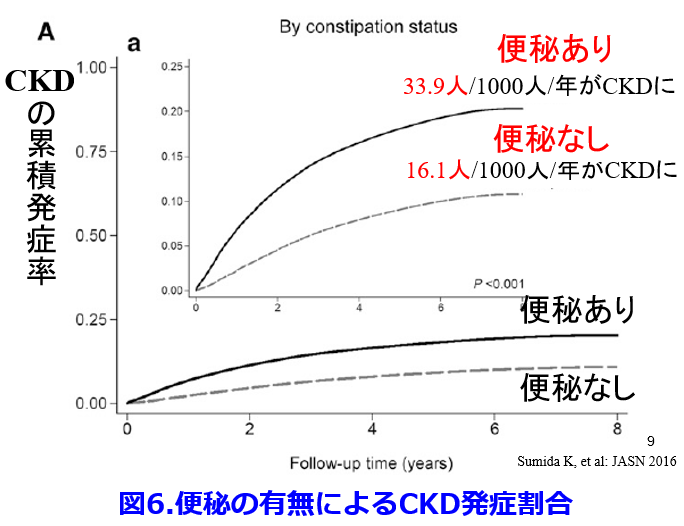
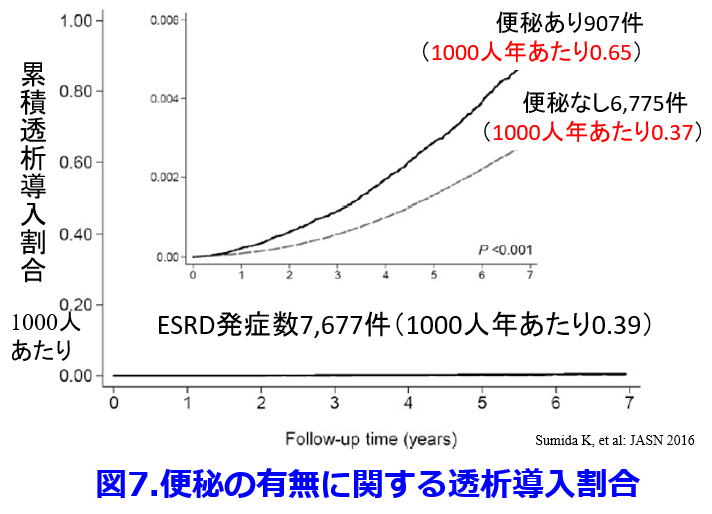
最近になって便秘の重症度が高いほど心血管イベント発症率が高く、これには腸内細菌叢の変化による慢性炎症が関わっている(図4)4)。 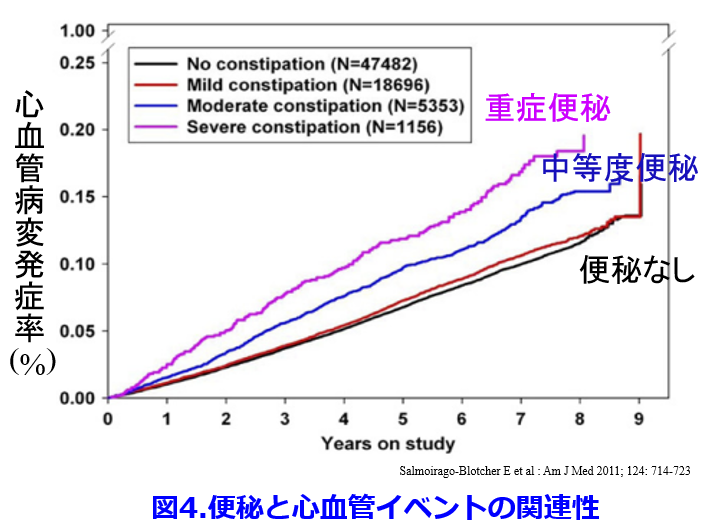 便秘患者は非便秘患者に比し心血管病発症リスク・全死亡リスクともに高い(図5)5)、便秘患者は非便秘患者に比し有意にCKDになりやすく(図6)6)、有意に透析導入率が高い(図7)6)などが次々と明らかになってきた。実は便秘に伴う腸内細菌叢の変化が腎機能を悪化させる尿毒素に関わっているということが明らかにされつつある。
便秘患者は非便秘患者に比し心血管病発症リスク・全死亡リスクともに高い(図5)5)、便秘患者は非便秘患者に比し有意にCKDになりやすく(図6)6)、有意に透析導入率が高い(図7)6)などが次々と明らかになってきた。実は便秘に伴う腸内細菌叢の変化が腎機能を悪化させる尿毒素に関わっているということが明らかにされつつある。 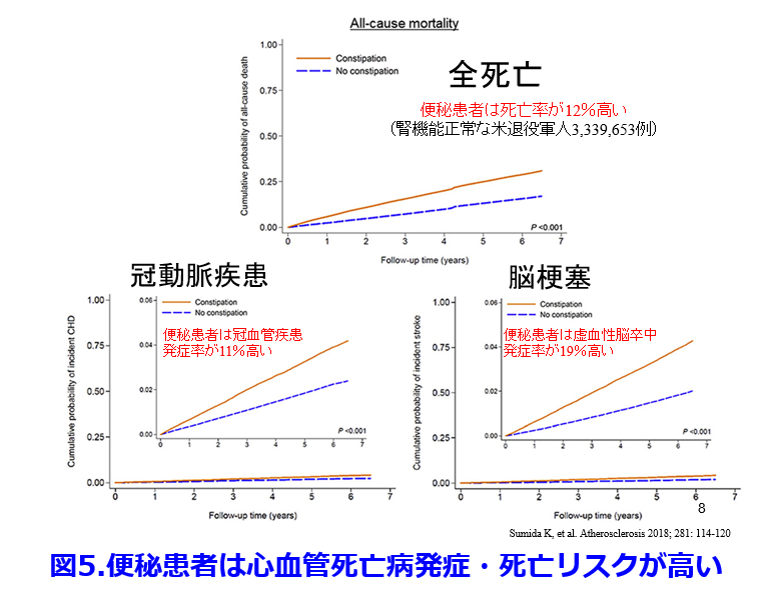
インドキシル硫酸はアンジオテンシノーゲンの発現上昇により糸球体硬化、尿細管間質線維化により腎機能悪化の原因となり、活性酸素種(ROS)を誘導して酸化ストレス亢進、血管平滑筋増殖の原因になり、NO産生低下により心筋線維化、動脈硬化促進、血管石灰化を促進し、さらにKlotho発現低下によって老化を促進させるなど腎・心への悪影響が非常に強い尿毒素である(図8)7)。 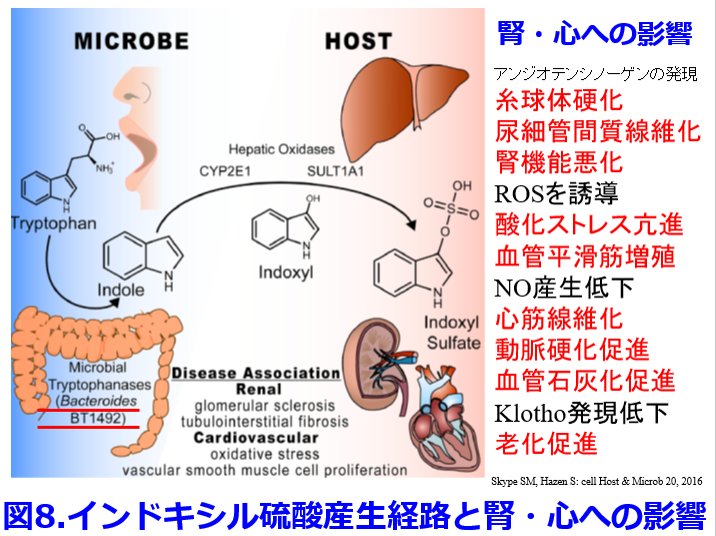 インドキシル硫酸は食事成分由来のアミノ酸のトリプトファンがかつては大腸菌によってインドールを産生するといわれていたが8)、現在では大腸菌だけではなくBacteroides、Clostridium属などが持つtriptophanaseという酵素によってインドールとなって腸管で吸収され、肝臓でインドキシル硫酸になるとされている9)。その前駆物質であるインドールを吸着して糞便中に排泄させることによって、インドキシル硫酸の産生を抑えて腎機能の悪化を防ぐのがクレメジンⓇ(AST120)である。血中インドキシル硫酸濃度が高いほど生存率が低下するという報告は前述のように当然のごとく存在する(図9)8)。
インドキシル硫酸は食事成分由来のアミノ酸のトリプトファンがかつては大腸菌によってインドールを産生するといわれていたが8)、現在では大腸菌だけではなくBacteroides、Clostridium属などが持つtriptophanaseという酵素によってインドールとなって腸管で吸収され、肝臓でインドキシル硫酸になるとされている9)。その前駆物質であるインドールを吸着して糞便中に排泄させることによって、インドキシル硫酸の産生を抑えて腎機能の悪化を防ぐのがクレメジンⓇ(AST120)である。血中インドキシル硫酸濃度が高いほど生存率が低下するという報告は前述のように当然のごとく存在する(図9)8)。 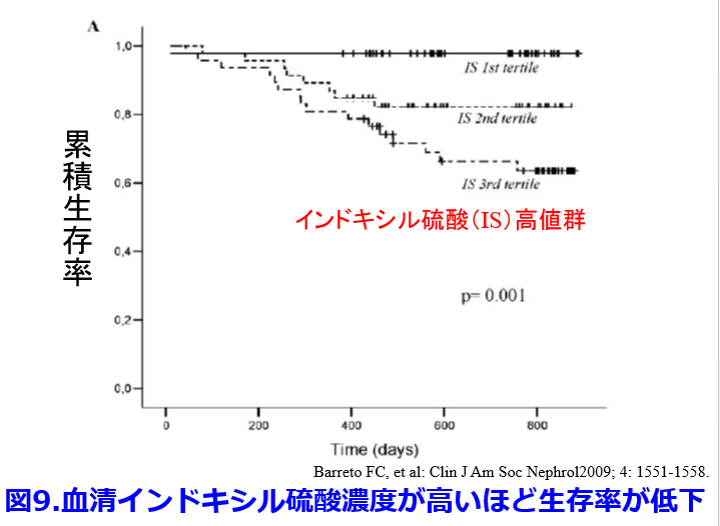
パラクレジル硫酸はチロシンが腸内細菌の持つTyrosine phenol lyaseによってp -クレゾールやフェノールになり、消化管吸収されて肝臓でp -クレジル硫酸, フェニル硫酸になる。血中p -クレジル硫酸濃度が高いほど生存率が低下するという報告もある(図10)10)。 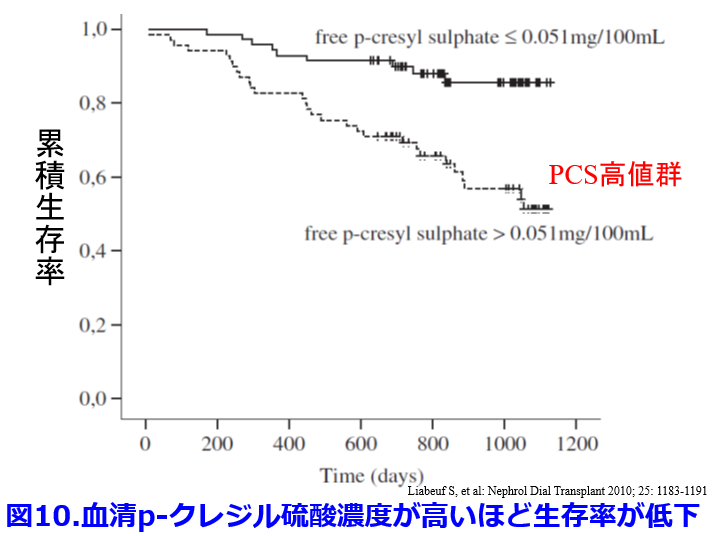
糖尿病性腎臓病の原因物質でアテローム性動脈硬化などの心血管病の原因物質トリメチルアミン-N-オキサイド(TMAO)11)はカルニチンやホスファチジルコリン(レシチン)を基質としてclostridium属の持つCarnitine TMA lyaseおよびCholine TMA lyaseよって産生される。血中TMAO値が高いほどアテローム性動脈硬化のリスクとなって心筋梗塞・脳卒中・死亡などの心血管死と関連するという報告も当然のごとく存在する(図11)12)。以上のことからインドキシル硫酸、P-クレジル硫酸、フェニル硫酸、TMAOといった名だたる尿毒素の産生にはすべて腸内細菌が絡んでいる(図12)。 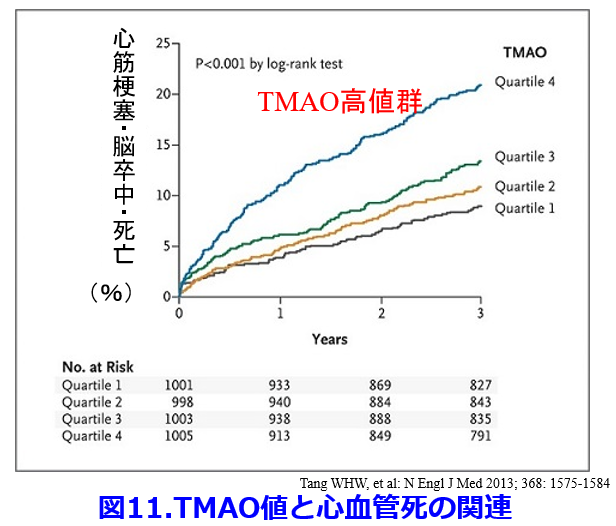
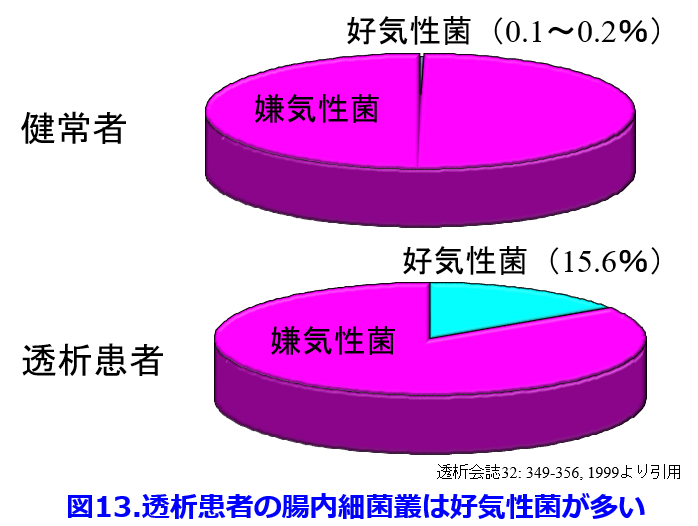
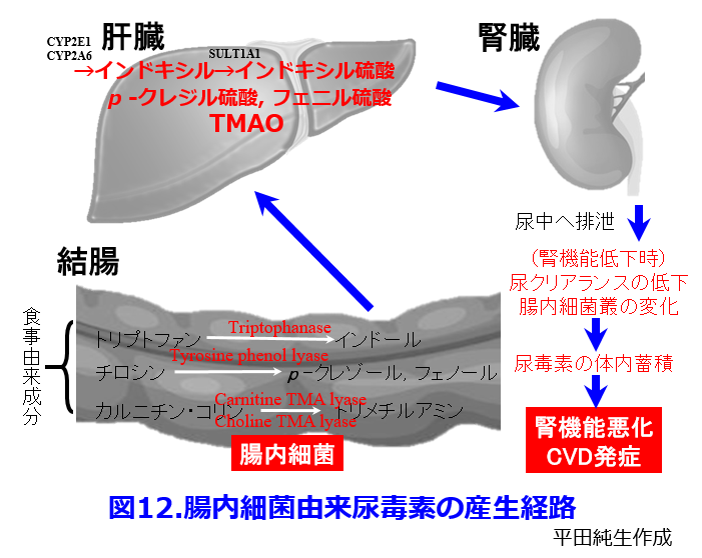 さらに健常者の腸内細菌叢は嫌気性菌が99%以上を占めるのに対し、光岡知足先生の便培養技術によって透析患者の腸内細菌叢を調べると3.7%であったという報告13)や15.6%が好気性菌であったという報告(図13)14)など、透析患者の腸内細菌叢は異常であるという報告で一致している。腸内細菌叢をうまく制御できれば腎機能悪化を防ぎ透析導入になる患者数を減らすことができ、透析患者にとっても死因のトップである心血管病変を減らすことができるかもしれない。
さらに健常者の腸内細菌叢は嫌気性菌が99%以上を占めるのに対し、光岡知足先生の便培養技術によって透析患者の腸内細菌叢を調べると3.7%であったという報告13)や15.6%が好気性菌であったという報告(図13)14)など、透析患者の腸内細菌叢は異常であるという報告で一致している。腸内細菌叢をうまく制御できれば腎機能悪化を防ぎ透析導入になる患者数を減らすことができ、透析患者にとっても死因のトップである心血管病変を減らすことができるかもしれない。
3.透析患者が経口カルニチンを服用、腎不全患者がトリプトファンを摂取しもよいのか?
もう1つ気になることは生体にとって必要なトリプトファン、レシチン、カルニチンなどはサプリメントとしても発売されているが、腎不全患者がこれらのサプリメントを摂取してもいいのか、あるいはいけないのかについて明快な答えがないことが悩ましい。カルニチンは蛋白結合しない低分子薬物で分布容積も0.2~0.3L/kgと小さいため、血液透析によって極めて除去されやすい。そのため保存期腎不全では欠乏しないカルニチンが血液透析患者では欠乏して筋肉症状(こむら返り・筋力低下等),心症状(心機能低下・心筋症等),エリスロポエチン抵抗性貧血などのカルニチン欠乏症を起こしやすい。経口カルニチン製剤のバイオアベイラビリティが20%以下と低いため、血液透析患者では吸収されずに腸内に残ったカルニチンがTMAOに変換されて蓄積する可能性があるため、透析患者では経口製剤ではなく静注製剤を用いるべきであろう。透析日には透析後に静注製剤を週3回、透析後に1回10~20mg/kgの低用量を静脈側透析回路に注入して開始するなど患者の状態を観察しながら慎重に投与し、漫然と投与を継続しないことが肝要である。
代表的な尿毒素のインドキシル硫酸の前駆体のトリプトファンは脳内で幸福感を感じさせてくれる神経伝達物質で枯渇するとうつ病になるセロトニン(5-HT; 5-hydroxytryptamine)、夜になると睡眠を促すメラトニンの前駆物質になる。ということはトリプトファンを摂取すると脳内に移行して幸福感を得るのに欠かせない物質・セロトニン15)、あるいは睡眠に必要なメラトニンに変換されることから、トリプトファンも催眠・鎮静サプリメントとして売られている(図14)。 うつ病患者では血中トリプトファン濃度が低く、トリプトファンを含むタンパク質の摂取量の少ない国では自殺率が高いといわれている16)。生体内にセロトニンは10mg存在し、90%が消化管粘膜に、脳内には2%存在するといわれており、このような腸脳連関は腸腎連関以上に学問的に確立している17)。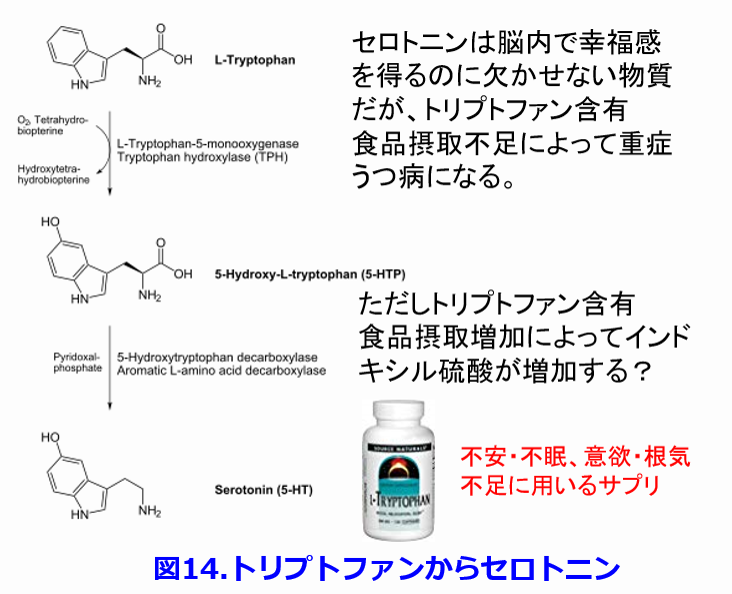 CKD患者がトリプトファンを過剰摂取するとインドキシル硫酸の産生量が増え、それによってインドキシル硫酸濃度が高くなって腎機能が低下を伴うことが危惧されるはずである。そこで筆者はPubMedで論文を検索してみたが、今のところ、トリプトファン摂取が腎機能を悪化させる要因であったのか?あるいは腎機能が悪くなった結果としてインドキシル硫酸濃度が高くなったのかについての判断がつけられないのが現状ではないだろうかという論文を見つけた18)。このようにまだまだこの分野で解明されていないことは多いが、現状では透析患者が経口カルニチンを服用するよりも静注投与という選択肢があるかぎり、経口カルニチンではなく静注カルニチンを使うべきであろう。そして腎不全患者がトリプトファンを摂取しもよいのかについては不明であるが、大量摂取は控えたほうがよいのではないだろうか。今後の研究に注目したい。
CKD患者がトリプトファンを過剰摂取するとインドキシル硫酸の産生量が増え、それによってインドキシル硫酸濃度が高くなって腎機能が低下を伴うことが危惧されるはずである。そこで筆者はPubMedで論文を検索してみたが、今のところ、トリプトファン摂取が腎機能を悪化させる要因であったのか?あるいは腎機能が悪くなった結果としてインドキシル硫酸濃度が高くなったのかについての判断がつけられないのが現状ではないだろうかという論文を見つけた18)。このようにまだまだこの分野で解明されていないことは多いが、現状では透析患者が経口カルニチンを服用するよりも静注投与という選択肢があるかぎり、経口カルニチンではなく静注カルニチンを使うべきであろう。そして腎不全患者がトリプトファンを摂取しもよいのかについては不明であるが、大量摂取は控えたほうがよいのではないだろうか。今後の研究に注目したい。
引用文献
1) 西原 舞, 他:透析会誌37: 1887-1892, 2004
2) 西原 舞, 他:透析会誌38: 1279-1283, 2005
3) 日本透析医学会: わが国の慢性透析療法の現況2016
4) Salmoirago-Blotcher E, et al : Am J Med 124: 714-723, 2011
5) Sumida K, et al. Atherosclerosis 281: 114-120, 2018
6) Sumida K, et al: J Am Soc Nephrol28: 1248-1258, 2017
7) Skype SM, Hazen SL: Cell Host & Microb 20: 691-692, 2016
8) Niwa T et al: Kidney Int 52, Suppl 62: S23-S28, 1997
9) Roager HM, Licht TR: Nature Commun 2018 9(1):3294. doi: 10.1038/s41467-018-05470-4.
10) Barreto FC, et al: Clin J Am Soc Nephrol 4: 1551-1558, 2009
11) Liabeuf S, et al: Nephrol Dial Transplant 25: 1183-1191, 2010
12) Tang WHW, et al: N Engl J Med 368: 1575-1584, 2013
13) 阿部貴弥, 他: 透析会誌29: 1529-1537, 1996
14) 安藤康宏, 他: 透析会誌32: 349-356, 1999
15) Gao K, et al: Adv Nutr 11: 709-723, 2020
16) アランナ・コリン: あなたの体は9割が細菌 微生物の生態系が崩れはじめた. 2016
17) De Palma G, et al: J Physiol 592: 2989-2997, 2014
18) Cheng Y, e t al: Sci Rep 2020; 10: 12675.doi: 10.1038/s41598-020-69559-x.
◆連載◆薬物代謝に関わる腸内細菌~アレルギー疾患が急増した理由~ 第10回
1.ジゴキシンとエリスロマイシン、テトラサイクリンの相互作用のメカニズム
ジゴキシンの代謝には腸内細菌が関わっているのをご存じだろうか?ジゴキシンとエリスロマイシンの併用によってジゴキシンの血中濃度が上昇するといわれている。添付文書には「エリスロマイシン、クラリスロマイシン、テトラサイクリンとの併用によって腸内細菌叢*への影響による本剤の代謝の抑制、あるいは、P糖タンパク質を介した本剤の排泄の抑制により血中濃度が上昇するとの報告がある。」とされているが、クラリスロマイシンはCYP3A4阻害薬でありP糖タンパク質の阻害薬であることは今となっては誰でも知っているが、テトラサイクリンにはそのような阻害作用はないはずだ。ではエリスロマイシンはどうなんだろう、というのが今回のテーマだ。
エリスロマイシンとテトラサイクリンがジゴキシンの血中濃度を上げる報告はNew Engl J Medに掲載されたLindenbaumらの報告で抗生物質がジゴキシンを代謝する腸内細菌叢への影響を初めて明らかにした1)。内容はジゴキシン錠を投与し定常状態に達した10~17日目に、エリスロマイシンやテトラサイクリン系抗生物質を5日投与により、患者の10%で尿および糞便中のジゴキシン代謝物の排泄が阻害され、血清ジゴキシン濃度が2倍に上昇したという内容である。これは抗菌作用によって腸内細菌叢が変化し、嫌気性菌Eubacterium lentumによるジゴキシンの不活性物質への代謝(ジゴキシンのジヒドロジゴキシンへの代謝)が阻害されることによるという内容である(図1; 赤字および赤線部分に腸内細菌が関わっている)。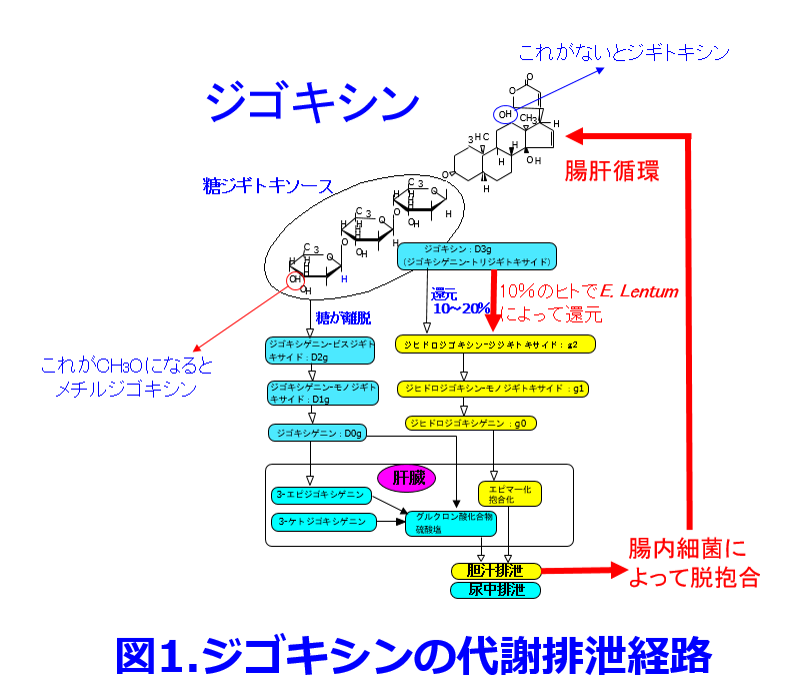 このためジゴキシン服用中の患者のうち腸内細菌としてE. lentumを持っている10%の人でジゴキシンの吸収が促進し、バイオアベイラビリティが上昇し、血中濃度が2倍になるというものである。
このためジゴキシン服用中の患者のうち腸内細菌としてE. lentumを持っている10%の人でジゴキシンの吸収が促進し、バイオアベイラビリティが上昇し、血中濃度が2倍になるというものである。
この論文のデータは非常にきれいであるが、ジゴキシンを代謝するE. lentumを常在菌として持っている人は10%にすぎず(報告によってはもっと高い報告もある)、腸内細菌叢の変化によって起こる血中濃度上昇は10人に1人しか起こりえないことになる。
クラリスロマイシンによる血中ジゴキシン濃度の上昇はジゴキシンが腎排泄性薬物であるため、近位尿細管のP糖タンパク質によるジゴキシンの排泄をクラリスロマイシンが阻害することによって起こると考えがちで、実際にそのような臨床報告もあった2)。筆者は白鷺病院時代に年間600件のジゴキシンのTDMをやっていた累積データから、クラリスロマイシンが併用された腎機能の廃絶した透析患者6名(うち4名は無尿)すべてで血中ジゴキシン濃度が平均3倍(1.8~4倍、非透析患者での相互作用も平均約3倍に上昇する(表))に上昇することを明らかにした(図2)3)。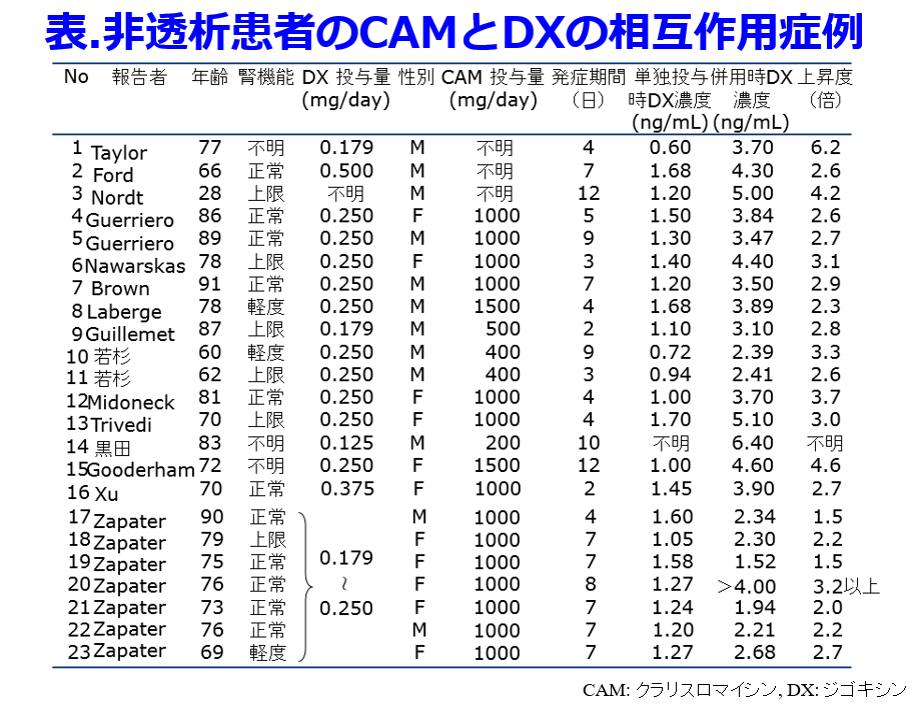
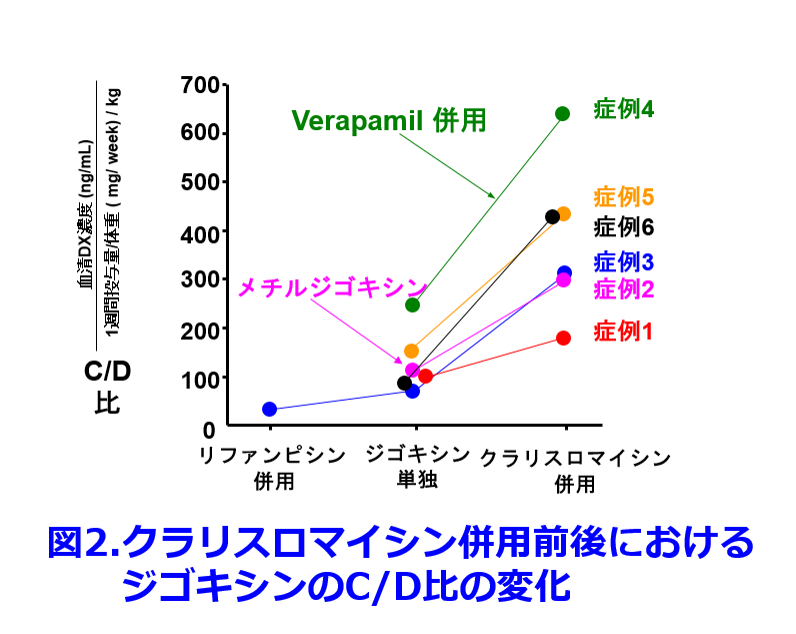 P糖タンパク質阻害薬のベラパミル(ワソラン?)が併用されていた症例4の血中濃度/用量比(C/D比)はもともと高く、症例3では結核によりP糖タンパク質を誘導するリファンピシンが投与されたときにはジゴキシン濃度は1/3に低下し、クラリスロマイシン併用によりリファンピシン中止時の3倍になるなど、クラリスロマイシンが併用された6名全員で明らかな血清ジゴキシン濃度の上昇が認められた。すなわちクラリスロマイシンとジゴキシンの相互作用はLindenbaumらの報告のように10%の確率で起こる相互作用ではなく、併用された6名全員に起こった相互作用であること、無尿の透析患者では尿細管機能も含め完全に腎機能が廃絶しているため、この相互作用はクラリスロマイシンが尿細管ではなく、胆管あるいは消化管のP糖タンパク質によるジゴキシンの排泄が阻害されているに違いないと考えている。
P糖タンパク質阻害薬のベラパミル(ワソラン?)が併用されていた症例4の血中濃度/用量比(C/D比)はもともと高く、症例3では結核によりP糖タンパク質を誘導するリファンピシンが投与されたときにはジゴキシン濃度は1/3に低下し、クラリスロマイシン併用によりリファンピシン中止時の3倍になるなど、クラリスロマイシンが併用された6名全員で明らかな血清ジゴキシン濃度の上昇が認められた。すなわちクラリスロマイシンとジゴキシンの相互作用はLindenbaumらの報告のように10%の確率で起こる相互作用ではなく、併用された6名全員に起こった相互作用であること、無尿の透析患者では尿細管機能も含め完全に腎機能が廃絶しているため、この相互作用はクラリスロマイシンが尿細管ではなく、胆管あるいは消化管のP糖タンパク質によるジゴキシンの排泄が阻害されているに違いないと考えている。
ジゴキシンとバラパミルは心房細動のレートコントロールによく併用されるため、非常に重要な相互作用であるが、ベラパミル錠240mg/日の併用によって透析患者のジゴキシン濃度は約2倍に上昇する。これに関してはジゴキシン服用者5名に経口ベラパミル最大用量の240mg/日を併用して腎クリアランスと胆汁クリアランス(胆汁を胆管からドレナージして採取する臨床試験は現在では倫理委員会を通らないのでは?)をクロスオーバー試験で示した報告で4)、腎クリアランスに変化はなかったものの胆汁クリアランスが有意に43%低下したことから、ジゴキシンの尿細管分泌よりも胆汁排泄、あるいは小腸での排泄が阻害されやすいのではないかということが推察できる(図3)。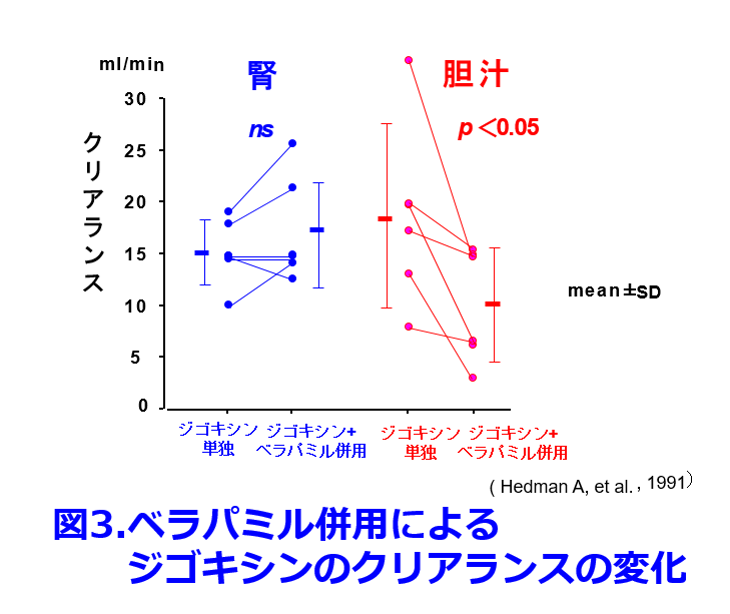 Lindenbaumらはこれ以降も権威の高い雑誌でこの現象について報告し続けたが、17年後にAm Fam Physician誌に「E. lentumを常在菌として持っていればジゴキシンの血中濃度が上がらないだろうが、1966年以来、私や私の仲間がこのような現象を見たことも聞いたこともない」というLetter to Editorが届いている5)。現在では同じマクロライド系のエリスロマイシンもクラリスロマイシンと同様、P糖タンパク質阻害のメカニズムと考えるのが妥当であろう。
Lindenbaumらはこれ以降も権威の高い雑誌でこの現象について報告し続けたが、17年後にAm Fam Physician誌に「E. lentumを常在菌として持っていればジゴキシンの血中濃度が上がらないだろうが、1966年以来、私や私の仲間がこのような現象を見たことも聞いたこともない」というLetter to Editorが届いている5)。現在では同じマクロライド系のエリスロマイシンもクラリスロマイシンと同様、P糖タンパク質阻害のメカニズムと考えるのが妥当であろう。
NOTE: 腸内細菌叢
抗菌薬シリーズ第6回でCD腸炎、偽膜性大腸炎の原因菌のクロストリジウム・ディフィシルが2016年以降、クロストリディオイディス・ディフィシルという名称に変わったと書いたが、腸内細菌叢の英名は以前はmicrofloraであったがこれでは植物を表すとして、新たにmicrobiota(遺伝情報まで含むとmicrobiome)に変わった。細菌は細胞核を持たない原核生物で、同じ微生物の中でも真核生物である真菌とは異なる分類になる。「細菌は細胞壁をもつので植物?」と思う方もいるかもしれないがこれらは全く別物で、生物は細菌を含む原核生物と真核生物に分かれ、学説によって異なるが真核生物はさらに動物界、植物界、原生生物界(真菌を含む菌界)などに分かれるという5界説で説明すると理解しやすいかもしれない。
2.腸肝循環する薬物代謝にも腸内細菌が関わっている
薬物代謝に関わる腸内細菌はジゴキシンに関しては疑わしい部分もあるが、腸内細菌が薬物代謝に関わっている例はこれだけではない。モルヒネが高齢者や腎機能低下患者で使いにくいのはM6G(モルヒネ-6-グルクロニド)というグルクロン酸抱合体が蓄積してせん妄をきたしやすいことによる。グルクロン酸抱合体は極性が高いため腎機能正常者であれば速やかに尿中に排泄されるが腎機能が低下すると蓄積しやすいためである。ただしそれだけではない。腎機能が低下して蓄積した抱合体は胆管のトランスポータによって胆汁排泄されやすいが、十二指腸に排泄された抱合体が回腸で腸内細菌の持つβグルクロニダーゼによって脱抱合され、再びモルヒネとして吸収されて肝臓で代謝されるという「腸肝循環」によって血中濃度が下がりにくくなることがある(図4)。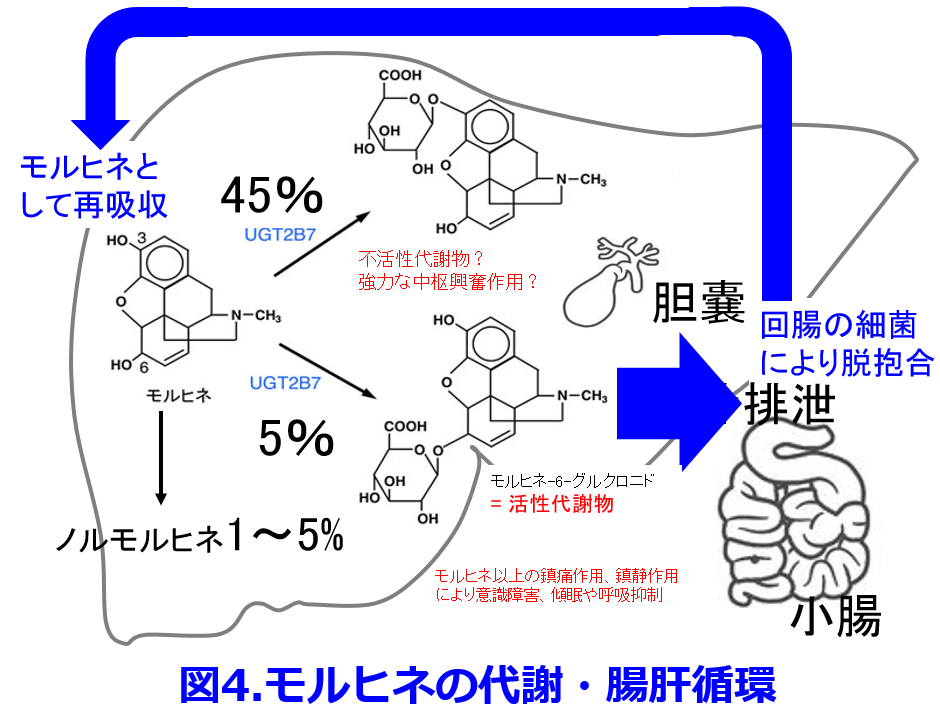 腸肝循環する薬物にはモルヒネのほかにも先述のジゴキシン(図1)、アセトアミノフェン、コルヒチン、エストロゲンなどの薬物のほかにもたくさんあるので本ホームページの「育薬に活用できるデータベースの 2.薬物動態の 4.腸肝循環する薬物」の一覧表およびその解説を見ていただきたい。さらに腎機能悪化の原因となるインドキシル硫酸、パラクレジル硫酸、トリメチルアミン-N-オキサイドなどのいずれの尿毒素uremic toxinも腸内細菌によって産生されているが、これについては次回、第11回で触れたいと思う。
腸肝循環する薬物にはモルヒネのほかにも先述のジゴキシン(図1)、アセトアミノフェン、コルヒチン、エストロゲンなどの薬物のほかにもたくさんあるので本ホームページの「育薬に活用できるデータベースの 2.薬物動態の 4.腸肝循環する薬物」の一覧表およびその解説を見ていただきたい。さらに腎機能悪化の原因となるインドキシル硫酸、パラクレジル硫酸、トリメチルアミン-N-オキサイドなどのいずれの尿毒素uremic toxinも腸内細菌によって産生されているが、これについては次回、第11回で触れたいと思う。
引用文献
1)Lindenbaum J, et al: N Engl J Med 305: 789-794, 1981
2)Wakasugi H, et al: Clin Pharmacol Ther 64: 123-128, 1998
3)Hirata S, et al: Int J Pharmacol Ther 43 (1): 30-36, 2005.
4) Hedman A, et al: Clin Pharamacol Ther 49: 256-262. 1991
5) Constantine PA: Am Fam Physician 57: 1239-1240, 1998
◆連載◆クロストリディオイデス・ディフィシル(CD)腸炎について考える 第9回 後編
2.クロストリディオイデス・ディフィシル(CD)腸炎を防ぐために
(5)CD腸炎はどんな人が罹患しやすい?
CD腸炎の院内感染に罹患しやすい患者は我々の経験のように①広域スペクトル抗菌薬が投与された患者がほとんどで、②高齢者(特に長期入院患者)、③胃酸分泌抑制薬のPPIやH2遮断薬投与患者ではCD関連下痢症のリスクが3倍高くなることが報告されており4)、PPIの服用で再発性CD腸炎を4.2倍になる5)。
欧米人では抗菌薬非投与群ならば0~数%、抗菌薬投与群で約20%に上昇し、日本人は欧米人と比較してCDの保菌率が非常に高く、抗菌薬を投与されていないケースで約25%,抗菌薬投与例ではたとえ無症状でも約50%からCDが分離される。日本人で保菌者が多いという事実は,逆に毒素に対する抗体を持つ率が高いとも言えるので、日本人は欧米人ほど激しい症状に見舞われずに済むことが多い。逆に米国では年間50万人にCD腸炎に罹患し、1万4千人が死亡しておりその医療費は48億円に達している6)。高齢者・手術侵襲・TPNによる粘膜退行・腸虚血・血圧低下・免疫能低下などの要因が加わると激しい腸炎を発症することがある。
抗菌薬としては最初の偽膜性大腸炎の報告の原因薬物がクリンダマイシンであったため、クリンダマイシン、リンコマイシンの使用がCD腸炎の発症原因になりやすいと考えられていたが、現在ではほとんど全ての抗菌薬が原因となり、セフェム、ペニシリン、βラクタム+βラクタマーゼ阻害薬、胆汁排泄されやすい抗菌薬、キノロン系、クリンダマイシン、リンコマイシンによるものが多いといわれている。経口抗菌薬だけでなく、あらゆる種類の抗菌薬投与が腸管内での菌交代現象からCDが増殖してCD腸炎や、重篤化すると偽膜性大腸炎を発症することがある。特筆されるべきはCD腸炎の治療薬となるVCMの静脈内投与後にCD腸炎が起こったという報告があるということだ7)。
(6)CD腸炎パンデミック防止対策
接触感染し、芽胞を形成するのでエタノールが無効なため、通常の接触予防策ではなく、石鹸を用いる物理的な手洗い・環境の清拭、使い捨て手袋、使い捨てガウンの着用を主とした標準予防策、便失禁のある患者の隔離が重要と考えられる。
またCD腸炎を発症した全患者に抗菌薬が投与され、発症者のうち高頻度で胃酸分泌抑制薬が投与されていたため、これらの症例に対して、CD腸炎予防のためのプロバイオティクス投与が有効な可能性がある。ただし抗菌薬耐性とうたっている整腸剤投与であってもバンコマイシンやキノロンによって死滅するものがほとんどである。小児の報告ではあるが、抗菌薬単独投与群の抗菌薬関連下痢症は59%に発症したが、CDの増殖に拮抗作用を示す細菌製剤としてClostridium butyricum(ミヤBM?錠: 宮入菌)を抗菌薬と同時に予防投与した患児の抗菌薬関連下痢症発症率は9%、さらに抗菌薬投与3日前に予防投与すると5%に激減した(図4)8)。しかも抗菌薬が投与された群では嫌気性菌が増加しビフィズス菌の減少が防げた。 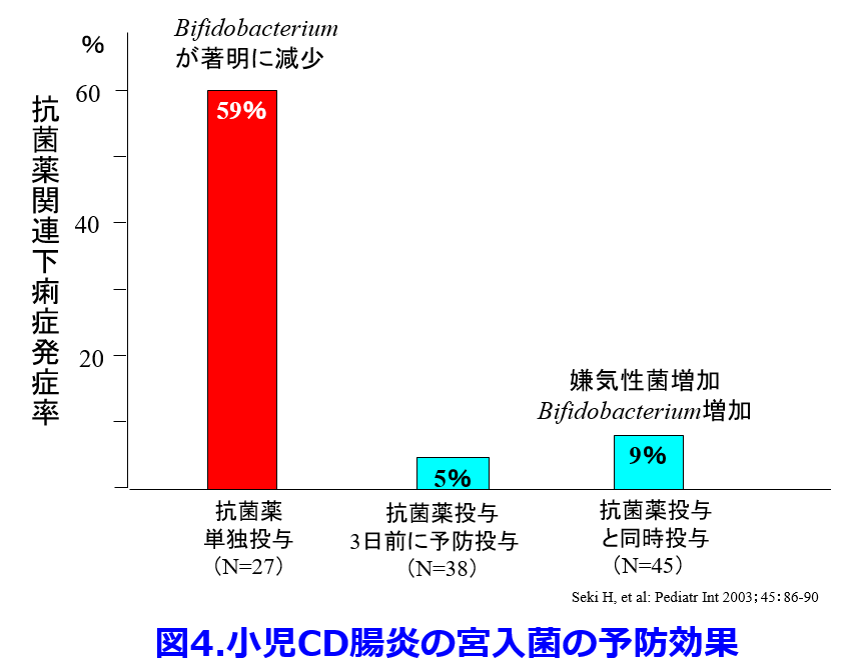 これらの結果から我々の経験した院内アウトブレイクも宮入菌の予防投与によって防げたかもしれない。宮入菌もCDと同様に芽胞を形成するため、バンコマイシン投与によっても死滅しない。今回提示した症例でレボフロキサシン投与によってCD感染が再発したように、CD感染は再発しやすい。そのため再発を防ぐためバンコマイシン投与中止後も宮入菌の投与を続ける必要があったのかもしれない。宮入菌は抗菌薬投与にも関わらず、70%の患者から宮入菌が糞便中から分離され、そのうち半数は芽胞菌より、非芽胞菌が多く、投与された生菌が消化管内で発芽していることを示している。糞便中CDまたはトキシンの検出率は、抗菌薬投与後、著しく増加するが、その増加は宮入菌の併用によって著明に抑制される9)。宮入菌はCDの発育とトキシンAの産生を抑制し、CDの糞便中検出率を減少させる。糞便移植(FMT: Fecal Microbiota Transplantation)はさらに有効でVCM14日標準投与群の再発なし治癒率が30.8%だったのに比し糞便の経鼻注入2回群の治癒率は93.8%であった(図5)10)。
これらの結果から我々の経験した院内アウトブレイクも宮入菌の予防投与によって防げたかもしれない。宮入菌もCDと同様に芽胞を形成するため、バンコマイシン投与によっても死滅しない。今回提示した症例でレボフロキサシン投与によってCD感染が再発したように、CD感染は再発しやすい。そのため再発を防ぐためバンコマイシン投与中止後も宮入菌の投与を続ける必要があったのかもしれない。宮入菌は抗菌薬投与にも関わらず、70%の患者から宮入菌が糞便中から分離され、そのうち半数は芽胞菌より、非芽胞菌が多く、投与された生菌が消化管内で発芽していることを示している。糞便中CDまたはトキシンの検出率は、抗菌薬投与後、著しく増加するが、その増加は宮入菌の併用によって著明に抑制される9)。宮入菌はCDの発育とトキシンAの産生を抑制し、CDの糞便中検出率を減少させる。糞便移植(FMT: Fecal Microbiota Transplantation)はさらに有効でVCM14日標準投与群の再発なし治癒率が30.8%だったのに比し糞便の経鼻注入2回群の治癒率は93.8%であった(図5)10)。 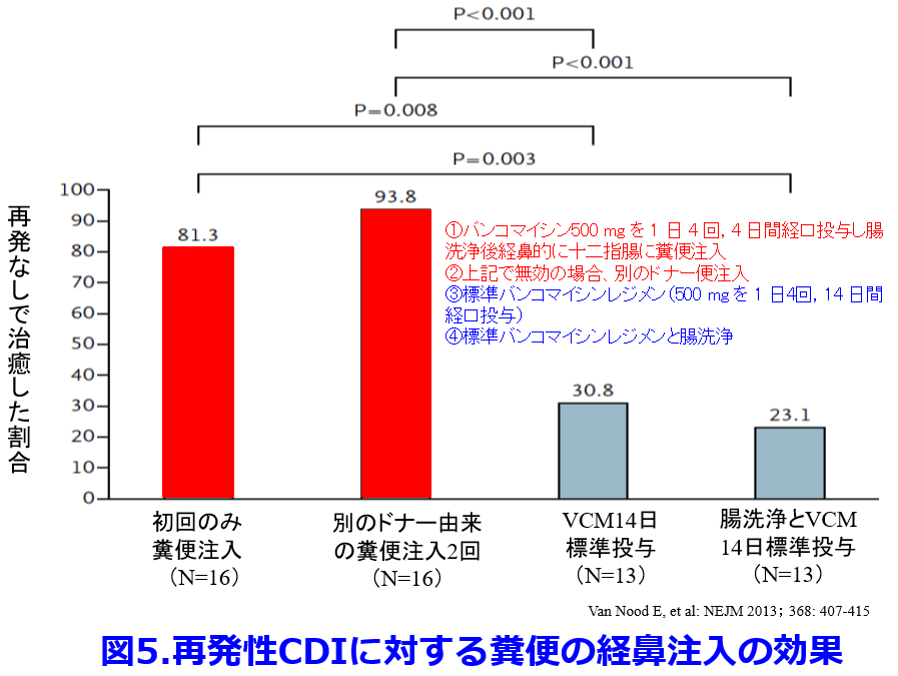 宮入菌はこのほかにも免疫チェックポイント阻害薬が投与された時に発症しやすい重症大腸炎を防ぐ目的で使われることがあるが、非小細胞肺がんに宮入菌を併用すると生存率が向上したという結果が熊本大学呼吸器内科から報告された(図6)11)。さらに糞便移植によって免疫チェックポイント阻害薬の反応性が向上するという報告もある12)。
宮入菌はこのほかにも免疫チェックポイント阻害薬が投与された時に発症しやすい重症大腸炎を防ぐ目的で使われることがあるが、非小細胞肺がんに宮入菌を併用すると生存率が向上したという結果が熊本大学呼吸器内科から報告された(図6)11)。さらに糞便移植によって免疫チェックポイント阻害薬の反応性が向上するという報告もある12)。 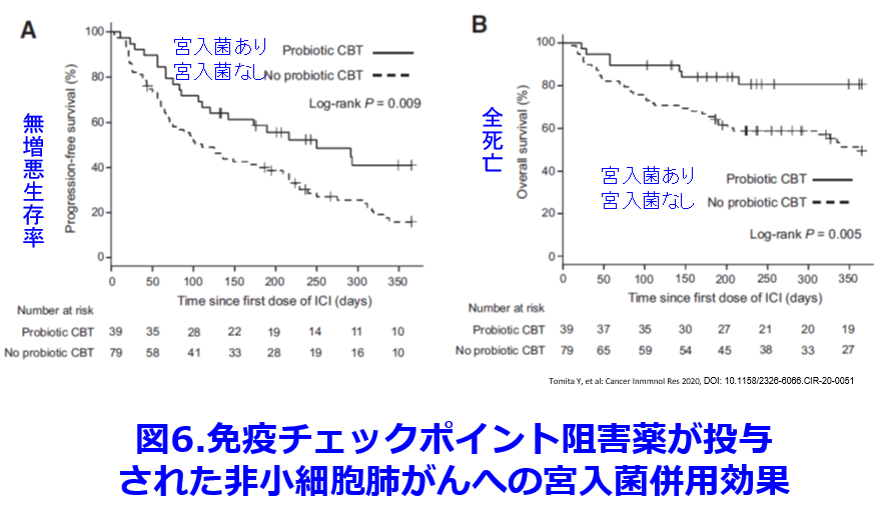 宮入菌は酪酸菌であり、酪酸はもともと抗炎症作用があり上皮細胞のエネルギー源となるため、便秘症状も改善するが、特に下痢気味の人に良く効く整腸剤のイメージがあり、確かに下部消化器疾患に対する有効性は高い13)。しかし最近の報告では酪酸は血糖値の急上昇を抑えるGLP-1や食欲を抑えるペプチドYYなど消化管ホルモンの分泌を促し、脂肪が貯まりにくい体質にして肥満を防止するといわれている。また酪酸は小腸のパイエル板に働いて免疫細胞の暴走を止める制御性T細胞の産生を誘導することも注目されており、アレルギー疾患や自己免疫疾患の発症防止にも関与する可能性があり、宮入菌は単なる整腸剤にとどまらない可能性を秘めている。
宮入菌は酪酸菌であり、酪酸はもともと抗炎症作用があり上皮細胞のエネルギー源となるため、便秘症状も改善するが、特に下痢気味の人に良く効く整腸剤のイメージがあり、確かに下部消化器疾患に対する有効性は高い13)。しかし最近の報告では酪酸は血糖値の急上昇を抑えるGLP-1や食欲を抑えるペプチドYYなど消化管ホルモンの分泌を促し、脂肪が貯まりにくい体質にして肥満を防止するといわれている。また酪酸は小腸のパイエル板に働いて免疫細胞の暴走を止める制御性T細胞の産生を誘導することも注目されており、アレルギー疾患や自己免疫疾患の発症防止にも関与する可能性があり、宮入菌は単なる整腸剤にとどまらない可能性を秘めている。
(7)CD腸炎の治療薬
軽症者ではメトロニダゾールを1.0~1.5g/日投与するが、小腸で大部分が吸収されるために結腸内への移行が不十分であることが欠点である。重篤な症例にはVCM0.5~2g/日を経口投与する14)。下痢、発熱は1~2日間の投与で軽快し、7~14日の投与でほとんどの症例が治癒する。ただし米国ではバンコマイシンの使用はメトロニダゾールによる治療に反応しない症例や、重篤で生命に危険性のあるような場合の使用に限られており、抗生剤腸炎の初期治療にはVCMは使用すべきではないとされている(米国防疫センター:VCMの耐性菌を防ぐために)。
最近の報告ではVC M耐性株が増加傾向であり15)、以前に説明したようにグラム陽性菌に強くバイオアベイラビリティが非常に低い(イヌのデータで3%以下)代替薬としてマクロライド系抗菌薬であるフィダキソマイシン(ダフクリア?錠)が使用される。糞便中濃度は高いものの、バクテロイデスなどの腸内細菌叢にあまり影響しないので、CDに選択的に作用すると考えられている16)。
CD腸炎の再発防止のためには抗CDトキシンB ヒトモノクローナル抗体であるベズロトクスマブ(ジーンプラバR)が利用でき、CDトキシン B に結合し、CD トキ シン B と標的細胞との結合を阻害することによってトキシンの活性を中和するが抗菌活性を有していないことから、CD腸炎の抗菌薬治療と併せて使用する。
(8)まとめ~この症例で得た教訓~
1. 吸収されるはずのないバンコマイシンが炎症所見の強い腸病変では吸収され、腎機能の廃絶した透析患者では排泄されにくいため中毒域に達することがある。
2. CD腸炎は再発しやすく、芽胞を形成するためエタノールによる手指消毒は無効で院内感染しやすいので、医療従事者の手洗いの徹底が重要である。
3. CD腸炎は①抗菌薬が投与された患者がほとんどで、②高齢者(特に長期入院患者)、③胃酸分泌抑制薬のPPIやH2遮断薬投与患者ではCD関連下痢症のリスクが高くなる。
4. CD腸炎治療には軽症者ではメトロニダゾール、重症者にはバンコマイシン散(通常は0.125gを1日4回、重症例には1日2.0gまで投与可能)、無効例にはフィダキソマイシンを投与し、再発例にはベズロトクスマブを併用する。糞便移植の治療成績は極めて高い。
5. アウトブレイク予防・再発予防にはプロバイオティクスのミヤBM?(宮入菌)の投与が有効かもしれない。
引用文献
4) Morrison RH et al. Clin Infect Dis 15; 53:1173、2011
5) Candle RM, et al: Am J Health Syst Pharm 64: 2359-2363, 2007
6) Paddock C: Study reveals how C. difficile disrupts the gut. 2015 https://www.medicalnewstoday.com/articles/289817
7) Hecht JR, Olinger EJ: Dig Dis Sci 34: 148-149, 1989
8) Seki H, et al: Pediatr Int 2003;45:86-90
9) Ritchie ML, et al: PLoS One 2012; 7(4)e34938
10) Van Nood E, et al: NEJM 2013; 368: 407-415
11) Tomita Y, et al: Cancer Inmmnol Res 2020, DOI: 10.1158/2326-6066.CIR-20-0051
12)Routy B, et al: Science 2018; 359: 91-97
13)高橋志達, 他: 日化療誌66:489-503, 2018
14) Zar FA, et al: Clin Infect Dis 45: 302-307, 2007
15)Saha S, et al. Anaerobe 58: 35-46, 2019
16) Louie TJ, et al: Antimicrobial Agents and Chemotherapy 53 : 261-263, 2008
◆連載◆クロストリディオイデス・ディフィシル(CD)腸炎について考える 第9回 前編
1.クロストリディオイデス・ディフィシル(CD)腸炎・偽膜性大腸炎とバンコマイシンのTDM
(1)はじめに
今回は抗菌薬関連下痢症・細菌性腸炎の原因菌として最も重要なクロストリディオイデス・ディフィシル感染症Clostridioides difficile(CD)腸炎について我々の経験した症例について解説したい。これも腸内細菌叢の変化が大きく関わる疾患である。なおCDは2016年まではクロストリジウム・ディフィシルと呼ばれていた有芽胞偏性嫌気性グラム陽性桿菌で下痢、腹痛、発熱を伴うCD腸炎や偽膜性大腸炎、あるいは麻痺性イレウスや巨大結腸症発症、腸管穿孔の主要な原因菌とされ、健康成人でも日本人で10~50%前後の糞便から検出され、もともと弱毒菌で菌量が少なければ健常者には病原性はないが、菌量が増えてトキシンA、トキシンBという外毒素を産生すると、腸炎を引き起こす。傷口から感染しやすい破傷風菌 (C. tetani )、真空パックの食品内部でも増殖して食中毒の原因になるボツリヌス菌 (C. botulinum )、常在菌だが毒素を産生して食中毒の原因になり、ガス壊疽菌を起こすことがあるウェルシュ菌 (C. perfringens )などは今まで通りClostridium属である。
(2)症例1)
68歳、体重56.8kgの男性透析患者で原疾患は糖尿病。肛門周囲膿瘍のため入院し、セフォチアムに次いでクリンダマイシン+セフタジジムが投与された。第23病日に発熱、白血球数29,190/μL、CRPが20mg/dLを超え、大腸ファイバーにて著明な偽膜*(図1左)の形成、CD抗原を認めたため、抗菌薬投与を中止し、バンコマイシン(VCM)散0.5gを1日4回、経口投与された。翌日よりメトロニダゾール250mg、1日2回を経口投与後、8日目にCD抗原は消失し投与10日目には内視鏡にて偽膜形成の減少が観察された(図1中)。しかし下痢症状の改善があまりみられなかったことから、36病日(VCM投与14日)に血漿VCM濃度の測定を依頼すると51.98μg/mLと異常高値であり、便培養でCDが検出されなかったためVCMの投薬を中止して経過を観察した。37病日には58.74μg/mL(経口VCM投与後では当時の世界記録)と非常に高値を示した。 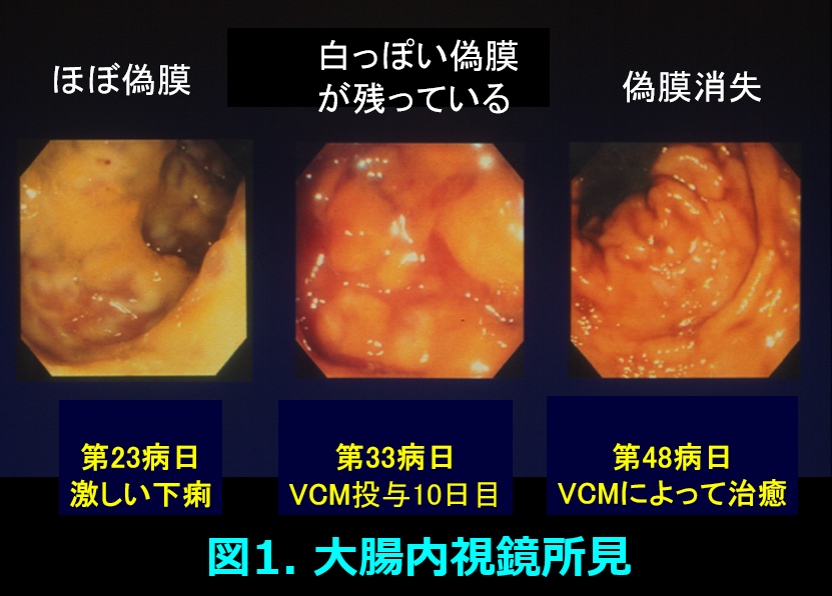 投与中止後6.56μg/mlにまで血漿濃度が低下するのに27日間を要し、この間のVCMの消失半減期は158時間であり、Vdを0.956L/kgとしてクリアランスを算出するとClearance =(ln2×Vd)/t1/2 =(0.693×0.956×56.8×1000)/158×60=3.97mL/minと透析患者のVCMクリアランスが非常に低いことも解明された。さらに158時間という半減期から58.7μg/mLという濃度は完全に定常状態に達しているわけではないが、バイオアベイラビリティ(この場合、吸収率)=Clearance×steady state serum VCM level/ VCM dose= (3.97×58.7)/{2.0×1,000,000/(24×60)}=0.1678となり、吸収されるはずのないVCMが偽膜という腸管炎症所見が強い場合、少なくとも16.78%が吸収されたと考えられた。これはCDトキシンが腸管上皮の緻密結合tight junctionを傷害してバリア機能が破綻したために、吸収されるはずのないVCMが吸収されたものと考えた。VCMの中毒反応は腎障害や聴覚障害が知られているが、腎機能の廃絶したこの症例には有害反応は見られなかった。48病日には偽膜は完全に消失した(図1右)。
投与中止後6.56μg/mlにまで血漿濃度が低下するのに27日間を要し、この間のVCMの消失半減期は158時間であり、Vdを0.956L/kgとしてクリアランスを算出するとClearance =(ln2×Vd)/t1/2 =(0.693×0.956×56.8×1000)/158×60=3.97mL/minと透析患者のVCMクリアランスが非常に低いことも解明された。さらに158時間という半減期から58.7μg/mLという濃度は完全に定常状態に達しているわけではないが、バイオアベイラビリティ(この場合、吸収率)=Clearance×steady state serum VCM level/ VCM dose= (3.97×58.7)/{2.0×1,000,000/(24×60)}=0.1678となり、吸収されるはずのないVCMが偽膜という腸管炎症所見が強い場合、少なくとも16.78%が吸収されたと考えられた。これはCDトキシンが腸管上皮の緻密結合tight junctionを傷害してバリア機能が破綻したために、吸収されるはずのないVCMが吸収されたものと考えた。VCMの中毒反応は腎障害や聴覚障害が知られているが、腎機能の廃絶したこの症例には有害反応は見られなかった。48病日には偽膜は完全に消失した(図1右)。
下痢症状は改善したが、57病日(VCM投与中止24日目)に気管支炎を発症したため、レボフロキサシン投与を行ったところ、下痢・発熱の再発がみられ、再びCD抗原が認められた(図2)。VCM再投与に至ったが、VCMの血漿濃度は一貫してCDのMICである0.78μg/mlを大きく上回っていたにもかかわらず、腸炎が再発したため、血中から腸管内へのVCMの移行は不良な可能性が示唆された。以上のことから、血液透析患者にVCM散を長期投与する際には血中漿濃度モニタリングを行う必要性があると思われた。 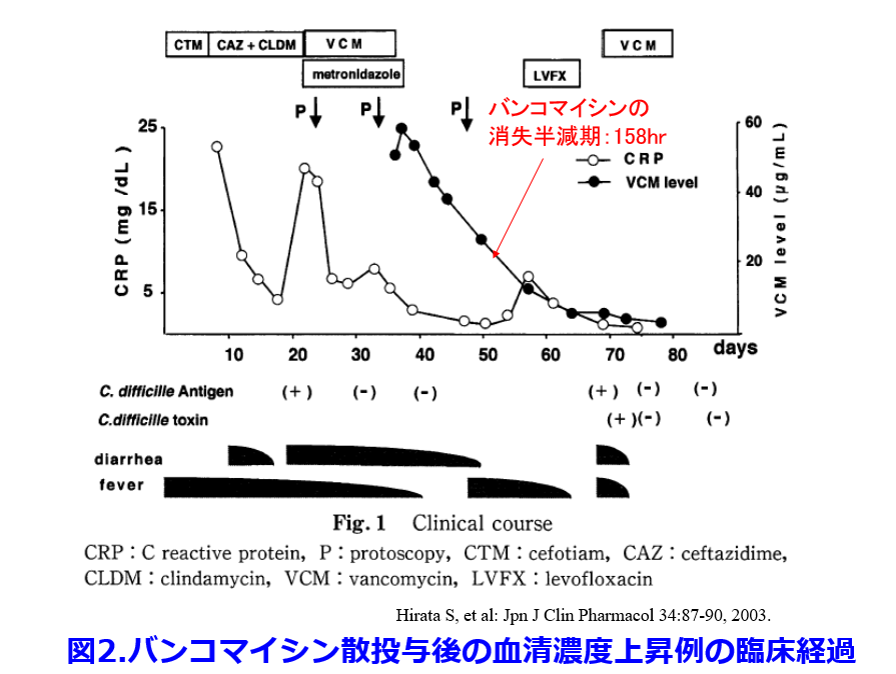 偽膜:大腸粘膜膜表面に血漿内のフィブリンや好中球、粘液などの炎症性物質が浸みだして凝固壊死して作られる膜のようなもの、わかりやすく言うとかさぶたのようなもの。CDだけでなく赤痢菌やカンジダなどによっても形成される。正常な大腸はオレンジ色に見えるが、偽膜は黄白色の扁平あるいは半球状の低い隆起をなす。
偽膜:大腸粘膜膜表面に血漿内のフィブリンや好中球、粘液などの炎症性物質が浸みだして凝固壊死して作られる膜のようなもの、わかりやすく言うとかさぶたのようなもの。CDだけでなく赤痢菌やカンジダなどによっても形成される。正常な大腸はオレンジ色に見えるが、偽膜は黄白色の扁平あるいは半球状の低い隆起をなす。
(3)その後の院内アウトブレイク
この症例が治癒後、院内感染によってCD腸炎患者は同じ病棟内で合計16名となったが、全員が発症前に抗菌薬を投与されており、抗菌薬の併用はCD感染症の治癒率を低下させることが明らかになっている2)。H2ブロッカーのファモチジン、ラニチジン、プロトンポンプ・インヒビター(PPI)のランゾプラゾールといった胃酸分泌抑制薬9名および制酸薬服用者3名で16名中12名(75%)で、同施設内の全透析患者における38.3%に比べ高かかったことから、胃酸抑制が腸炎の発症に関与している可能性が考えられた。さらにある大学に依頼したCDの遺伝子検査結果によると全員が初発の偽膜性腸炎患者と同じCDであり、16名全員が院内感染であることが判明した。
経口VCMの推奨量は0.5-1g/日の7-10日投与(添付文書用量は1回0.125~0.5gを1日4回)で、Keighleyら3)は0.125gの4回/日投与で十分な便中濃度を保ったとしている。本症例は重篤であったため、1日2.0gの投与に踏み切ったが、CD感染に対してVCMの大量投与は腸内細菌叢を崩壊する可能性があるため、少量の方がよかったかもしれない。
(4)クロストリディオイデス・ディフィシル(CD)腸炎とは
抗菌薬投与によってCDが異常増殖し、免疫能の低下した高齢者・手術侵襲・TPNによる粘膜退行・腸虚血・血圧低下などの要因が加わると激しい腸炎を発症することがある。ただし通常の状態では他の常在菌の存在がCDの増殖を抑制しているため、CDの菌数は糞便中102/g以下と少なく、毒素を産生して病原性を発揮することはない。抗菌薬の投与による菌交替現象から腸内細菌叢microbiotaが撹乱され、CDの異常増殖が起こり105/g以上になると大量の毒素を産生してCD腸炎が起こる。偽膜性大腸炎はCD腸炎の重症型であり、トキシンによる大腸の炎症粘膜に壊死白血球が集まって偽膜を形成する。CDは芽胞*(図3)を形成するためエタノール消毒でも死なないし、胃酸によっても芽胞を形成している場合は死滅せず、小腸に移行して嫌気性下になると発芽する。免疫能の低い透析患者や超高齢者の病棟では接触感染によって院内感染が起こるとCDトキシンによる腸炎によって重篤な下痢を起る患者が増える始末が悪い菌になる。 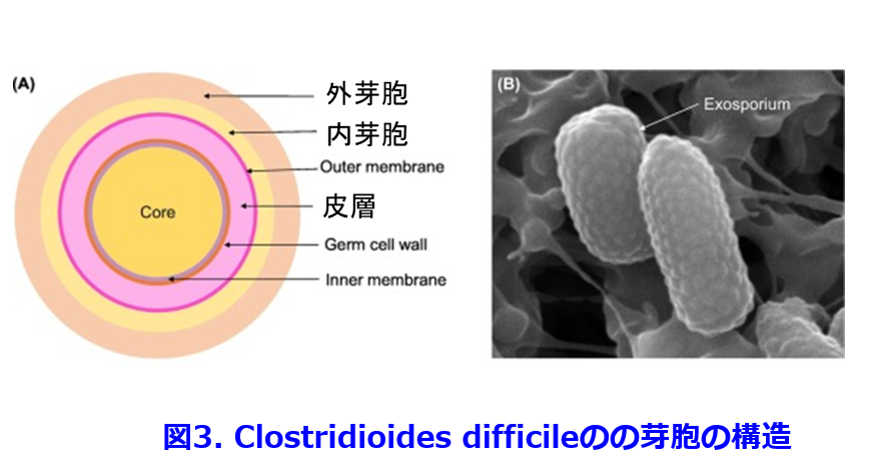 芽胞:ある種の細菌は乾燥や高温、酸や化学物質、紫外線などで環境条件が悪くなると芽胞とよばれる耐久器官を作って生きのびる。この芽胞を形成する菌で好気性の細菌をBacillus属,嫌気性の細菌をClostridium属と呼ぶ。芽胞形成菌であっても周りの環境が生存に適するようになると栄養型になって発芽し分裂増殖を始める。芽胞は代謝が行われていない仮死状態で生物活性がほとんど見られなくなる。
芽胞:ある種の細菌は乾燥や高温、酸や化学物質、紫外線などで環境条件が悪くなると芽胞とよばれる耐久器官を作って生きのびる。この芽胞を形成する菌で好気性の細菌をBacillus属,嫌気性の細菌をClostridium属と呼ぶ。芽胞形成菌であっても周りの環境が生存に適するようになると栄養型になって発芽し分裂増殖を始める。芽胞は代謝が行われていない仮死状態で生物活性がほとんど見られなくなる。
引用文献
1) Hirata S, et al: Jpn J Clin Pharmacol 34:87-90, 2003.
2) Mullane KM et al : Clin Infect Dis Sep 1; 53:440, 2011
3) Keighley MR, et al: Brit Med J 2: 1667-1669, 1978
◆連載◆吸収率の低い第3世代経口セフェムってこんなに必要? 第8回
1.腸内細菌叢の異常によっておこる様々な疾患が増えている
筆者が小学生のころの1960年代前半に友人で喘息、アトピー、花粉症を持っていることを見たことも聞いたこともなかった。そして20年後、筆者が父親になった1980年代に恵まれた2人の子はともにアトピー性皮膚炎、それが治るとアレルギー性鼻炎や喘息になったし、同学年の子供たちの約半数がこのようなアレルギーマーチになっていたように記憶している。このたった20年間に何が変わったのであろうか?食事の内容が豊かになり、内容が欧米化したことや化学物質が増えたことなどがとりざたされている。 一般的な風邪のほとんどはウイルス感染であり、抗菌薬は効果がないことからも、不要な抗菌薬の使用は避ける必要があるのだが、これらに対して経口抗菌薬を気軽に処方することも原因ではないだろうか?
一般的な風邪のほとんどはウイルス感染であり、抗菌薬は効果がないことからも、不要な抗菌薬の使用は避ける必要があるのだが、これらに対して経口抗菌薬を気軽に処方することも原因ではないだろうか?
2019年の2月に腸内細菌叢に興味を持っていたのでアランナ・コリン著「あなたの体は9割が細菌微生物の生態系が崩れはじめた」(図1)という非常に興味深い本を読んだ。第2次世界大戦後に抗菌薬が広く開発され、おかげでその当時の死亡率第1位、2位であった肺炎や結核などの感染症が著しく減少した。これは非常に喜ばしいことであったが、逆になぜか大腸がんやアレルギー性疾患や1型糖尿病やリウマチなどの自己免疫疾患、日本人には少なかった肥満やクローン病(欧米の1/10)や尋常性乾癬(日本で0.1%、世界で3%)、うつ病などの心の病なども大幅に増えたのだ(図2)。 そしてこれらのうち大腸がんを除くといずれも、なぜか若年発症の病気であり、これらに加えて生活習慣病と言われている2型糖尿病、CKD、心不全、脳卒中、高血圧、がんも増えたがこれらは小児期の過体重が原因と言われている。これらの病気の増加は欧米で始まったが、日本でも同様の現象が起こっているのはカロリー過多による肥満だけではなく、食事の欧米化によって日本人が古くから摂り続けてきた食物繊維や発酵食品の摂取不足が腸内細菌叢を変化させたことが原因ではないかと思うようになった。腸内細菌、あるいは小腸および大腸は人体における最大の免疫器官と言っても過言ではない。小腸の内側にある絨毛が未発達な場所にあるパイエル板は腸管免疫とよばれる、生体防御に関わる免疫機構において重要な働きを担っている。注意欠陥多動性障害ADHDや強迫性障害、双極性障害、統合失調症、自閉症、うつ病、パーキンソン病、認知症は免疫系の過剰反応による炎症が関係しているといわれている1)。有益な細菌を腸に加えると免疫系の過剰興奮を鎮める作用がある。
そしてこれらのうち大腸がんを除くといずれも、なぜか若年発症の病気であり、これらに加えて生活習慣病と言われている2型糖尿病、CKD、心不全、脳卒中、高血圧、がんも増えたがこれらは小児期の過体重が原因と言われている。これらの病気の増加は欧米で始まったが、日本でも同様の現象が起こっているのはカロリー過多による肥満だけではなく、食事の欧米化によって日本人が古くから摂り続けてきた食物繊維や発酵食品の摂取不足が腸内細菌叢を変化させたことが原因ではないかと思うようになった。腸内細菌、あるいは小腸および大腸は人体における最大の免疫器官と言っても過言ではない。小腸の内側にある絨毛が未発達な場所にあるパイエル板は腸管免疫とよばれる、生体防御に関わる免疫機構において重要な働きを担っている。注意欠陥多動性障害ADHDや強迫性障害、双極性障害、統合失調症、自閉症、うつ病、パーキンソン病、認知症は免疫系の過剰反応による炎症が関係しているといわれている1)。有益な細菌を腸に加えると免疫系の過剰興奮を鎮める作用がある。
もしも腸内細菌叢の変化がこのような病気を増やしているのだとしたら糖尿病、CKD、心不全、脳卒中、高血圧と言えば腎機能悪化と大きく関わってくるため、聞き流すわけにはいかない。これらの大きな原因は①食事で食物繊維を摂らなくなったから、②抗生物質が投与されて腸内細菌叢が変化したから、あるいは本書の指摘している③免疫系の発育に必要なのは古くから共生していた微生物のコロニー形成の異常 の3つに絞られるのではないだろうか。ヒトの体細胞は37兆個に対し、腸内細菌は重量では1kg程度であろうが、100~1000兆個ある。つまり、アランナ・コリンの「あなたの体は9割が細菌」の書名の意味は腸内細菌叢microbiotaを形成する細菌数が体細胞数の10倍あることを意味している。
腸内細菌叢を健全化すればO157, サルモネラ属菌、カンピロバクターなどの腸菅での細菌感染を防御してくれる。さらにプレバイオティクスである食物繊維をしっかり摂り、プロバイオティクスである発酵食品をしっかり摂取することによって、いわゆる善玉菌を増やして短鎖脂肪酸を産生し、結腸の蠕動運動を促進して大腸がんを防いでいる。男性では直腸がんが多いのに対し、女性では盲腸から下降結腸でも発症しやすいのは善玉菌の減少によっておこる便秘と関係しているからと言われている。がんの死亡率は男性の方が高いのだが、女性では第1位、男性は第3位であり、1975年以降40年で4倍以上に大腸がんは増えている(図3)。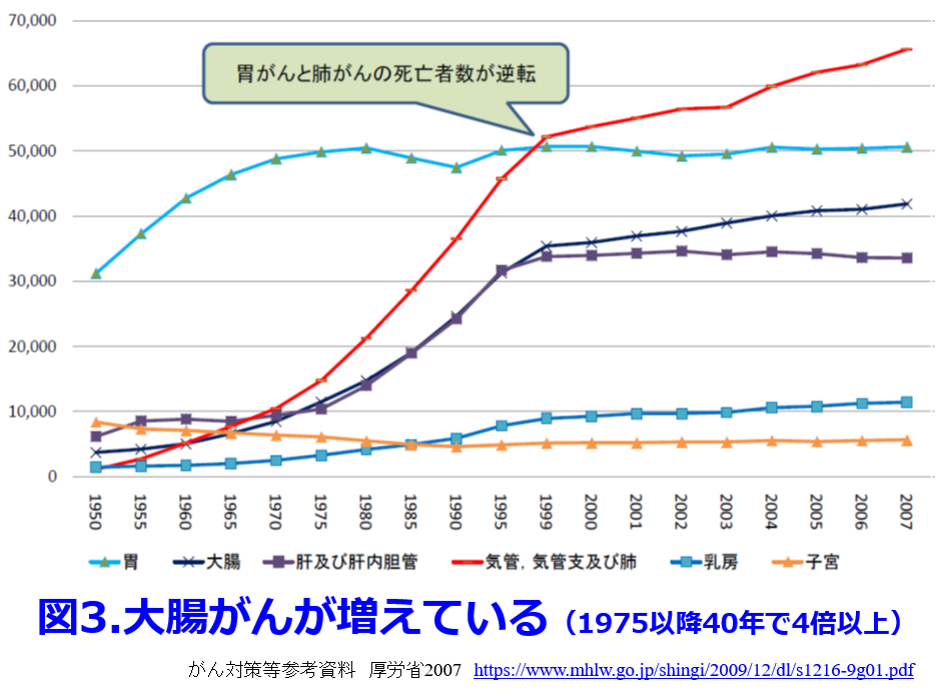 これは食事の欧米化・精製穀物の増加に伴い食物繊維摂取量が低下し腸内腐敗が進行しているためと言われている。
これは食事の欧米化・精製穀物の増加に伴い食物繊維摂取量が低下し腸内腐敗が進行しているためと言われている。
2.吸収率の低い第3世代経口セフェムはこんなにも必要?
そういえば筆者が子供の1960年ころ、大きな感染症にかかった時にはペニシリンGを臀部に筋注してもらっていた。経口抗菌薬があまり使われていなかった時代のことだ。ところが1980年代には様々な抗菌薬が登場した。抗菌薬シリーズの第1回で触れたが、第1世代よりも第2世代、第2世代よりも第3世代抗菌薬の方が薬価が高く定められており、このころはこのシリーズの第7回で述べたように薬価差が病院・製薬会社の利益になるため、製薬メーカーはこぞって第3世代の経口抗菌薬を開発し発売した。そして感染症にかかった小児に対してウイルス性疾患であり、効くはずのない風邪に対しても抗菌薬を投与したのであった。
早めに登場した経口抗菌薬の吸収率は概して高い。もともとβラクタム系抗菌薬は親水性が高いため、消化管の脂質二重層を通過できないはずだが、たまたま立体構造がアラニル-アラニンのようなジペプチド構造に似ていれば小腸上皮細胞に存在するペプチドトランスポータPEPT1の基質として認識されるため吸収される。おそらくペニシリン系のアンピシリン、アモキシシリン、第1世代セフェムのセファレキシン、セファクロルなどがこれらに相当し、これらの吸収率は概して高い(育薬に活用できるデータベース「3.薬効別分類表」にある「13.経口βラクタム系抗菌薬」参照)。そして問題となる第3世代セフェムはピボキシル基などをくっつけて脂溶性を高めて無理やり吸収率を上げさせたものばかりだ(図4)。 そもそも外来などの軽症例であればグラム陽性菌に効果のある第1世代抗菌薬が最も使う頻度が高いはずなのに、なぜこんなにたくさんの第3世代セフェムが必要なのかも理解できない。これらの第3世代セフェム系抗菌薬は吸収率が不明のものや、わかっていてもバイオアベイラビリティが50%以下のものが多い。これは効果が期待できないだけでなく耐性菌の増加に結びづく。吸収されなかった抗菌薬は糞便中に排泄されるが、この前に腸内細菌を殺菌してしまう。グラム陰性菌に強い第3世代セフェムだからグラム陰性菌の大腸菌も死滅するであろう。これによる腸内細菌叢の破壊が大問題なのだ。これらの抗菌薬が効かないクロストリディオイディス・ディフィシル菌Clostridioides difficile(2016年以降Clostridiumから名称変更;ミヤBMの宮入菌はClostridium butyricum のまま)を相対的に増殖させると、Clostridioides difficile腸炎や偽膜性腸炎という重症下痢症のリスクを高めることもあるが、今のところPubMed検索での報告は見当たらない。
そもそも外来などの軽症例であればグラム陽性菌に効果のある第1世代抗菌薬が最も使う頻度が高いはずなのに、なぜこんなにたくさんの第3世代セフェムが必要なのかも理解できない。これらの第3世代セフェム系抗菌薬は吸収率が不明のものや、わかっていてもバイオアベイラビリティが50%以下のものが多い。これは効果が期待できないだけでなく耐性菌の増加に結びづく。吸収されなかった抗菌薬は糞便中に排泄されるが、この前に腸内細菌を殺菌してしまう。グラム陰性菌に強い第3世代セフェムだからグラム陰性菌の大腸菌も死滅するであろう。これによる腸内細菌叢の破壊が大問題なのだ。これらの抗菌薬が効かないクロストリディオイディス・ディフィシル菌Clostridioides difficile(2016年以降Clostridiumから名称変更;ミヤBMの宮入菌はClostridium butyricum のまま)を相対的に増殖させると、Clostridioides difficile腸炎や偽膜性腸炎という重症下痢症のリスクを高めることもあるが、今のところPubMed検索での報告は見当たらない。
もっと大きな懸念は最初に書いたようにウイルス感染の風邪などに対しても、効かない経口抗菌薬を気軽に処方することによって腸内細菌叢が激変することによって今までは起こることのなかったアレルギー性疾患が増えてしまったのではないかということである。これに関しては英国ブリストル大学の報告で2歳までに抗菌薬を投与されていた小児は7.5歳になるまでに喘息(OR1.75: 95%CI 1.40-2.17)を発症する率が有意に高く、2歳までに4回以上投与された場合には、喘息(OR2.82: 95%CI 2.19-3.63)だけでなく湿疹(OR1.41: 95%CI 1.14-1.74)、花粉症(1.60 95%CI 1.21-2.10)などのアレルギー性疾患を発症するオッズ比が有意に高かったことが明らかにされている(表)2)。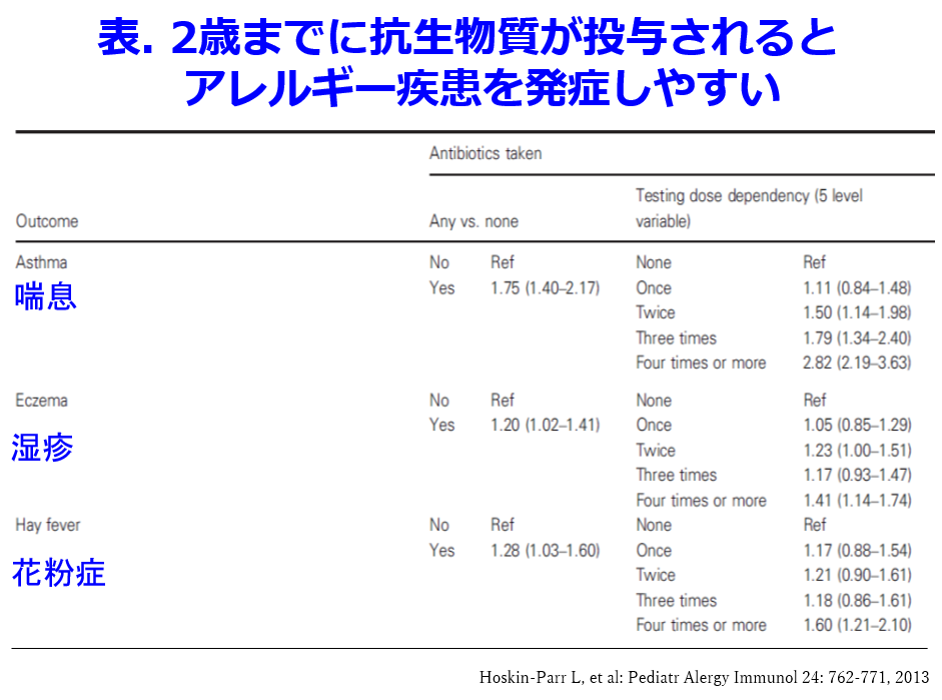 わが国でも2歳までの抗菌薬の使用と5歳におけるアレルギー疾患の有症率との間には有意な関連があり、抗菌薬を使用した群でアレルギー疾患の発症リスクが高くなることを成育医療研究センター内の出生コホートデータを使用した解析で見いだされている3)。ただし小児期の抗菌薬投与はアレルギー疾患と関与しないという報告があるのも事実だ。
わが国でも2歳までの抗菌薬の使用と5歳におけるアレルギー疾患の有症率との間には有意な関連があり、抗菌薬を使用した群でアレルギー疾患の発症リスクが高くなることを成育医療研究センター内の出生コホートデータを使用した解析で見いだされている3)。ただし小児期の抗菌薬投与はアレルギー疾患と関与しないという報告があるのも事実だ。
またピボキシル基を付けて吸収率を上げるが吸収されるセフカペン ピボキシル塩酸塩水和物(フロモックス?)、セフジトレン ピボキシル(メイアクト?)、セフテラム ピボキシル(トミロン?) 、テビペネム ピボキシル(オラペネム?)はくっついているピボキシル基からピバリン酸を生じ、カルニチン抱合されるためカルニチン欠乏によってβ酸化が行われず、もともとカルニチンの貯蔵臓器である筋肉量の少ない小児では糖新生ができないため、低血糖を起こしやすくなることに関しては非常に多くの副作用報告がある4)。これは食事摂取が少ない、あるいは抗菌薬投与期間が長い患児で起こりやすいので気を付けよう。
引用文献
1) Khansari PS, Sperlagh: Inflammopharmacology 20: 103-107, 2112
2) Hoskin-Parr L, et al: Pediatr Alergy Immunol 24: 762-771, 2013
3)Hanada KY, et al: Ann Allergy Asthma Immunol 119: 54-58, 2017
4)ピボキシル基を有する抗菌薬投与による小児等の重篤な低カルニチン血症と低血糖について. 医薬品医療機器総合機構PMDAからの医薬品適正使用のお願い 2012年4月
◆連載◆抗菌薬が効かない多剤耐性菌MRSAが出現した~抗菌薬の耐性化~ 第7回
1.第1世代~第2世代セフェムの時代
筆者が薬剤師になった1977年、第1世代セフェムのセファメジンⓇ(セファゾリン、1971年発売)が飛ぶように売れていた。この当時の外科領域感染症は黄色ブドウ球菌が主だったからグラム陽性球菌に強い第1世代セフェムはよく効いた。そして1gのバイアルが3,000円以上の高薬価であり、仕入れ値は20~30%引きであったため、比較的清潔な手術でも1日3バイアルの予防投与をすると売り上げ10,000円/日、薬価差による純利益2,000~3,000円/日で予防投与として1~3週間、退院まで処方され、多額の利益(薬価差)が病院に入ってきた。
約10年後、グラム陽性菌をターゲットにした第1世代の乱用の影響でグラム陰性桿菌の大腸菌、肺炎桿菌が起炎菌の主役になってくると、グラム陰性菌にも効力を示すパンスポリンⓇ(セフォチアム、1981年発売。パンスポリンⓇが悪いのではなくこの当時、一番売れていたイメージがあるのがこの薬ということです)などの第2世代セフェムが登場し、この薬価が3000円以上になって、セファメジンⓇの薬価は2000円程度に下げられたため、より薬価差の高く儲かる第2世代セフェムを各社比較して、薬価差の大きいものを購入して、どの病院も相変わらず、2週間程度の長期間、予防投与と称して使い、1手術当たり3万円~5万円の利益を得ていた。
2.第3世代セフェムの時代
約5年後、グラム陽性菌には弱いが陰性桿菌に超強力な第3世代セフェムが台頭し、抗菌薬市場は第3世代セフェムの販売競争で荒れに荒れた。セファメジンⓇの薬価は1000円台に、第2世代セフェムは2000円台になったため、製薬メーカー各社とも薬価3000円以上の第3世代セフェムのモダシンⓇ(セフタジジム、1986年発売)、ロセフィンⓇ(セフトリアキソン、1986年発売)など数多くの第3世代セフェムを市場に載せた。中には「第1選択薬として広く使ってください」と緑膿菌に対するMICがその当時で最も低いファースト○○という商品名を付けて、売り込んだメーカーもあった。それを感染症の可能性が決して高くはない結石破砕後の感染予防にルーチン使用を勧めたのには猛反対した覚えがある。
3.院内感染MRSAの出現
 そして1989~1990年、ついに市販の抗菌薬すべてが効かない耐性菌、グラム陽性球菌であるメチシリン耐性黄色ブドウ球菌(MRSA:写真)による院内感染が蔓延し始めたのである。MRSAは抗菌薬が効かない院内感染、つまり入院しなければ罹患しない感染症としてこの当時、大きな社会問題になった。この時、MRSAの特効薬のバンコマイシンは偽膜性大腸炎治療薬としての内服薬(見た目は注射薬と同じバイアル入りで滅菌もされていた)しか認可されておらず、適応を無視して使われた患者には効果を示し、査定を恐れて低感受性の既存抗菌薬が使われた患者は亡くなっていたのではないだろうか。この当時、働き盛りの男性が感染症に罹患し、大学病院に入院して抗菌薬投与を受けたが最終的にMRSAの院内感染症に罹患して亡くなった方の奥様の書いた手記が出版されるなど、現行の抗菌薬が一切効かないMRSA感染症がテレビ、新聞でも取り上げられて大きな話題になった。慌てた政府は1990年アルベカシン注、1991年に塩酸バンコマイシン注をMRSA治療薬として認可した。そして黄色ブドウ球菌中のMRSAの割合が諸外国が10%程度であったのに比し、日本だけが特出して60%と高い耐性化が進行した(図)。「日本でのMRSAの割合はsixty percentだ」と言っても欧米人には「sixteenの間違いじゃないの」と聞き返される始末だった。MRSAの蔓延はおそらくグラム陰性菌にはめっぽう強いが、グラム陽性菌には第1・第2世代セフェムに劣る第3世代セフェムの多用・長期投与によるものと考えられた。
そして1989~1990年、ついに市販の抗菌薬すべてが効かない耐性菌、グラム陽性球菌であるメチシリン耐性黄色ブドウ球菌(MRSA:写真)による院内感染が蔓延し始めたのである。MRSAは抗菌薬が効かない院内感染、つまり入院しなければ罹患しない感染症としてこの当時、大きな社会問題になった。この時、MRSAの特効薬のバンコマイシンは偽膜性大腸炎治療薬としての内服薬(見た目は注射薬と同じバイアル入りで滅菌もされていた)しか認可されておらず、適応を無視して使われた患者には効果を示し、査定を恐れて低感受性の既存抗菌薬が使われた患者は亡くなっていたのではないだろうか。この当時、働き盛りの男性が感染症に罹患し、大学病院に入院して抗菌薬投与を受けたが最終的にMRSAの院内感染症に罹患して亡くなった方の奥様の書いた手記が出版されるなど、現行の抗菌薬が一切効かないMRSA感染症がテレビ、新聞でも取り上げられて大きな話題になった。慌てた政府は1990年アルベカシン注、1991年に塩酸バンコマイシン注をMRSA治療薬として認可した。そして黄色ブドウ球菌中のMRSAの割合が諸外国が10%程度であったのに比し、日本だけが特出して60%と高い耐性化が進行した(図)。「日本でのMRSAの割合はsixty percentだ」と言っても欧米人には「sixteenの間違いじゃないの」と聞き返される始末だった。MRSAの蔓延はおそらくグラム陰性菌にはめっぽう強いが、グラム陽性菌には第1・第2世代セフェムに劣る第3世代セフェムの多用・長期投与によるものと考えられた。
新しく広域であればあるほど薬価が高く、病院に利益をもたらすため、新しい広域セフェムは飛ぶように売れた。感染を起こしていない手術の予防投与にも……。製薬メーカーは第1世代から第4世代まで、より広域のセフェムの開発競争を行い、予防投与にも使用を勧めた。1980年代に一番売れた薬が抗生物質だった。
4.抗菌薬耐性を防ぐために
今は売上ベスト30に入る抗菌薬は全くないので抗菌薬の新薬の開発をやめるメーカーが続出してきていることが問題になっている。この耐性化の説は証明されたものではないが、この当時の専門家が言っていたものをまとめた。このころだったであろうか、WHOが以下の警告を発した。「薬剤耐性の増加により抗菌薬は(新規を含め)その役割を失いつつある。先進国での抗菌薬の無意味な処方量の増加、発展途上国での低用量の処方のいずれもが薬剤耐性菌の増加に関与する。」今回の例は術後感染予防投与と称して1~3週間、広域のセフェム系抗菌薬の「無意味な処方量の増加」だったのであろう。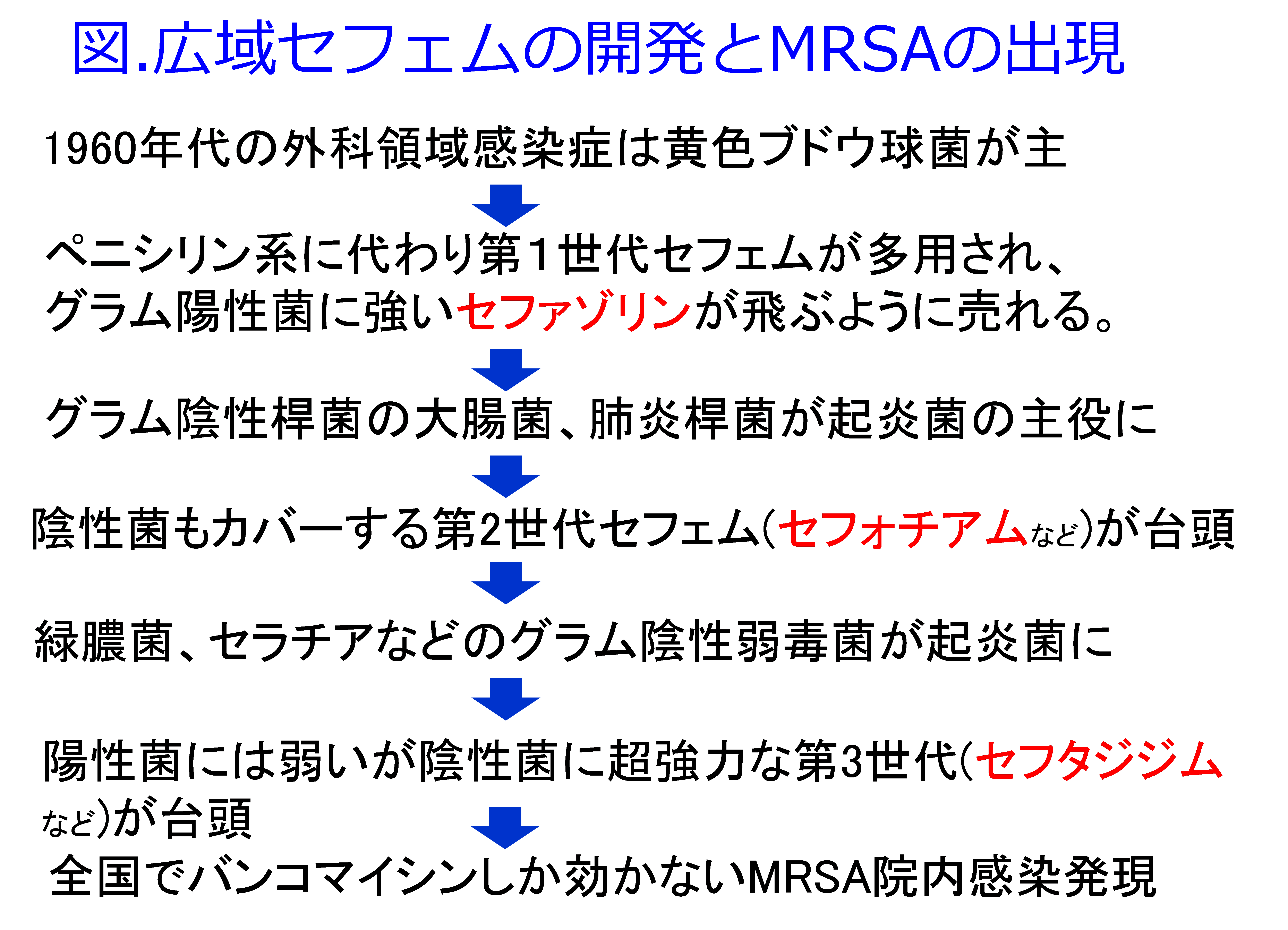 1990年以降も新たに開発されたグラム陰性菌に強い、経口抗菌セフェムは7種類もあるが、皮膚軟部感染症の主役となるグラム陽性球菌に効果的な第1世代セフェムは新規性がなく、高薬価を付けてもらえないせいか、全く現れていない。そして薬価差によって儲かるシステムを変えるため(だけではないが)、医薬分業が推進され、抗菌薬適正使用のために各病院に感染防御チーム(ICT: infection control team)が結成され、院内感染防御対策としてスタンダードプリコーションが普及した。そして術後感染予防の抗菌薬投与の主流派は狭域の経口ペニシリンあるいは経口第1世代セフェムの術前1回投与に代わった。
1990年以降も新たに開発されたグラム陰性菌に強い、経口抗菌セフェムは7種類もあるが、皮膚軟部感染症の主役となるグラム陽性球菌に効果的な第1世代セフェムは新規性がなく、高薬価を付けてもらえないせいか、全く現れていない。そして薬価差によって儲かるシステムを変えるため(だけではないが)、医薬分業が推進され、抗菌薬適正使用のために各病院に感染防御チーム(ICT: infection control team)が結成され、院内感染防御対策としてスタンダードプリコーションが普及した。そして術後感染予防の抗菌薬投与の主流派は狭域の経口ペニシリンあるいは経口第1世代セフェムの術前1回投与に代わった。
このころの私は薬剤師として臨床業務ができず、病院の利益に貢献することにしか生きがいを見いだせなかった薬剤科長であった。誰もが広域で殺菌力の強い抗菌薬が素晴らしいものと信じて疑わず、率先して薬価差を追求していたころの本当に恥ずかしい話だ。
そして世の中はというと1990年代にバンコマイシン耐性腸球菌が出現して2000年リネゾリドが発売された。2010年以降の多剤耐性アシネトバクタ―の出現には2012年になってチゲサイクリンが緊急導入された。2000年以降の多剤耐性緑膿菌の出現に対しては2015年になって製造中止になっていた古い抗菌薬のコリスチンが復活した。これらの緊急導入には日本感染症学会、日本化学療法学会、日本環境感染学会、日本臨床微生物学会の専門4学会の提言によって早期導入が実現した。
5.感染防御チームICTから抗菌薬適正使用支援チームASTの結成へ
MRSAの院内感染の蔓延という反省から院内にICTが結成され、MRSAなどの耐性化や院内感染数の把握は検査部が、カルバペネム系、第4代セフェムのセフェピム(マキシピームⓇ)、超広域ペニシリンのピペラシリン/タゾバクタム(ゾシンⓇ)などの広域スペクトルの抗菌薬の使用状況は薬剤部がまとめ、管理栄養士が栄養状態に関する情報提供するなど、チーム医療が重要な時代に入り、栄養サポートチームNSTも結成されるようになった。
そして抗菌薬がほとんど開発されなくなった今、現行の抗菌薬をいかにして耐性化を防ぐこと、つまり抗菌薬の適正使用が重要な課題となってきて、診療施設内の「抗菌薬の使用制限」と「介入とフィードバック」するプログラム(ASP)を実践するためにAST(Antimicrobial Stewardship team:抗菌薬を正しく使う手助けをするチームでICTは感染防止という予防、ASTは治療に特化)が活動するようになった。

