2021年12月
◆連載◆8日目 再び食事について考えてみよう
SGLT2阻害薬による心腎保護作用と急性腎障害抑制作用~ケトン体って何よ?~
8日目 再び食事について考えてみよう
~再びケトン体について~
(1)ケトン体は有益?有害?
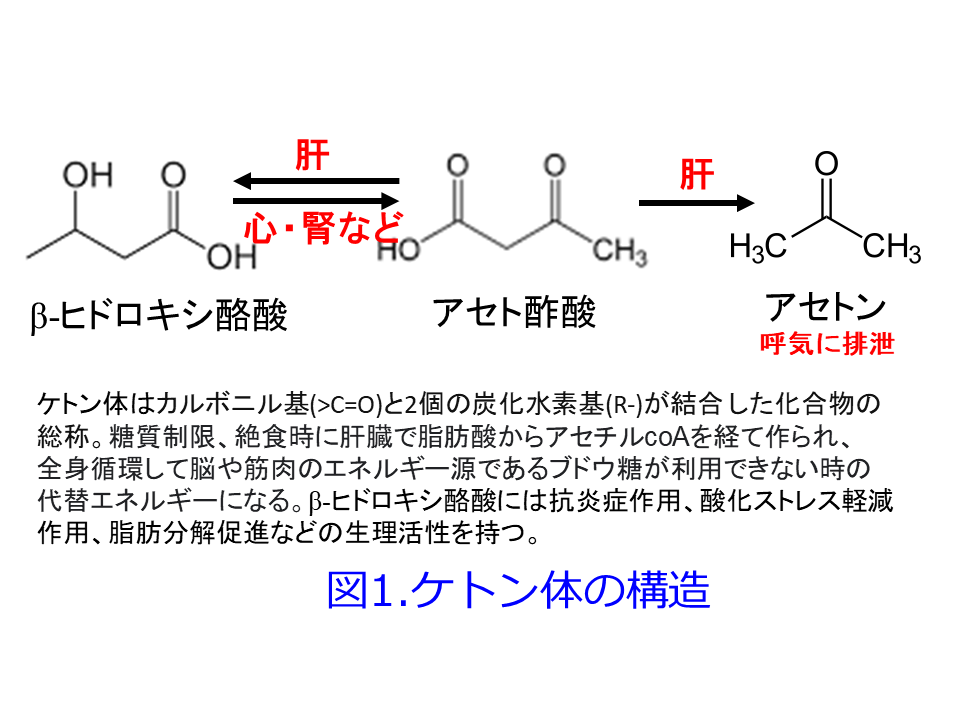
ヒトは24時間エネルギーを消費しているため早朝、8時間もたつと前夜に蓄えた肝臓のグリコーゲンは枯渇してしまいます。このような空腹時でブドウ糖を最も多く消費しているのは脳で、肝臓が10g/hr産生して血中に放出したうち、1時間に5~6g(安静時に全身で使われる60%に相当)のブドウ糖を使います。赤血球には核がないので自分でエネルギーを産生できないからでしょうか、ブドウ糖しかエネルギーとして使えません。そのほかの細胞はブドウ糖を節約して脳に回すため、代謝エネルギーの50~60%を遊離脂肪酸で賄っています。ただし遊離脂肪酸は血液脳関門を通過できないため脳は遊離脂肪酸を使うことができません。ヒトは空腹が続くとインスリン分泌をやめグルカゴンが分泌されることによって血糖値を上げ、さらに脂肪の分解を促進して遊離脂肪酸の代謝を促進し、血液脳関門を通過できる小分子のケトン体にしてブドウ糖の代替エネルギー源にします。したがって飢餓時にはケトン体は脳のエネルギーになります。脳以外の心臓や安静時の骨格筋は遊離脂肪酸を使っていますが、これはブドウ糖を節約して脳に回すためと考えられています。ただし心不全などの心臓病になると、エネルギー源が脂肪酸からケトン体にスイッチされます1)。
(2)SGLT2阻害薬によるケトアシドーシス
インスリン欠乏が高度、かつグルカゴン分泌過多になると脂肪分解に歯止めが効かなくなって多量のケトン体が蓄積するとケトアシドーシスになって、意識障害から死に直面することがあるとされています。SGLT2阻害薬を投与すると大量のブドウ糖が尿中に排泄され、脂肪が分解してケトン体が産生されるため、体脂肪は減少しますが、体重も減少するという低糖質ダイエットをしているのと同じようになるため、サルコペニア患者には使えませんし、副作用としてケトアシドーシスがまれに(1000人に1.3人くらい2)、1000人に2.3人くらい3))起こっています。しかし不適切なインスリン減量や中断や極端な糖質摂取不足、あるいは脱水などによって、酸性物質である血中ケトン体が急増するとケトアシドーシスが発症します。有益とも考えられているケトン体はあまり増加させ過ぎないことも重要です。SGLT2阻害薬によるケトアシドーシスの約1/3が正常血糖ケトアシドーシス(BS<300mg/dLで起こるケトアシドーシス)と言われており、服薬指導時に飲水を励行して嘔気・嘔吐、腹痛、全身倦怠感、息切れ、脱水、意識障害などのケトアシドーシスの兆候を見逃さないことが重要です。
ケトアシドーシスはSGLT2阻害薬が1型糖尿病への適応が承認されたことに伴い、ケトアシドーシスの報告が増加しているそうですし、臨床試験の報告では、 アルコール多飲者、感染症や脱水など、女性、非肥満・やせ(BMI<25)で起こりやすいといわれており4)、そのほかにもインスリン欠乏、インスリンの減量、発熱、ストレスなども言われており、手術は少なくとも3日前にはSGLT2阻害薬を一時中止する必要があります。
(3)緩やかな糖質制限か厳格な糖質制限か
山田悟先生は1食につき糖質を20~40gを1日3回+嗜好品10gまでという緩やかな糖質制限食をロカボと称して、糖尿病患者さんや肥満患者さんに推奨するとともに、全国的なムーブメントも展開しておられます。一方、1日50g以下の糖質とする極端な糖質制限(ケトン産生食)に対してはケトン体が増え、血糖降下薬を服用中の糖尿病患者では低血糖に陥る可能性があるので、推奨はしておりません。最近になってケトン体食という極端な糖質制限食に関する書物が増えていますが、中には平田が読んでも「エビデンスに乏しい」と思うものがほとんどでした。

その中で平田が大変興味深いと思ったのが、厳格な糖質制限食の推進者である産婦人科医の宗田哲男先生の「ケトン体が人類を救う 糖質制限でなぜ健康になるのか」(図4)5)という書物です。宗田先生はMEC食という肉(Meat)、卵(Eggs)、チーズ(Cheese)の3つの食品を中心にたっぷり食べ、30回かむというルールの食事法を推進して、妊娠糖尿病患者を対象に実際にケトン体濃度を測定したデータを学会に発表しています。
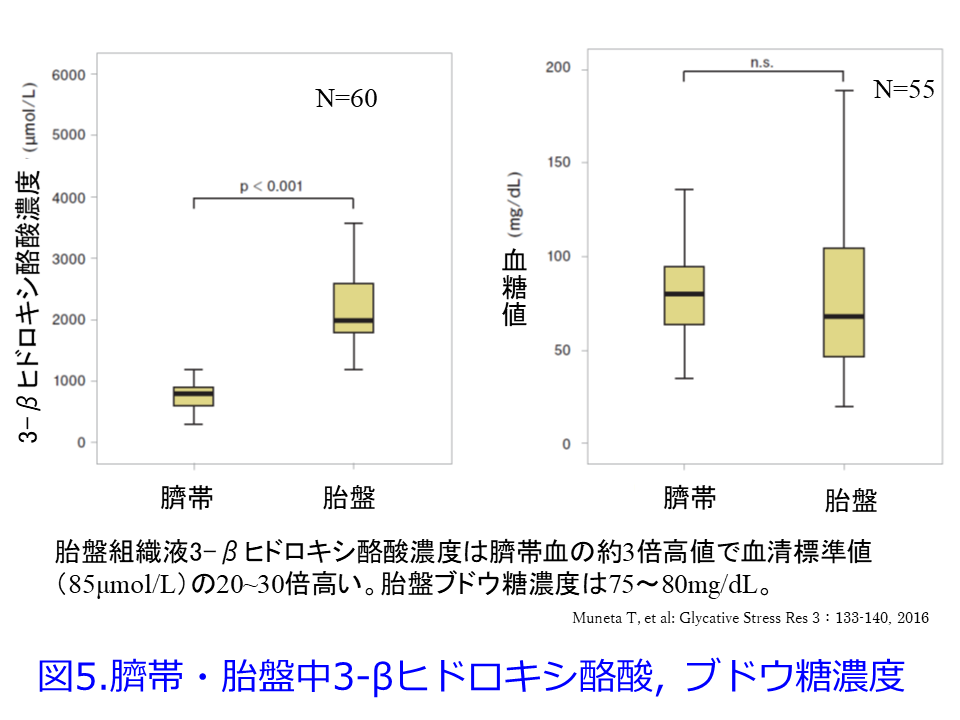
その要点は①「アセト酢酸とβ-ヒドロキシ酪酸は強い酸だからアシドーシスになる」というのは間違い、②厳密な糖質制限食によって血清ケトン体濃度は2,000-7,000µmol/Lになることがあるが、ケトン体は無害だから高濃度になってもなに起こらない、アシドーシスの症状も起こらない、③糖尿病性アシドーシスは必ず高血糖を伴う。つまりインスリンの働きが極端に落ちた人で発症する、④糖質制限をすればケトーシス(血中ケトン体濃度が200µmol/L以上に増加した状態)にはなるが、高血糖を起こさない限り重症のケトアシドーシスにはならない、という内容でケトン体は極めて安全という立場です。そして宗田先生は1型糖尿病のため他病院から見捨てられた妊婦を糖質制限食でインスリン不要にして正常分娩に成功した驚くべき症例を報告しています。さらに正常妊婦60名の血液、胎盤、新生児、妊婦のケトン体濃度を測定して英語論文にしており6)(なぜかPubMedでは検出されないのですがWebで入手可能でした)、血糖値はやや低めで、ケトン体を測定すると胎盤で2,235.0µmol/L、臍帯で779.2µmol/L、4日後の新生児では240.4µmol/L、30日後は366.7µmol/Lと高値であり、胎盤組織液3-βヒドロキシ酪酸濃度は臍帯血の約3倍高値で血清標準値(85μmol/L)の20~30倍高く、胎盤ブドウ糖濃度は75~80mg/dLと低値でした(図5)6)。そのうえでβ-ヒドロキシ酪酸は生後30日までは新生児の栄養として不可欠であると結んでいます。つまり7日目に解説したとおり、ケトン体は毒物ではなく、もともと胎児・新生児の栄養素の主役であると考えられます。胎盤で2,235.0µmol/Lもの高濃度になっていてもアシドーシスは起こしているはずがないのですから、胎児の栄養物が大人にとって毒物というのは確かにナンセンスかもしれません。
ただし平田が2021年11月12日に医中誌で検索したところ、SGLT2阻害薬×症例報告×原著で124件。そのうちケトアシドーシスの報告が13件あり、正常血糖ケトアシドーシスは8件でした。つまり論文になっているSGLT2阻害薬の症例報告124件中13例がケトアシドーシスを発症した症例報告であり、13例中8例が正常血糖ケトアシドーシスだったのです。したがってSGLT2阻害薬が投与されている糖尿病患者が厳密な低糖質食にすると正常血糖ケトアシドーシスを発症した報告が多いため、糖尿病患者でSGLT2阻害薬が投与されている症例には厳密な糖質制限食は危険です。山田悟先生の提唱する緩やかな糖質制限食(ロカボ)にとどめるべきであり、朝食を抜くダイエットもSGLT2阻害薬服用患者には推奨できないように思います。
(4)SGLT2阻害薬による2型糖尿病患者の正常血糖ケトアシドーシス症例を見てみよう
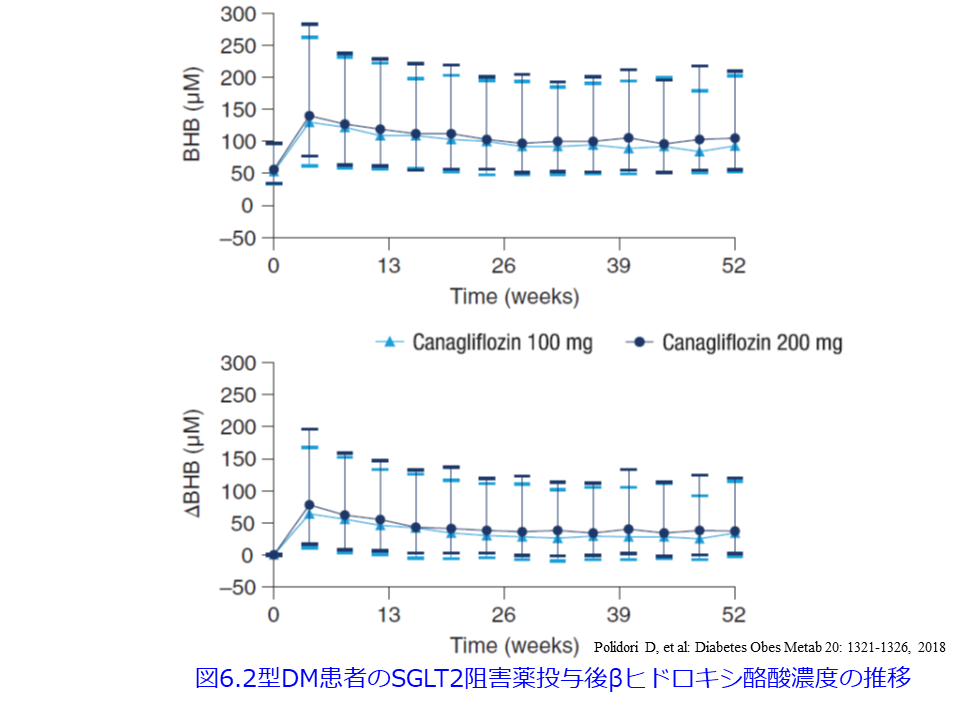
インスリン分泌能を失った1型糖尿病患者ではケトアシドーシスを起こしうると思いますが、2型糖尿病ではいかがなものだろうと思い、PubMedで「SGLT2 inhibitors × 3-Hydroxybutyric acid × type 2 diabetics」で検索すると、カナグリフロジン投与後のβヒドロキシ酪酸濃度は平均100µmol/L足らずで、投与前後の差であるΔβヒドロキシ酪酸濃度濃度は平均100µmol/L足らずでアシドーシスを起こす濃度ではありません(図6)7)。Letter to the EditorではSGLT2阻害薬を投与して2.8mg/dL(269µmol/L)を超えるβヒドロキシ酪酸濃度が14%の患者に認められたがアシドーシスは起こらないという報告がありました8)が、これは前述の宗田先生のご指摘の通りで1000µmol/L程度のケトン体濃度ではアシドーシスは起こっていないということが再確認できました。
カナグリフロジン服用中の71歳の女性が食欲不振、倦怠感、悪心および腹痛を訴えて救急搬送され、血糖値259mg/dLとさほど高くないものの、pH 6.89でβヒドロキシ酪酸濃度10,000µmol/Lを超える重篤な正常血糖糖尿病性ケトアシドーシスを発症し、3日間の持続的血液浄化法の後改善したという久留米大学病院の報告がありました9)。この報告で興味深かったのは尿糖はSGLT2阻害薬中止後10日以上持続し多尿・尿糖の管理のために乳酸リンゲル液の輸液が必要であったことです。カナグリフロジンはUGTによりグルクロン酸抱合されるため、本症例にはUGTの欠損があったのかもしれないことを考察していますが、患者の遺伝子検査はされていません。
2型糖尿病による正常血糖ケトアシドーシスについてはイタリアでもエンパグリフロジン20mg/日での報告があり10)、高カリウム血症、血圧低下、頻脈、呼吸数増大、多尿、尿中ケトン体7,692mmol/L、および血液ガスはpH6.91で重篤なアシドーシス、意識障害、腎機能悪化(2週間前に投与されたNSAIDによると考察)が認められておりますが、尿糖の遷延はこの症例も同様でSGLT2阻害薬が中止されて7日後も2,700mg/dLでした。またこの症例も重炭酸を用いた血液透析を2日間連続実施後、症状が改善しています。この尿糖の遷延や多尿や尿中ケトン体検出が持続することはわが国の正常血糖アシドーシスの報告でも散見されており、単なる偶然とは思われません。単にSGLT2阻害薬が不可逆的にSGLT2を阻害し、SGLT2のターンオーバーが長いためという理由ではなさそうです。
カナグリフロジン、エンパグリフロジンの消失半減期は各々10~12時間、7.4~18時間なので、血中濃度は遅くとも中止後4日でほぼ3%近くに低下するはずなのですが、7日あるいは10日以上、効果が持続するのはやはり不可思議であり、UGTの遺伝子多型が関わっているなど疑問が残ります。ひょっとしたらSGLT2服用患者で1000人に1~2人しか発症しないケトアシドーシスのうち、正常血糖アシドーシスはSGLT2阻害薬を代謝する酵素のUGT、あるいは何らかの機能性タンパクの遺伝子多型や人種差が考えられるかもしれません。前述の山田悟先生はMedical Tribuneの Doctor‘s Eye 2021年4月13日「ケトン体は味方だった!」で肝臓はSCOT(サクシニルCoA/オキソ酸CoAトランスフェラーゼ)という酵素を持たないため、ケトン体を利用できないので、SGLT2阻害薬によってケトアシドーシスになるのは末梢組織におけるSCOTあるいはミトコンドリア2の遺伝子欠損者ではないか、という仮説を考えているそうです。この症例報告の考察では正常血糖アシドーシスの特徴が書かれていましたので、表1に示しますが過剰のアルコール摂取やカロリー摂取の低下は正常血糖ケトアシドーシスのリスク原因になります。

(5)SGLT2阻害薬によるケトアシドーシスを防ぐために
SGLT2阻害薬服用者には厳密な糖質制限食を避け、食欲不振・嘔気・嘔吐、脱水などでは、シックデイ対策としてSGLT2阻害薬の服用を一時中止して来院するよう服薬指導する必要があります。SGLT2阻害薬の適正使用のRecommendations11)では、手術時には術前3日前から休薬し、食事が十分摂取できるようになってから再開するということになっています。術直前の中止は避けるべきであり、尿糖を測定しながらの栄養管理が必要じゃないかと思いました。やはり2型糖尿病であっても、そして血糖値がさほど高くなくても糖尿病性ケトアシドーシスは起こりえますので、全身倦怠・悪心嘔吐・腹痛などのケトアシドーシスの症状をしっかりと指導する必要があります。
「SGLT2 inhibitor×acute kidney injury×case report」で検索するとAKI症例がヒットすると思ってPubMed検索しましたが、ヒットした10論文中、5論文はケトアシドーシスの症例で、ケトアシドーシスによる脱水による腎機能悪化ではないかと思います。その他はSGLT2阻害薬による間質性腎炎、コカインを併用した症例、症例報告ではない後ろ向き研究などであり、SGLT2阻害薬による純粋なAKIは非常に少ないのではないか、ほとんどがケトアシドーシスによる脱水によるAKIではないかと感じました。
非糖尿病のCKD患者にSGLT2阻害薬を投与してケトアシドーシスを起こした症例やケトン体濃度を測定した報告は今のところ見当たりません。インスリンの働きが正常で、ブドウ糖の利用が適切である限り、ある一定濃度のケトン体は極めて安全なエネルギー源となるため、非糖尿病のCKD患者にSGLT2阻害薬を投与してもケトアシドーシスになることは極めてまれ、あるいは糖尿病では起こらないのではないかと思います。最近の海外の論文の傾向を見ているとケトン体は有害→ケトン体は危険だが有用な面もある→ケトン体は有用なだけで危険性は低いので、極端な糖質制限食も容認できるのでは?というように変わりつつあると感じています。ただしSGLT2阻害薬服用者で極端な糖質制限食をすると、インスリン分泌能が低下した(つまり糖尿病)患者では、非常にまれではありますが、重篤な正常血糖ケトアシドーシスを起こす危険性が高くなると思います。
(6)カロリー制限食・米飯には利点もある?~理想的な食事には食物繊維も重要~
日本糖尿病学会は、炭水化物を50~60%エネルギー、たんぱく質 20%エネルギー以下を目安とし、残りを 脂質とするカロリー制限食を「糖尿病診療ガイドライン2019」が出るまではずっと推奨しており、「日本人は古くから白米を主食とした食事を主流に糖質をエネルギーとして活用してきた。そして糖質は脳や赤血球のエネルギー源となる重要な栄養素だから、糖質は身体に良くないという考え方自体が間違っている」という考え方がつい最近まで日本糖尿病学会の主流でした。今でもカロリー制限食を支持する意見は根強いようです。
戦前の日本人は米食中心で、昭和初期には1日3合と現在の3倍以上のご飯を食べていましたが、戦後の高度成長期あたりから米を食べる量が少なくなり、食事の欧米化が進行していきました。それによって肥満、糖尿病、脂質異常症、糖尿病などの生活習慣病が増えてきたのは事実です。食事の欧米化=カロリー摂取の過剰、脂質の過剰摂取と信じられてきたのです。
厳格な低糖質食でMEC食は糖尿病や肥満患者には適しているかもしれませんが、7日目に触れたように、食物繊維不足による腸内細菌叢の多様性が失われて、大腸がんやアレルギー性疾患、自己免疫疾患などの様々な病気の原因になる可能性もあります。フルーツもポテトもカボチャもダメでたまにはケーキやクッキー、アイスクリームだって食べたいものです。糖尿病や肥満患者だけではなく育ち盛りの子供や妊婦、栄養状態の不良な高齢者など多様な人々にとって理想的な食事って何なのでしょうか?
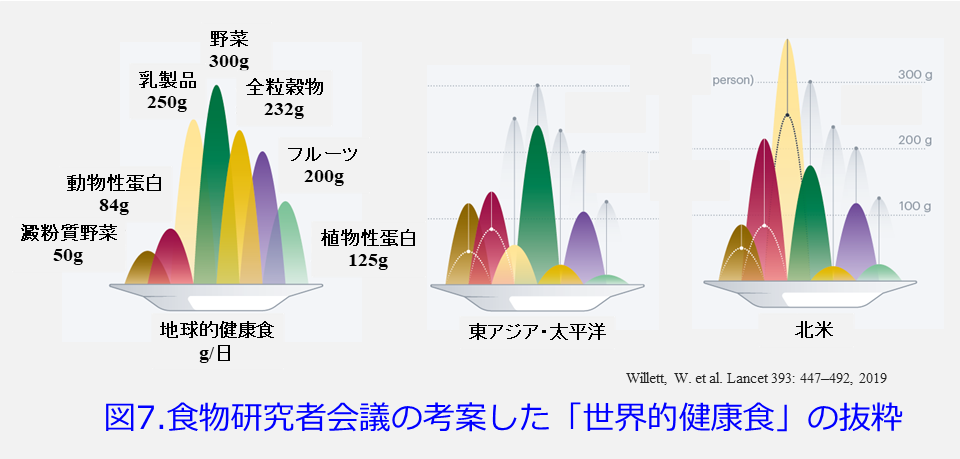
図7に食物研究者会議の考案した「世界的な健康食」12)を抜粋します。北米では澱粉質野菜(ジャガイモなど)、動物性蛋白、乳製品が摂取過多で野菜、全粒穀物、フルーツ、食物性蛋白は不足しており完全に肉食タイプで、3大栄養素はすべて過多で圧倒的に食物繊維不足だと思われます。日本・中国・韓国などの東アジアやオセアニアでは澱粉質野菜、動物性蛋白が摂取過多で乳製品、全粒穀物、フルーツ、食物性蛋白は不足、野菜はやや不足しており、野菜少なめの低カロリー食に近いという感じです。ヨーロッパはこの中間で、サハラ砂漠以南のアフリカでは澱粉質野菜が摂取過多でその他はすべて不足という深刻な栄養不良状態です。平田はいわゆる健康食は緩やかな低糖質食+適度なフルーツ、全粒粉穀物の摂取、つまり緩やかな低糖質食+食物繊維に近いと思っています。では我々の食事で不足気味な食物繊維はどのような役割を果たしているのでしょうか?
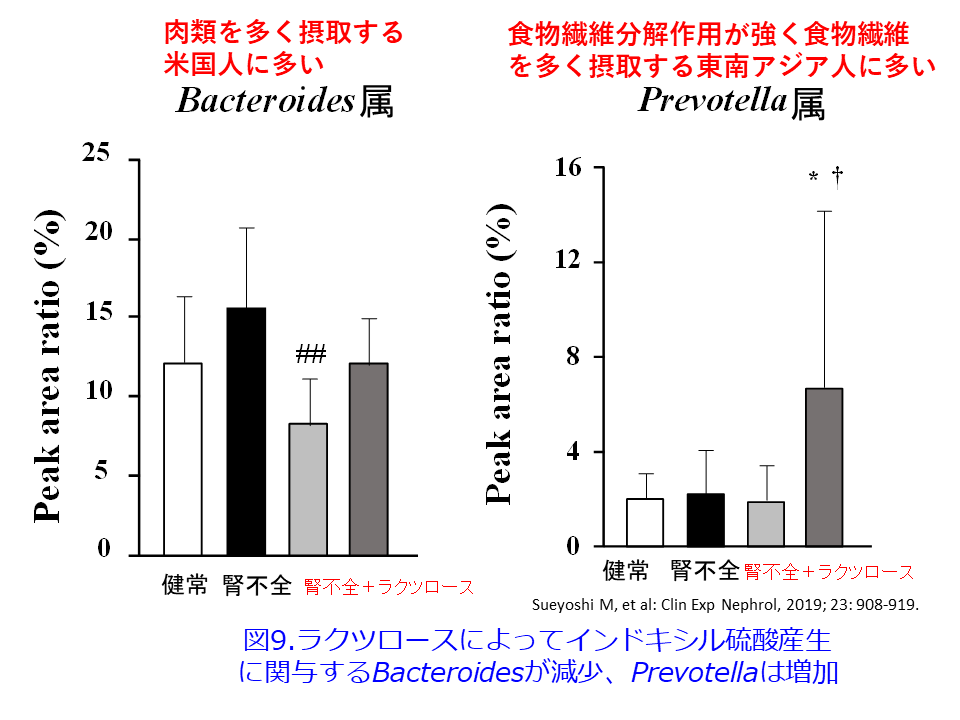
現在でも米食中心の東南アジアやアフリカ・中南米の一部、欧米のベジタリアンや地中海食は高食物繊維食を摂っています。Natureに報告された論文によると13)、これらの高食物繊維食を摂取する人々の腸内細菌叢は食物繊維分解作用が強いPrevotella属が主流を占めており2型に分類され、現在の日本人やスエーデン人は動物性蛋白質・脂肪が多くRuminococcus属が主流で3型に分類され、脂質や糖質をため込み糖尿病・心筋梗塞のリスクになるとされています。そして中国人・米国人は低炭水化物・高蛋白食でBacteroides属が主流で1型になっています。Bacteroides属は尿毒素のインドキシル硫酸産生に関与しており、下剤でプレバイオティクス(ビフィズス菌など短鎖脂肪酸を産生する腸内細菌プロバイオティクスのエサで食物繊維もプレバイオティクス)として作用するラクツロースを用いた我々の検討14)では、アデニン腎不全モデルマウスにラクツロースを投与するとインドキシル硫酸やp-クレジル硫酸濃度の低下とともに、腎機能悪化が抑制されました。さらに腎不全モデルマウスのTGF-βのmRNA発現がラクツロースの投与量依存的に低下し、腎線維化が抑制されました(図8)14)。興味深いことにラクツロース投与によってBacteroidesが減少、Prevotellaは増加したのです(図9)14)。ラオスなどの東南アジアの住民は、米国住民よりも腸内細菌叢の構成が多様で、腸管内に有益な微生物が多く存在しますが、これらの人々が米国に移住すると、速やかに腸内細菌叢が変化し肥満や慢性疾患のリスクが高まるといわれています15)。Prevotella が多いタイプには認知症患者がいない16)など、興味深い報告が増えつつありますが、腸内細菌叢についてはまだまだ不明な点が多いのが現状です。どの菌がよい、悪いではなくバランスの良い食事によって多様な腸内細菌叢を作ることが、便秘や大腸がんを減らし、免疫系の暴発による自己免疫疾患やアレルギー性疾患を防ぎ、健康、長寿に寄与すると思っています。◆連載◆共生生物としての腸内細菌の役割 ~腸内細菌叢とTregの話~ 第12回 後編を参照。

引用文献
1) Murashige D, et al: Science 370: 364-368, 2020
2) Ueda P, et al: BMJ 2018; Nov 14;363:k4365. doi: 10.1136/bmj.k4365
3) Qui M, et al: Diab Vasc Res Mar-Apr 2021;18(2):doi: 10.1177/14791641211011016.
4) 日本糖尿病学会: SGLT2阻害薬の適正使用のRecommendations 2020年12月25日.
5) 宗田哲男: ケトン体が人類を救う 糖質制限でなぜ健康になるのか. 光文社, 2015
6) Muneta T, et al: Glycative Stress Res 3:133-140, 2016
7) Polidori D, et al: Diabetes Obes Metab 20: 1321-1326, 2018
8) Thapa SS, et al: J Fomos Med Assoc 118: 1473, 1474, 2019
9) Fukuda M, et al: Int J Emerg Med . 2020 Jan 22;13(1):2.doi: 10.1186/s12245-020-0261-8.
10) Nappi F, et al: Medicina . 2019 Aug 10;55(8):462.doi: 10.3390/medicina55080462.
11) 日本糖尿病学会: SGLT2阻害薬の適正使用のRecommendations 2020年12月25日.
12) Willett, W. et al. Lancet 393: 447?492, 2019
13) Arumugan M, et al: Nature 473:174-180, 2011
14) Sueyoshi M, et al: Clin Exp Nephrol 23: 908-919, 2019
15) Vangay P, et al: Cell 175: 962-972, 2018
16) Saji N, et al: Sci Rep 2019; 9(1):1008. doi: 10.1038/s41598-018-38218-7
◆連載◆7日目 食事について考えてみよう
SGLT2阻害薬による心腎保護作用と急性腎障害抑制作用~ケトン体って何よ?~
7日目 食事について考えてみよう ~糖質制限食の重要性~
(1)糖質制限食の重要性
日本糖尿病学会では国際的に認められ、エビデンスの高い糖質制限食ではなく、炭水化物を50~60%含むカロリー制限食を「糖尿病診療ガイドライン2019」以前はずっと推奨してきましたが、そろそろ見直す時期に来ていると思います。平田もこの説を長期間、信じていました。アメリカ人に肥満が多いのは脂っこいものばかり食べるから、カロリー摂取量が多いからだと思っていましたが、実は肥満の原因は糖質の摂りすぎと食べ過ぎだったのです。そういえばアメリカのケーキ、アップルパイなど日本人の僕には甘すぎて食べられないくらい甘かったし、マクドナルドのコークのLサイズは1300mLのようにバケツ並み、レストランで食べるパスタの量も食べきれないくらいの大盛でした。
マラソン大会の直前にはつらいカロリー制限(熊本のころ講演会後の飲み会でも刺身も食べずに刺身のツマの大根ばかり食べていたのを思い出します)をして、63kgに減量し、それが終わると普通に食べるだけで、直ちにお腹が出て67kgに戻るという繰り返しをしましたが、David A Sinclair博士の「ライフスパン 老いなき世界」を読んでから「16:8ダイエット」という16時間何も食べないが、食事量は減らさない「辛くなくリバウンドしないダイエット(具体的には夕食を20時に食べると16時間後の翌日12時までナッツ[糖質を含まないもので、ピーナッツはNG]以外は食べない)」+緩めの低糖質食で常に62kgの体重を維持しています。
基本的に低糖質であれば満腹になるほど食べても、カロリー過多であっても太らないのです。そして糖質摂取量が少なければ少ないほど体脂肪は減少し、それに伴って体重が減少するのです。現在ではコンビニに行っても食品のカロリー数ではなく炭水化物量(糖質量)を気にするようになりました。ただし「16:8ダイエット」は糖尿病患者やフレイル気味の高齢者、成長期の小児には勧められません。平田は若年者ではありませんが、今のところ毎日ジムに通うくらい健康なのでやっています。  67歳にして平田は6年連続フルマラソンを完走でき、「脱いでも凄い(人前で脱ぐことはありませんが)」体型を手に入れることができたのです。
67歳にして平田は6年連続フルマラソンを完走でき、「脱いでも凄い(人前で脱ぐことはありませんが)」体型を手に入れることができたのです。
医療者である薬剤師であれば患者さんから食事の質問を受けることがあると思いますが、北里大学北里研究所病院の内分泌・代謝内科部長であり糖尿病センター長の山田悟先生の著した「糖質制限の真実(図1)」1)または「カロリー制限の大罪」2)、いずれも新書の文庫本ですから1,000円もしません。真実を伝えるためにはこれらのエビデンスを重視した著書を読んでいただければと思います。
(2)カロリー、脂質は気にしないでいいんだ!
これらの本で学んだことは、いまだに推奨されている「カロリー制限食」による心臓病発症率が低下するエビデンスはなく、骨密度が低下することが明らかになっています。カロリー制限食は1gで9kcalあって、糖質や蛋白質よりもカロリーの高い脂質を制限するのが最も効果的と思われがちですが、脂質制限をしても痩せないし、血清脂質濃度もコレステロールも下がらないので、脂質異常症も改善せず、動脈硬化や心筋梗塞を予防できません。有酸素運動をしてもコレステロールはエネルギー源ではない(胆汁酸やステロイドの成分として必要なだけ)ので下がりません。LDLが高すぎればスタチン薬を服用するしかありません。逆に動物性脂肪の摂取は脳卒中リスクを減らし、動脈硬化を予防できるので、脂質を制限する必要はありません。コレステロールを多く含む卵黄などを制限してもコレステロールは下がりません(一時的に下がったとしても元に戻る)。平田の検査値異常はLDL高値だけだったので、長期間、卵を食べるのをやめていましたが、これは全くの無駄でした。
1984年には米国の著名な一般誌「TIME」は「コレステロールに関する悪いニュース」で「食物中のコレステロール、血清コレステロールと心臓病の関係という試験からコレステロールは死をもたらす」と飽和脂肪酸が心臓病の原因になると警告を鳴らしました。このような間違った知識によって数十年、脂質は怖いというイメージがついてしまったのです。しかし実際には脂質の摂取よりも重要なのは、CRPなどの炎症マーカーの方が総コレステロール値や心臓病と密接に関連していたのです。何十年にもわたる低脂肪食(低カロリー食)は、肥満、糖尿病、心臓病の発生率の上昇と一致しています。「バターは何十年もの間、それはアメリカの食事療法の中で最も邪悪な栄養素でした。しかし、新しい科学は、脂肪が私たちの健康を害するものではないことを明らかにしています。脂肪を減らすことが、病気の発生率の上昇にどのように寄与するのでしょうか? 人々は実際に非常に高炭水化物の食事に切り替え、そしてそれらの炭水化物は肥満、糖尿病に関しては飽和脂肪よりもはるかに悪いように見えることがわかりました。」ということでTIME誌は謝罪の意味も込めて、30年後の2014年に「バターを食べろ!」という特集を組んで、それまでの脂質に対する否定的な考えから30年間にもわたって「低脂肪/高炭水化物(カロリー制限食)」を推奨してきたことを謝罪しています(図2)。ただし、単にバターを食べることがいいと推奨しているのではなく、「ファストフード、加工食品を減らすことが重要で、脂肪の摂取量はこれから気にしなくていい」というメッセージが込められています。

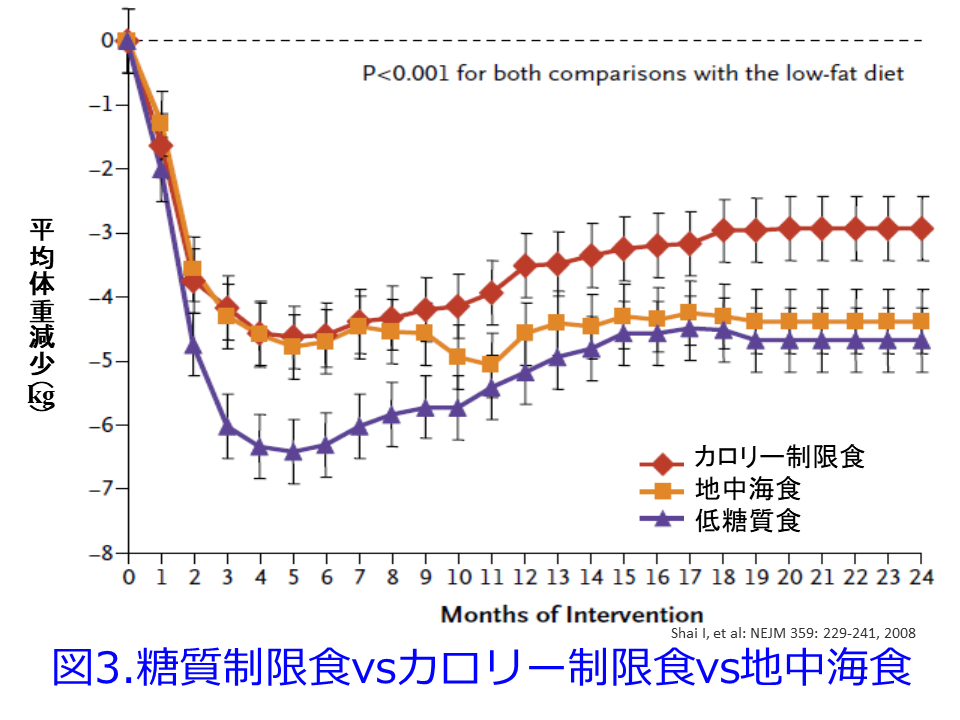
脂質は悪くなかったのです。αリノレン酸、エイコサペンタエン酸、ドコサヘキサエン酸などのω-3多価不飽和脂肪酸、あるいは一価不飽和脂肪酸のオリブ油が、心臓病のリスクを軽減することはよく知られていますが、栄養素としては飽和脂肪酸も悪くなかったのです。米国ではすでに脂質摂取量の上限が撤廃されており、脂質を多く摂取するとカロリー摂取量は増えても、脂肪組織の中性脂肪が分解されて脂肪酸が使われるため、脂質代謝が亢進して肥満が解消されるのです。悪いのは血糖値を上げる糖質だったのです。厳格な糖質制限食(炭水化物は20g/日でカロリー、たんぱく質、脂質制限なしだが動物性は避ける)vs低脂肪食群(カロリー制限食で男性1800、女性1500kcal/日でカロリーの30%が脂肪)vs健康に良いとされる地中海食(低脂肪食と同じカロリー制限症で脂質は35%以下で30~35gのオリーブオイルと5~7個のナッツを含む)の体重変化を検討したRCTであるDIRECT試験の報告3)では体重減少は平均で,低脂肪食群で 2.9 kg,地中海食群で 4.4 kg,糖質制限群で 4.7 kg でした(図3)。ただし完遂率は糖質制限食が78%で最低で低脂肪食で90.4%、地中海食で85.3% だったことは、厳格な糖質制限食はこの研究ではなかなか楽にはできなかったのかもしれません。これは炭水化物は20g/日という極端な糖質制限だったからだと思われます。
山田悟先生は緩やかな糖質制限、つまり「糖質摂取量1食40グラム以内、1日130グラム以内のロカボ」を推奨しています。ちなみにライザップの食事は厳格な糖質制限食+高たんぱく食だそうで、糖質を制限することで効率よく体脂肪を減らす作戦です。健康を保つための食事やダイエット本の中には根拠のない嘘で固められたものが多くありますので気をつけてください。たとえば下記のような記載はすべてウソです!
コンビニ食品はすべてダメいうのはウソです。アスパルテーム、スクラロースなどの人工甘味料(摂取制限はある)、糖アルコールのエリスリトールなどのカロリーにならない甘味料もダメというのはウソです。蕎麦はカロリーが低いが糖質そのものですし、果物もブドウ糖や果糖(もっとも太りやすい)が多いもの(ブドウ、リンゴなど)、ショ糖の多いもの(バナナ、パイナップルなど)の摂りすぎはよくありません。果物の中ではイチゴやブルーベリー、ラズベリーなどのベリー類は食物繊維が豊富で低糖質なのでおすすめです。そういう意味では果物は良いが、フルーツジュースはダメというのも食物繊維の有無による差、リンゴやブドウの皮に含まれる抗酸化物質アントシアニンなどの差はありますが、果物の糖質量はジュースと丸ごとの果物に差があるわけではありません。玄米は良いが白米はダメいうのは微妙です。玄米には確かに食物繊維が含まれているので腸内細菌叢などに好影響を与え、総死亡率、がん、心疾患、脳血管疾患、糖尿病などのリスクが低下する報告が多いのですが、糖質量としては白米とほぼ同じです。同様に全粒粉パンは白パンよりは健康によいのでしょうが、糖質量が劇的に減っているわけではありません。
カボチャやジャガイモに糖質が多いのはよく知られていますが、ニンジンや玉ねぎなどほのかな甘みのある野菜にも糖質を含んでいるようです。アボカドはカロリーは高いですが糖質を含みませんし、ブロッコリーやカリフラワーも糖質を含みません。砂糖を吸収されない甘味料のエリスリトール、スクラロースに変更するだけでも「甘いもの」を減らすことなく糖質を減らすことは可能です。
ちなみに平田は厳格な糖質制限食は糖尿病、肥満患者にはいいかもしれませんが、赤肉やソーセージやハム、ベーコンなどの加工食品を増やすのは「がん」予防の観点からは良くないですし、腸内細菌叢を健全に保つ(これもがんだけでなく免疫系の暴発によるアレルギー性疾患や自己免疫疾患を防ぐことができると思われます:わかりやすい細菌と抗菌薬の話の第8回 吸収率の低い第3世代経口セフェムってこんなに必要?を参照)には多少は糖質を含んでいてもいいから、食物繊維の豊富な野菜をもっと摂るべきだと思います。ヨーグルト、納豆などの発酵食品も積極的に摂りたいと考えています。そして食事を楽しむためには、たまには羽目を外して、甘いものも取りすぎにならない程度に摂ってもいいと考えています。
引用文献
1)山田悟: 糖質制限の真実日本人を救う革命的食事法ロカボのすべて. 幻冬舎新書, 2015
2)山田悟: カロリー制限の大罪. 幻冬舎新書, 2017
3)Shai I, et al: N Engl J Med 359: 229-241, 2008
SGLT2阻害薬による心腎保護作用と急性腎障害抑制作用~ケトン体って何よ?~
6日目 人類の歴史のほとんどでエネルギー産生の主役は ブドウ糖ではなくケトン体だった?
(1)人類はケトン体を主要エネルギーとしていたかもしれない
200万年前にホモ属が誕生し、20万年前に東アフリカでサピエンスが誕生しましたが、人類は長期間、ずっと狩猟採集生活、つまり主な食物は狩りで得た肉類と木の実(ナッツ)、つまり低糖質食(ケトジェニック食)でしたので、長期間、ケトン体がエネルギー産生の主役だったと考えられます(図1)。低糖質食の摂取によって肝臓で脂肪がβ酸化によってアセチル-CoAになってβ-ヒドロキシ酪酸、アセト酢酸、アセトンなどのケトン体となって血流に乗って各臓器で効率の良いエネルギーとして消費されていたのです(図2)。体脂肪は現代人では体重の10~20%ありますが、インスリンの働きによって増えますので、果物や獲物が見つかった時には食べるだけ食べて、飢餓に備えて太る必要があったのではないでしょうか?女性で10kgの体脂肪があると90,000kcalで、1日1500kcal必要とすると60日分になるので、飢餓状態においては脂質が生体・細胞維持に必須であるATPの重要な産生源になっていたはずです。食物が安定して獲れなくても女性は妊娠・出産のために皮下脂肪を蓄える必要があったのだと考えると女性で皮下脂肪がつきやすいことが納得できます。
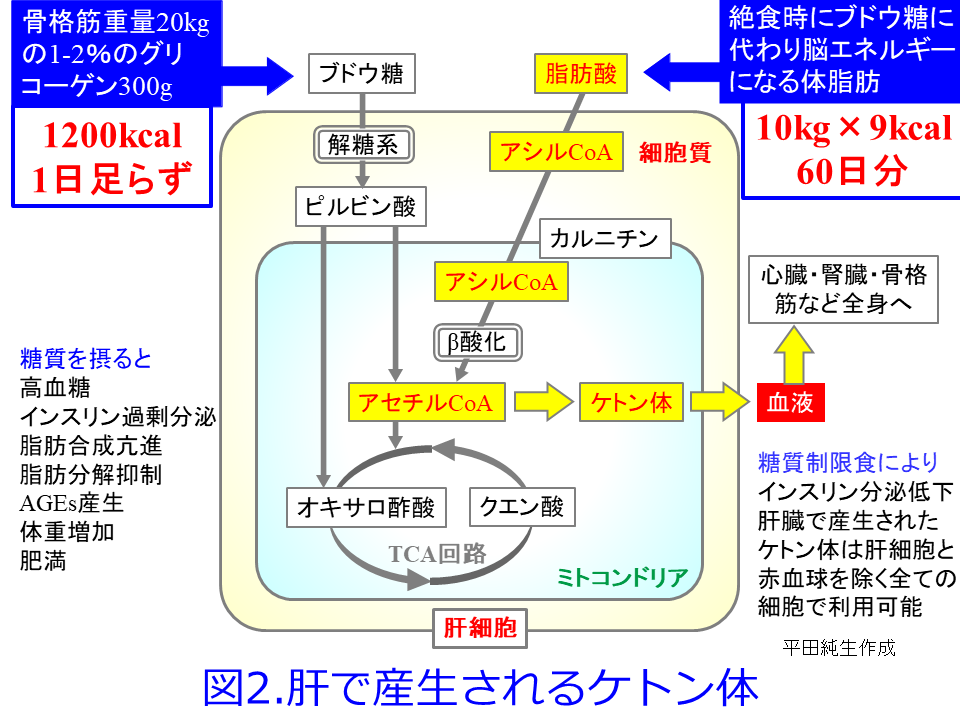
最後の氷河期が終わって、5,000年前(イスラエルの歴史家で哲学者でもあるユヴァル・ノア・ハラリ氏による「サピエンス全史」によると12,000年前に農業革命が起こったとしています)の新石器時代になって農耕・牧畜が始まり、糖質である穀物を主食にしはじめ、ブドウ糖がエネルギー源になったと考えられますが(図3)、糖質のグリコーゲンは大人でもせいぜい300g程度しか蓄えられず、1日で枯渇してしまいます。人類が農耕をはじめてからも天災や干ばつによる飢饉で、食事量は十分ではなかったはずですから、やはり糖質中心の食生活になってもケトン体は必要なのだと思われます。さらに18世紀末に起った産業革命によって、穀物の生産量が飛躍的に向上して、摂食カロリーが増加し始めました。玄米・全粒粉パンから白米・白パンなどの精製穀物となって糖質過多で飽食の時代、2型糖尿病や肥満が富裕層だけではなく、ファストフードや清涼飲料水、菓子など発展途上国でも、最も安上がりなカロリー源の炭水化物が主食になったのは数十年前の極めて最近のことではないでしょうか。
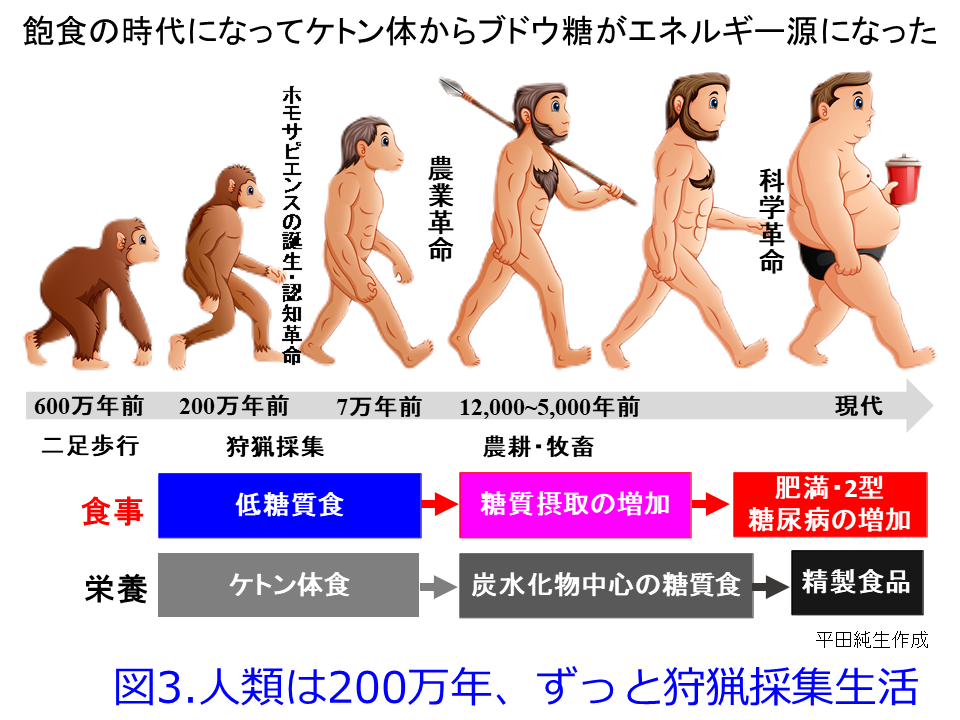
つまり人類の歴史の99%以上が低糖質食で、1%足らずが現在の高糖質食だったと考えると、糖質よりもケトン体を利用する方が都合がよいようにヒトの体ができていると考えることもできます。前述の「サピエンス全史」でも人間は農耕によって人口は増えてサピエンスという種を守ることはできたものの、もともと狩猟に適した体型をしており、農耕に向いた遺伝子を持っていなかったから、腰痛に悩まされ、栄養状態も悪く様々な病気に悩まされたはずと指摘しています。DNAは糖質制限食向きに作られていたのです。ただし現在でも、摂食不良や激しい運動時や糖質制限食を摂取すれば、体内のブドウ糖が枯渇する状態となった時に、ブドウ糖に代わるエネルギー源として脂肪からケトン体が肝臓で産生されます。通常時の心筋は脂肪酸を60-70%、ブドウ糖を30%エネルギーとして使用しており、糖質摂取が少なければ脂肪酸から産生されるケトン体も代替エネルギーになり、脂肪酸のβ酸化を介した、エネルギー効率が高いケトン体を利用するのが高いエネルギーを必要とする心臓にとっては都合がいいのだと思われます。
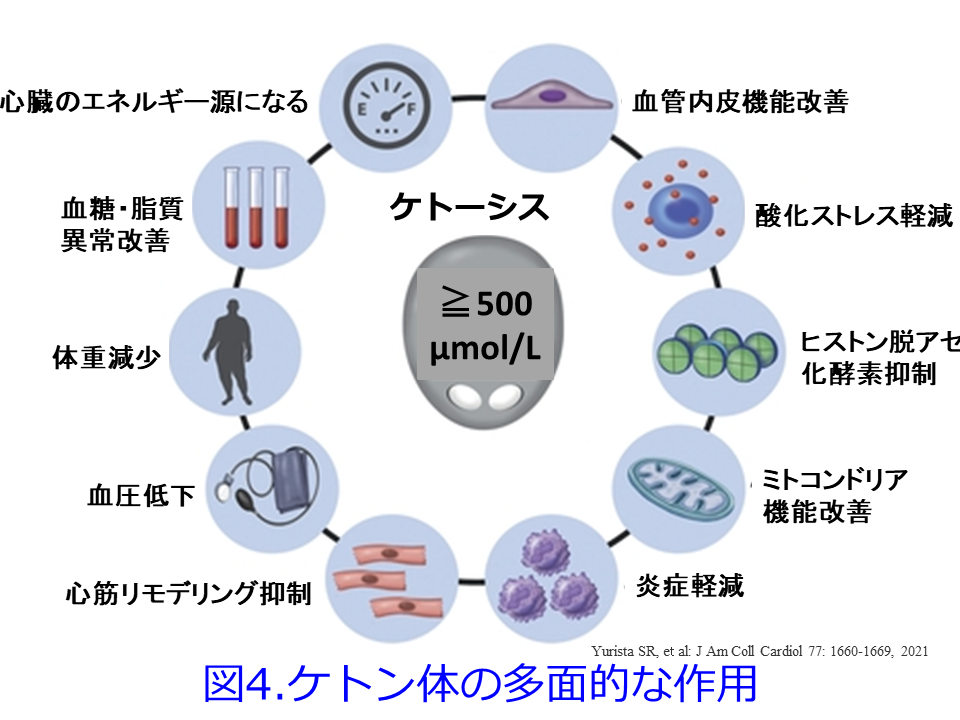
そして大量の糖質を尿中に捨てるSGLT2阻害薬を服用すると、低糖質食を摂取したのと同様の生体内環境になって、ケトン体がエネルギー産生源の主役になるのではないでしょうか。絶食などで惹起される血中ケトン体濃度上昇(これをケトーシスと言います)では重篤なアシドーシスはならず、著しいインスリン作用不足によって、あるいはアルコール過剰摂取によってケトン体が高濃度になると、アシドーシスとなって毒性を示す可能性があるといわれています。糖尿病患者にとってケトン体は糖尿病ケトアシドーシスの原因物質であるというマイナスイメージがあります。しかし最近の研究ではケトン体、特にβ-ヒドロキシ酪酸には5日目に説明したとおり、心筋細胞に負担をかけることなく心機能を改善させる、血管内皮機能改善作用、抗炎症作用、酸化ストレス軽減作用、脂質異常改善あるいは抗老化作用などの生理活性があるなど、様々な有益性が明らかにされつつあります(図4)1)。
(2)ケトアシドーシスについて
ケトン体は以前は猛毒のように恐れられていたのです。糖尿病性ケトアシドーシス(DKA)は1型糖尿病などで、インスリン欠乏が高度でグルカゴン分泌過多になると、脂肪分解に歯止めが効かなくなって多量のケトン体が蓄積してDKAという死に直面する病気になります。これを熟知している糖尿病専門医がなかなか「カロリー制限食」から抜け出せないのは、まさにケトン体の蓄積による悲惨な病態を多く経験しているからかもしれません。
DKAは高血糖の症状と、悪心・嘔吐・腹痛などの消化器症状、また大量のブドウ糖が尿中排泄されることで起こる浸透圧利尿により、体液や電解質が失われることで脱水状態になります。脱水・アシドーシスにより低血圧や頻脈、速く深い呼吸(クルマウル呼吸)がみられ、吐いた息にはアセトンが含まれるため、果物のような香り(呼気アセトン臭)がする。意識障害や横紋筋融解症をきたすこともあります。特に1型糖尿病ではシックデイでインスリン注射をしなかったときなどにみられることがあるようです。DKAの本体はアシドーシスと脱水であるため、治療は輸液・インスリンの投与ですが、インスリン投与により細胞外液から細胞内にカリウムが取り込まれるため、その後のカリウム補給にも配慮する必要があります。
2型糖尿病でも口渇により糖分を含む清涼飲料水を多飲する血糖値が1,000mg/dL近くになるとみられ、ソフトドリンクケトアシドーシスと呼ばれていますが、多くは軽症だそうです。SGLT2阻害薬によるケトアシドーシスの約1/3が正常血糖ケトアシドーシス(血糖値<300mg/dLで起こる糖尿病性ケトアシドーシス)だそうですが、これについては8日目に詳述します。
(3)ケトン体についての基礎知識
最後に薬剤師目線でケトン体の動態・物性について考えてみましょう。アセトンは血中には存在せず、呼気中に排泄されますが、アセト酢酸とβ-ヒドロキシ酪酸は水溶性で、強い酸性物質で蛋白結合しません。血中のケトン体濃度の基準値は総ケトン体:26-122µmoL/Lで、そのうちアセト酢酸が13- 69µmoL/L、β-ヒドロキシ酪酸が0-76µmoL/Lとされており、ケトーシスとは血中ケトン体濃度が200µmol/L以上に増加した状態と定義されているようで、呼気や汗からもアセトン臭がすることがあります。
糸球体濾過されたケトン体は近位尿細管でトランスポータによって再吸収されますが、多くのトランスポータと同様、再吸収閾値を超えると尿中に排泄され、それが尿中ケトン体として測定されます。したがって通常では尿中にケトン体は検出されませんが、尿中にケトン体が出ていると熟しすぎた柿やリンゴのような甘酸っぱい「ケトン臭」がします。尿試験紙法によるケトン体の定性は主にアセト酢酸と反応します。ケトン体は肝臓で脂肪(食べた脂肪から先に分解し、体脂肪はあとで分解する)が分解されて産生される中間代謝産物で通常、血中には存在しませんが、糖尿病、飢餓状態、激しい運動、高脂質低糖質食(ケトジェニックダイエット)、外傷や手術後、重篤な感染症などでブドウ糖がエネルギーに変換されなくなると、肝臓で脂肪組織から引き抜かれた中性脂肪から産生される遊離脂肪酸が分解されてエネルギー源としてのケトン体が産生されます。血中に放出されたケトン体は骨格筋、心臓、腎臓、あるいは飢餓時の脳など多くの臓器でエネルギー源として利用されますが、肝臓ではエネルギー源にはなりません。赤血球もブドウ糖のみをエネルギーとするためケトン体は使われていないようです。
引用文献
1) Yuriska S, et al: J Am Coll Cardiol 77: 1660-1669, 2021
◆連載◆5日目 SGLT2阻害薬の糸球体過剰以外の腎保護効果のメカニズムは?
SGLT2阻害薬による心腎保護作用と急性腎障害抑制作用~ケトン体って何よ?~
5日目 SGLT2阻害薬の糸球体過剰以外の腎保護効果のメカニズムは?
(1)ケトン体の様々な作用
SGLT2阻害薬を投与すると、尿中ブドウ糖排泄の増加により血糖値および血中インスリン濃度が低下し、グルカゴン/インスリン比が大きくなり、肝臓での糖新生が増加するとともに脂肪組織では脂肪分解が亢進して産生された遊離脂肪酸が肝臓でケトン体に変えられて全身循環します。ケトン体はケトアシドーシスの原因になる非常に危険な酸性の物質というイメージがあるかもしれませんが、最近になってブドウ糖に替わるエネルギー源として心臓・腎臓で利用されることによって、心腎の仕事の効率化・機能改善に寄与している、あるいはケトン体自身が健康にとって良い効果を持っているのではないか、という説が提唱されはじめています。ケトン体の中でアセト酢酸とβ-ヒドロキシ酪酸は酸性が強いので、血中のケトン体濃度が高くなるとアシドーシスになりますが、インスリンの働きが正常で、ブドウ糖の利用が適切である限り、ケトン体は安全なエネルギー源となるといわれています。
例えば酸素消費量が非常に高いことで知られる心筋細胞では脂肪酸やケトン体、グルタミン酸塩、乳酸、酢酸が重要な原動力になっており、心不全になると、心臓はタンパク質分解によってより多くのケトン体と乳酸を消費するようになります1)。牛や羊などの反芻動物(ruminant)はブドウ糖ではなく、酢酸を主要なエネルギー源にしています。これは白鷺病院で透析中の低血圧やショックの原因がアルカリ化剤として加えている酢酸が原因だったということで、世界初の重曹透析液による多人数透析液供給装置による無酢酸透析を行った時に酢酸に関する英語論文を散々読まされたので、22-23歳当時の平田はruminantについては詳しかったものです。動物実験では糖尿病で心筋梗塞のラットにエンパグリフロリジンを投与すると非投与群に比し血清Cr値とNGAL(neutrophil gelatinase-associated lipocalin)値が有意に低下し、メサンギウム基質が減少し糸球体面積が低下し、ラットのAKI発症を予防します。NGAL、KIM-1(kidney injury molecule-1)などの腎障害マーカーのmRNAレベルを下げるだけでなく、腎のTNF-α, IL-1βなどの炎症性サイトカインのmRNAレベルも低下したことが報告されており、この論文でもケトン体のβ-ヒドロキシ酪酸の濃度が上がることによって糖尿病患者のAKIを予防できることに言及しています2)。同様に虚血再灌流モデルマウスにβ-ヒドロキシ酪酸を持続投与すると腎虚血によって起こる炎症や酸化ストレスを軽減する作用、近位尿細管の細胞死を減少させる効果があることも報告されています3)。
ケトン体はエネルギーの枯渇した心臓の代替エネルギーになるだけでなく、遺伝子転写、炎症と酸化ストレス、内皮機能、心筋リモデリング、心血管危険因子など多様な細胞過程に有利な影響を及ぼすことも明らかにされています4)。さらに飢餓状態や低酸素、活性酸素をなどの細胞ストレスで活性化されるNAD依存性脱アセチル化酵素Sirt1(silent information regulator 1:当ブログ「老化は避けて通れないもの」ではない -後編-で紹介したメトホルミンとレスベラトロールが寿命を延ばすことに関して解説した長寿遺伝子のサーチュインファミリーです!)とAMPK(Adenosine monophosphate-activated protein kinase:これもメトホルミンによって活性化され、ミトコンドリアのオートファジー機能[ライソゾーム依存性の細胞内分解経路で古くなったタンパク質を再利用する働き]を促進する機能をもちます)を活性化します。つまりSGLT2阻害薬投与によって産生されたケトン体を介してSirt1やAMPKが活性化され、抗酸化、心筋症の発症抑制作用を示すのです。またSGLT2阻害薬は貧血の改善と血清尿酸値の低下ももたらしますが、これもSirt1の活性化によると書かれていますが5)6)、これらについては基礎研究の苦手な平田の理解力を超えていますので詳しくは解説できませんが、SGLT2阻害薬による絶食に似た効果はSirt1とAMPKの活性化を介して、寿命を延ばす効果が期待できるかもしれません。また2型糖尿病患者の膵島ではオートファジー機構の不全があるのですが、SGLT2阻害薬がオートファジー機能を補完して心・腎保護作用を示し、エネルギーの恒常性を調節するのではないでしょうか。
SGLT2阻害薬による腎保護効果は糖尿病腎臓病によるmTOR1(mammalian target of rapamycin 1)の過剰活性化をケトン体上昇によって抑制することに起因することも報告されています7)。mTORを阻害するとオートファジーが促進します。これも「老化は避けて通れないもの」ではない -後編-で紹介していますが、オートファジーによるたんぱく質の再利用は前述のように健康寿命を延ばすことが期待できます。
糖尿病の病態はインスリン分泌が減少、あるいはインスリンが作用しにくい病態であるため、細胞内にブドウ糖を取り込めなくなる細胞内飢餓状態になって、様々な臓器障害を起こしやすのだと考えてみると分かりやすいかもしれません。糖尿病では主要なエネルギー源として糖を利用できにくいため、脂肪から肝臓で合成されたケトン体にATP産生源になってもらうことで腎臓病の悪化を防ぎ、心筋の代謝改善によって心不全の悪化を阻止しているのではないでしょうか。糖質とケトン体はほぼ同等のエネルギーを生産できるので、SGLT2阻害薬を投与してグルカゴン濃度を上げて肝臓で脂質からケトン体を作ることによって心収縮力が上がり、腎臓の機能が温存されるのだと思います。
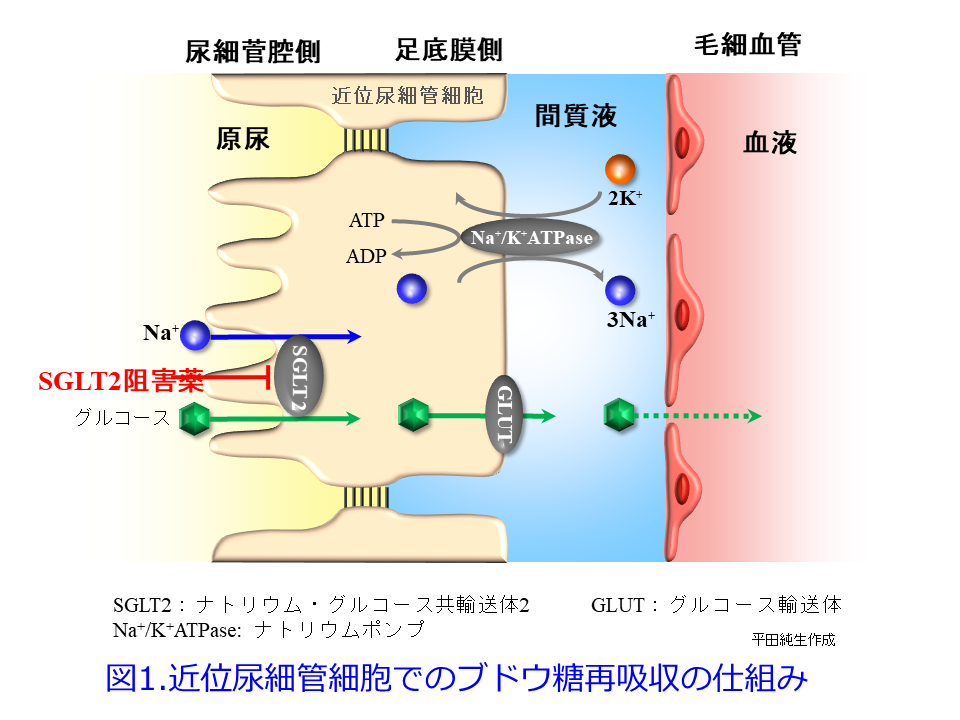
近位尿細管のS1およびS2セグメントはSGLT2が存在するところですから、ブドウ糖とNaがSGLT2によって再吸収されると近位尿細管上皮細胞内には大量のNaが入ってきます。ところが細胞内のカチオンの主役はカリウムですからNa+/K+ ATPase(Naポンプ)をフル稼働させてNaを細胞外に出してカリウムを取り込む必要があり、そのためには大量のATPが必要になるので、低酸素状態になった腎髄質での虚血に対してケトン体の利用が増えるのは理に適っていることではないでしょうか。腎臓の尿細管はATPを必要とする水、Na, Kを再吸収するトランスポータが豊富なため、ATPを産生するミトコンドリアが大量に存在しますし、心筋は拍動のためにATPを消費します。SGLT2阻害薬の投与によって近位尿細管上皮細胞でのATP消費が抑制されることも、RAS阻害薬や利尿薬、NSAIDsなどのTriple Whammy処方などによっておこる虚血性のAKI発症抑制に寄与しているのではないかと平田は愚考しております(図1: Naポンプを動かすために大量のATPが消費される)。ATPの産生に伴い活性酸素が産生され、酸化ストレスにさらされると尿細管やそれを取り巻く細動脈が障害されるはずだからです。そしてSGLT2阻害薬による酸化ストレスの軽減は腎臓だけではなく心不全状態で心筋虚血に陥っている心臓でも起こっているはずなのです。
(2)貧血改善作用と血行動態改善作用
SGLT2阻害薬が脳梗塞を起こすのは、当初の新聞記事(1日目の図2)になった時のニュースでは利尿作用により生じる血液濃縮のためだと平田は思っていましたが、それだけではなさそうです。糖尿病や心不全、CKDではRASが刺激されて産生されるアンジオテンシンIIが腎尿細管間質性低酸素を誘発し(SGLT2阻害薬はTGFを抑制することによって体液量が減少することによってレニン分泌を促すのではないかと考察する専門家もいます)、低酸素誘導因子(HIF)を刺激し、エリスロポエチン産生を介して赤血球産生を促すことによると考えられています8)。それに対しRAS阻害薬が貧血に関与していることはよく知られていますが、糖尿病におけるSGLT2の活性化は腎尿細管間質を高グルコース環境にすることによってHIF-1を損ないエリスロポエチン産生細胞を損傷し、貧血を助長します。SGLT2阻害薬は投与数週間で貧血が改善し、RAS遮断薬に加えて投与されたSGLT2阻害薬によるヘマトクリット値の上昇は、達成された心腎保護に大きく寄与する可能性があるというのです8)。最近の総説ではSGLT2阻害薬はHIF-1αを抑制してHIF-2αを活性化し(前述のSirt1を介したHIF-2αの活性化するという専門家もいます)、それによって赤血球形成を増強すると同時に、オルガネラ(細胞内小器官)の機能障害、炎症、線維症を抑制することが明らかになっているようですが9)、これは平田の理解を超えておりますので詳しく解説できません。これが腎組織や心組織への酸素供給を高めることに寄与して、過剰の糖を再吸収することによって起こる近位尿細管の低酸素状態・虚血を改善して腎保護効果を示しています。そういえばRAS阻害薬の副作用に貧血がありましたよね。
糖尿病患者のSGLTによるグルコース再吸収の増加はNaポンプによる過剰なATPを消費し(図1)、腎細管間質に高グルコース環境を作り出し、尿細管近傍にある腎エリスロポエチン産生細胞を損傷させ、EPO分泌低下と赤血球減少をもたらすそうです(図2)10)が、これは分かりやすいですね。 このことはRAS阻害薬単独だと貧血を助長するのに対し、SGLT2阻害薬を併用するとそれを打ち消してくれることもCKDの進行やAKIの発症を防ぐことになるかもしれません。それを裏付けるように3日目の図3ではSGLT2阻害薬阻害薬の腎保護作用はRAS阻害薬を併用したほうが、より腎保護作用が強い傾向が認められています(この考察が正しいかどうかは分かりませんが……)。
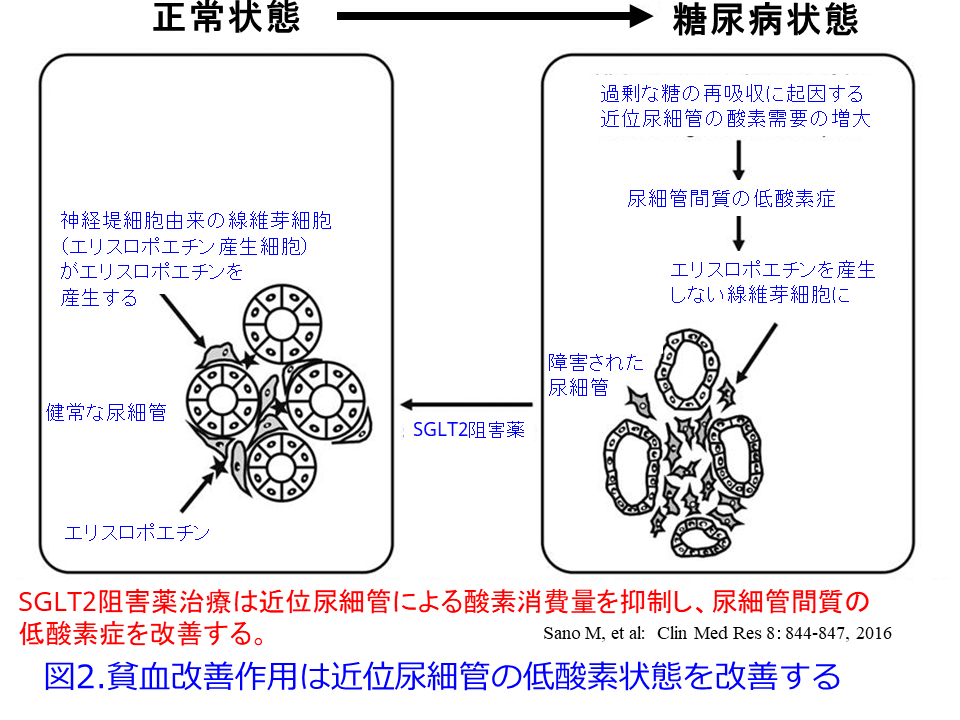
非糖尿病虚血再灌流モデルマウスでは,SGLT2 阻害により尿細管への糖取り込みを抑制することにより,尿細管からの血管内皮増殖因子VEGF 発現増加に伴って傍尿細管低酸素症を抑制し、毛細血管網を改善し,尿細管周囲毛細血管うっ血を抑制して腎の線維化の発症を抑制することが報告されています11)。これによってもTriple Whammy処方などによって起こるAKIの発症を抑制することが期待できるかもしれません。図2に示すように酸素需要増大が腎虚血を起こしているのをSGLT2阻害薬によってEPO産生細胞が守られる、あるいは代替エネルギーのケトン体の多面的な作用によってEPO産生細胞の障害を防いでいるのかもしれません。
(3)血清尿酸値低下作用
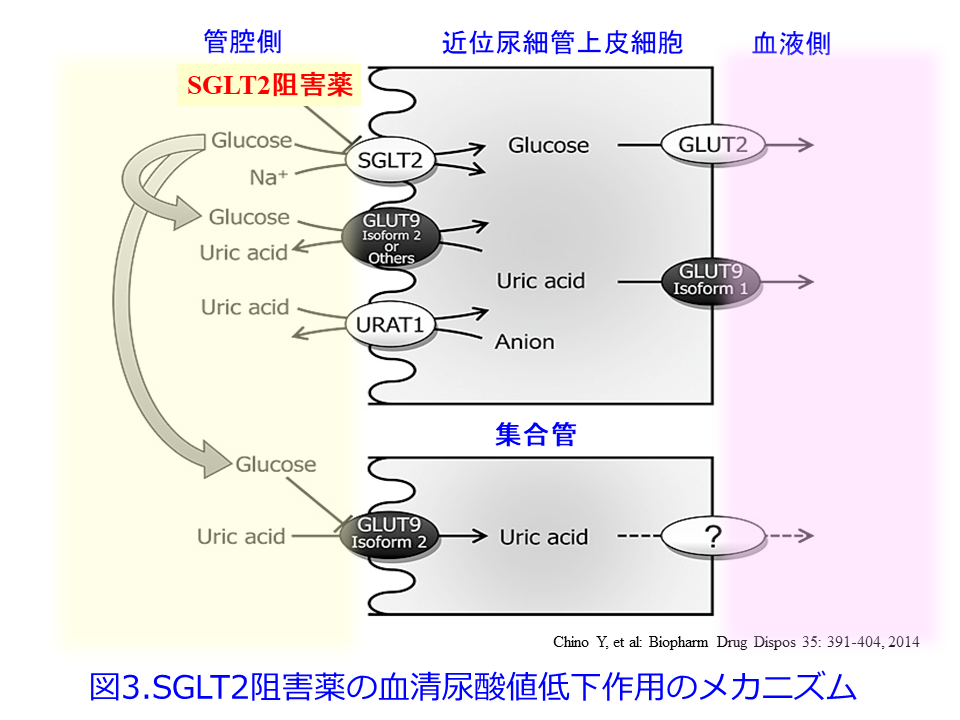
尿酸は糸球体でろ過された後、近位尿細管において尿酸トランスポータURAT1によってその90%が再吸収されますが、その後50%が分泌され、40%が分泌後再吸収されるため尿中には10%が排泄されます。SGLT2阻害薬はSGLT2を阻害することによって尿中にブドウ糖を排泄するため、管腔内の高濃度ブドウ糖が近位尿細管管腔側への尿酸の排泄を促進し、集合管で尿酸を再吸収するGLUT9 isoform 2(GLUT9: SLC2A9)を阻害することによって血清尿酸値をSGLT2阻害薬の用量依存的に低下させます(図3)12)。これはSGLT2阻害薬による尿酸低下作用は直接GLUT9を阻害するのではなく、SGLT2阻害薬による管腔中の高濃度のブドウ糖を介した作用と推測されています12)。GLP-1受容体作動薬投与群に比し、SGLT2阻害薬群において、痛風発症率リスクが有意に低かった(ハザード比0.64、95%信頼区間0.57-0.72)ことも報告されています13)。
(4)NHE抑制による心保護作用
Na+/H+交換輸送体(NHE-1: sodium hydrogen exchanger 1: Na+-H+ exchanger 1)は⼼筋細胞に発現しており、Na+濃度勾配を利用して細胞内のH+と細胞外のNa+を1:1で交換輸送し、ナトリウムの細胞内への取り込みに働きます1)。NHE-1が過剰に活性化すると、Naの取り込みが過剰となり、細胞内のNa/Ca交換体を介して、Caの過負荷状態となります。そのためNHE-1 の過剰な活性化が、⼼筋細胞の損傷およびアポトーシスを誘発し、⼼線維化に繋がると考えられます14)。SGLT2阻害薬はNHE-1 に結合することによってその活性を阻害し、細胞内Na濃度を低下させる結果、細胞内Ca濃度を低下させて、⼼筋細胞の⽣存能を改善し、⼼線維化を抑制する可能性があると考えられています14)。腎臓にも近位尿細管にはNa+/H+交換輸送体3(NHE-3)が発現しており、Naを再吸収していますが、SGLT2阻害薬は腎臓においても阻害しているそうです。また腸管NHE-3阻害薬のtenapanorは食事からのNaの吸収を抑え、結果として細胞内のプロトン濃度を上昇させます。それにより、消化管のリン吸収を制御する細胞間接着を強固にして、強力にリンの取り込みを抑制する作用があるので、新たな透析患者用高リン血症治療薬として注目されています。
心保護作用には、このほかにも利尿作用による体液量減少および左室の前負荷軽減、ケトン体産生による心筋のエネルギー効率の改善、貧血の改善、腎機能改善による「心腎連関」なども考えられます。そして心機能が改善すれば「心腎連関」によって腎血流の低下を防止することで腎機能の悪化も防止でき、腎虚血によるAKIを防止できるかもしれません。
(5)SGLT2阻害薬によるAKI予防効果がもたらすもの
これから糖尿病を合併しないCKD治療にもSGLT2阻害薬が使えるようになったことは、2日目の図1, 図5で示されるように腎機能悪化速度を遅らせるだけではなく、併用されやすいRAS阻害薬、利尿薬(これだけでdouble whammy)によるAKIを帳消しにしてくれるかもしれない希望を持たせてくれることは福音に違いありません。だって高齢CKD患者がAKIを発症すると末期腎不全に至る確率がうんと高くなるのですから(図4)15)。
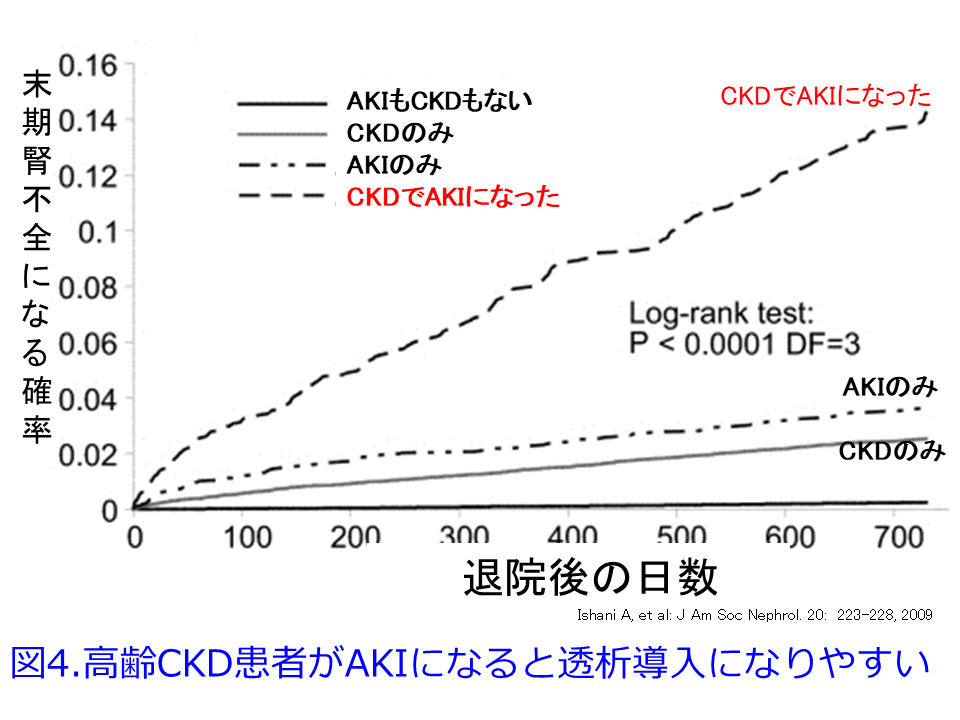
ということでまとめるとSGLT阻害薬の長期的腎保護作用およびAKI抑制作用は①尿細管糸球体フィードバックによってGFRを調節している、②ケトン体がブドウ糖の代替エネルギーとなって腎臓で利用され腎虚血によるエネルギー不足を解消してくれる、あるいはケトン体のβ-ヒドロキシ酪酸が抗酸化・抗炎症作用など心臓・腎臓に対して有利な作用を示す、③近位尿細管の過剰なATPの消費を防ぎ、腎細管間質に高グルコース環境を改善して、EPO分泌を促進して貧血を改善することによって近位尿細管の虚血状態を改善する、④心保護作用から期待される心腎連関や尿酸低下作用など、が考えられるのではないでしょうか。これらはSGLT2阻害薬が長期の腎保護効果だけでなく、短期的なAKIを予防してくれているメカニズムになるのではないかと思っています。
引用文献
1)Murashige D, et al: Science 370: 364-368, 2020
2)Ahmed A, et al: Biomed Pharmacother 2021 Jul;139:111624. doi: 10.1016/j.biopha.2021.111624.
3)Tajima T, et al: Kidney Int 95: 1120-1137, 2019
4) Yuriska S, et al: J Am Coll Cardiol 77: 1660-1669, 2021
5)Packer M: Cardiovasc Diabetol 2020 May 13;19(1):62. doi: 10.1186/s12933-020-01041-4.
6)Yang X, et al: Adipocyte 9: 484-494, 2020
7)Tomita I, et al: Cell Metab32:404-419, 2020
8)Marathias K, et al: Am J Nephrol 51: 349-356, 2020
9)Packer M: Am J Kidney Dis 77: 280-285, 2021
10)Sano M, et al: Clin Med Res 8: 844-847, 2016
11)Zhang Y, et al: Kidney Int 94: 524-535, 2018
12)Chino Y, et al: Biopharm Drug Dispos 35: 391-404, 2014
13)Fralick M, et al: Ann Intern Med 172: 186-194, 2020
14)Verma S. et al.: Diabetologia 61: 2108-2117, 2018
15)Ishani A, et al: J Am Soc Nephrol. 20: 223-228, 2009
◆連載◆4日目 SGLT2阻害薬の心・腎保護効果のメカニズムは?
SGLT2阻害薬による心腎保護作用と急性腎障害抑制作用~ケトン体って何よ?~
4日目 SGLT2阻害薬の心・腎保護効果のメカニズムは?
(1)SGLT2阻害薬の主作用は尿細管・糸球体フィードバックの正常化?
糖尿病ではSGLT2の発現量が増大しており、それによるブドウ糖・Naの再吸収の亢進につながり、尿細管・糸球体フィードバック(TGF: Tubuloglomerular feedback )の抑制を来たして、糖尿病初期の糸球体過剰濾過、GFRの上昇につながっているのを改善することが主要な薬理作用と考えられています。また糖毒性、つまり食後高血糖による血糖値の乱高下が動脈硬化や認知症を起こすのを軽減できる、あるいは利尿降圧作用によって心・腎の負荷を軽減するのは当然ですが、単に血糖降下作用、利尿降圧作用によるものではないことは、既存の血糖降下薬や降圧薬でこれほどまでの心・腎保護作用を示さなかったことからも明らかです。ほんの数カ月で対照群との差が明らかになり始めているので、SGLT2阻害薬による血糖低下を介した動脈硬化の抑制や長期的な病態の改善が心・腎保護作用につながっていると考えるのは不自然だと考えられます。またSGLT1は基本的に腎臓だけでなく小腸や心臓にも発現していますが、SGLT2は心臓にはほとんど発現していないので、SGLT2阻害が直接心不全改善につながらないのではという考え方もできます。さらに心筋細胞や血管内皮細胞・腎臓に直接作用しているだけであれば用量依存的になるはずですが、EMPA-REG OUTCOME試験以外の他の試験でも用量依存性は認められていません。
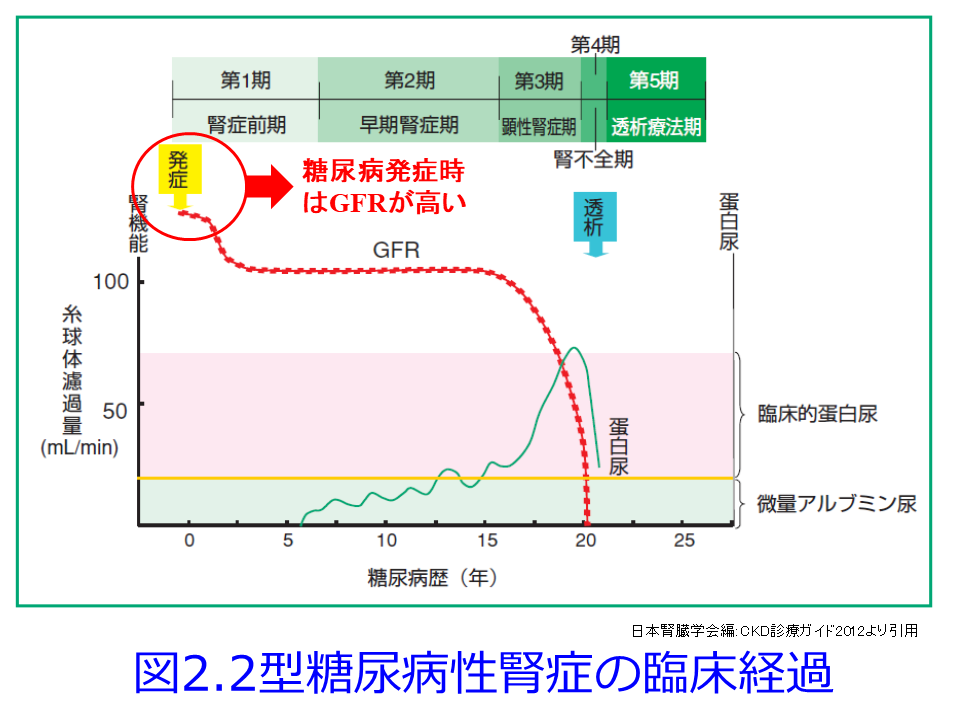
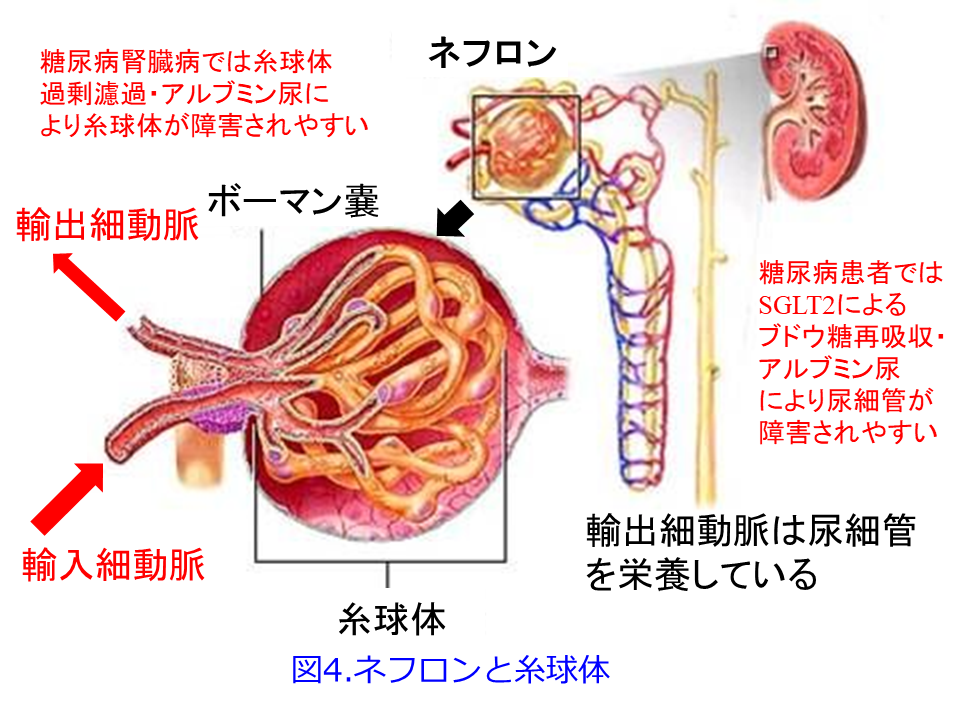
ただし2日目の図1,図5に示すようにGFRは一時的に低下しているため、RAS阻害薬と同様、糸球体過剰濾過を抑制してくれていることに間違いはありません。RAS阻害薬が輸出細動脈を拡張してGFRを低下させるのに対し、SGLT2阻害薬はTGFの障害を是正して、特に糖尿病性腎症初期に顕著な多飲・多尿および糸球体過剰濾過によるGFR高値、それに伴うアルブミン尿を是正する効果が期待できます(図1)。これに
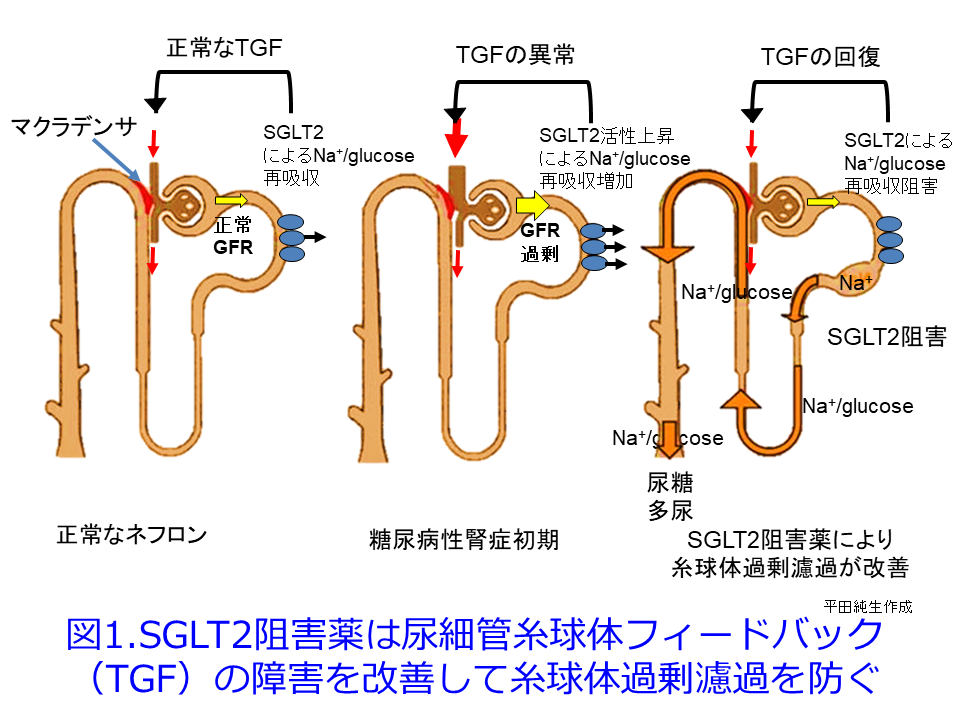
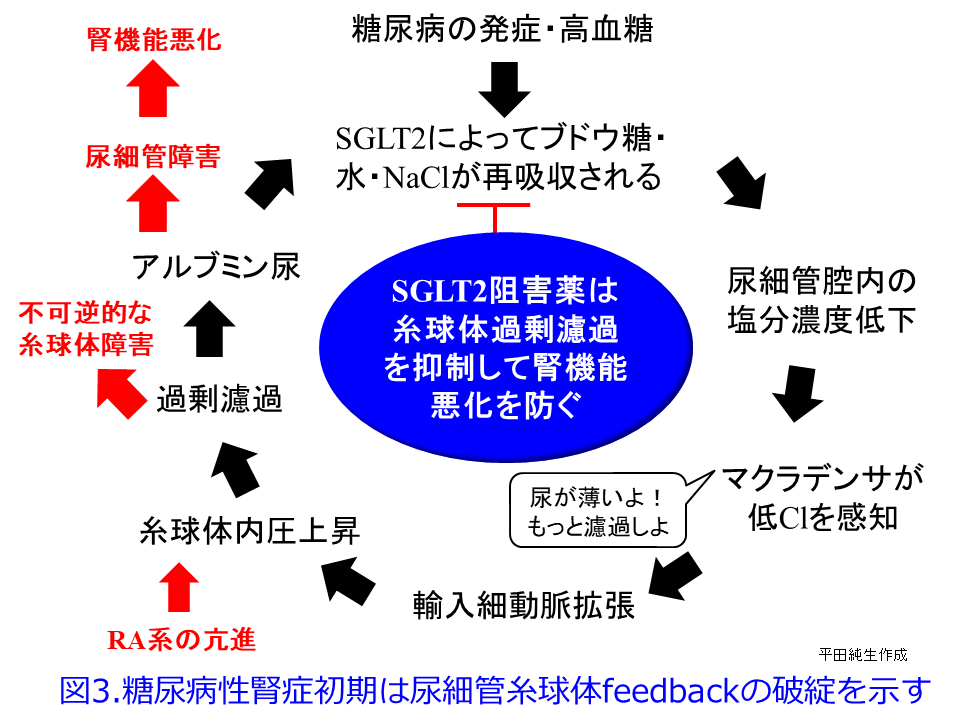
ついては図を用いて説明させていただきます。糖尿病性発症初期は高血糖のため多飲・多尿が続き、糸球体ろ過圧が高くなるためGFRが高くなってアルブミン尿も出やすく、その後に腎機能が悪化しやすくなります(図2)が、この典型的な糖尿病性腎症初期のGFRの上昇について考えてみましょう。血糖値が高い糖尿病発症初期には、SGLT2の活性が上昇してNa+/glucoseの再吸収を高めようとします。SGLT2はsodium-glucose cotransporter-2が正式名称で、ブドウ糖とNaを一緒に再吸収する役目を担っていますから、それにより遠位尿細管の塩濃度(正確にはCl–濃度)が低値となったことをマクラデンサ(緻密斑)がキャッチして、血管収縮物質のアデノシン分泌抑制を介して、輸入細動脈を拡張して糸球体濾過量を増やそうとするTGFの異常によって、多尿・多飲、腎機能(GFR)が高いという現象が起こります(図1中の図, 図2の赤丸)。
糖尿病患者にSGLT2阻害薬を投与するとNa+/glucoseの再吸収が阻害されるため、Na利尿・浸透圧利尿によって大量の尿糖が排泄されて血糖値を下げます。それとともに近位尿細管におけるSGLT2が阻害されているため、尿細管管腔中の塩濃度が高くなってTGFが正常化して糸球体過剰濾過が収まり、腎機能は一時低下するものの、長い目で見ると糸球体の過負荷が軽減されて腎機能の悪化速度が非常に緩徐になります。これが腎保護効果の1つのメカニズムと考えられています。このメカニズムは図3を見ると分かりやすくなると思います。平田の個人的な発想ですが、RAS阻害薬が無理やり輸出細動脈を拡張し、NSAIDsが輸入細動脈を無理やり収縮して、ともに糸球体内圧を下げてGFRを低下させるのに対して、SGLT2阻害薬は遠位尿細管のCl–濃度依存的に輸入細動脈を収縮させる方向に「調節」している点が異なるのではないかということです。つまりSGLT2阻害薬はRAS阻害薬やNSAIDsのような無理やりではなく、濾過量の増加の程度に応じて輸入細動脈を「調節」するために過度の虚血や腎機能低下にならない、つまりAKIを防いでくれているのではないかと思っています。
(2)糸球体過剰濾過の軽減による腎保護作用
SGLT2阻害薬にはNa利尿作用+浸透圧利尿作用もあり、血圧も下げ、糖尿病腎臓病、あるいは減少したネフロンの糸球体の前負荷(図4の輸入細動脈)・後負荷(図4の輸出細動脈)を軽減することが期待できます。さらに大量のブドウ糖を尿中に排泄することによって全身の糖毒性(高血糖に伴うインスリン抵抗性、インスリン分泌能低下、動脈硬化、内臓脂肪の増加など)を低化させ、インスリン濃度が低下し、インスリン感受性を改善し、中性脂肪が低下し、体重が減少することもCKDの悪化を抑制することが期待できます。ただしSGLT2阻害薬が初めて注目されたEMPA-REG OUTCOME試験による心・腎イベント発生がエンパグリフロジン投与3 か月後から減少し(効果が出るのが早すぎる…)、3年後まで続くことが血糖や血圧の是正などでだけでは説明できません1)。
糸球体過剰濾過は糖尿病ではなくても、CKDになって機能するネフロン数が激減してくると(図6上)、RASが刺激され、残った機能ネフロンが機能しなくなったネフロンの分まで肩代わりしようとしてGFRを上げようとして(図6下)、腎小体が肥大して過剰濾過を起こし、さらにネフロン数が減少してしまうのと同じ現象です。糸球体高血圧は糸球体硬化を惹起して糸球体数が減少し、残存ネフロンの糸球体あたりの負荷が増大して肥大化して疲弊し(図5左、図6下)、食塩・蛋白質の過剰摂取によ
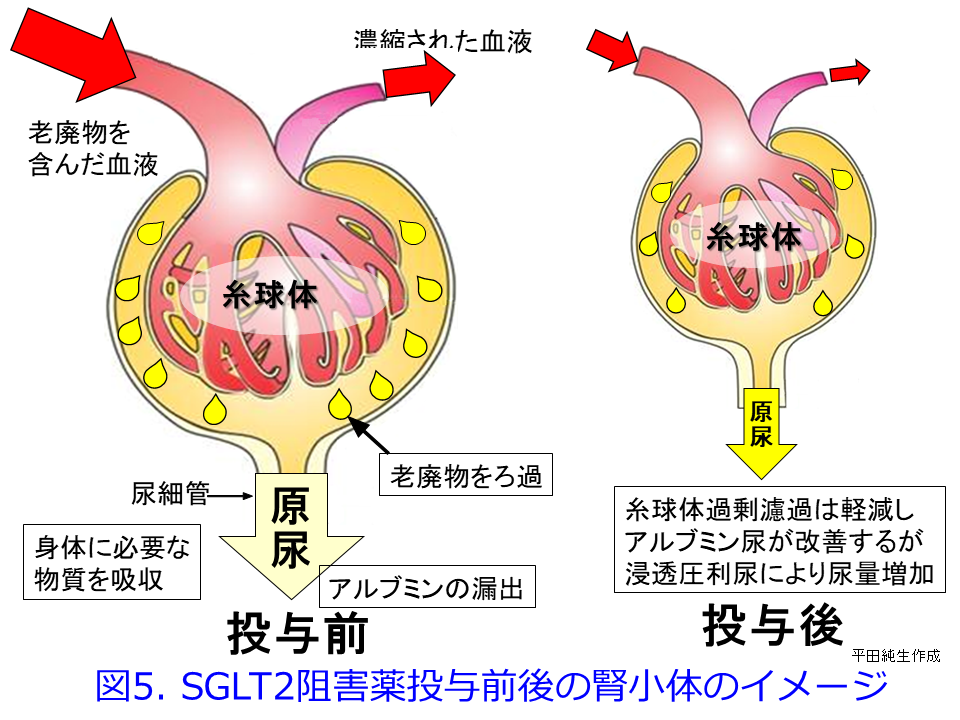
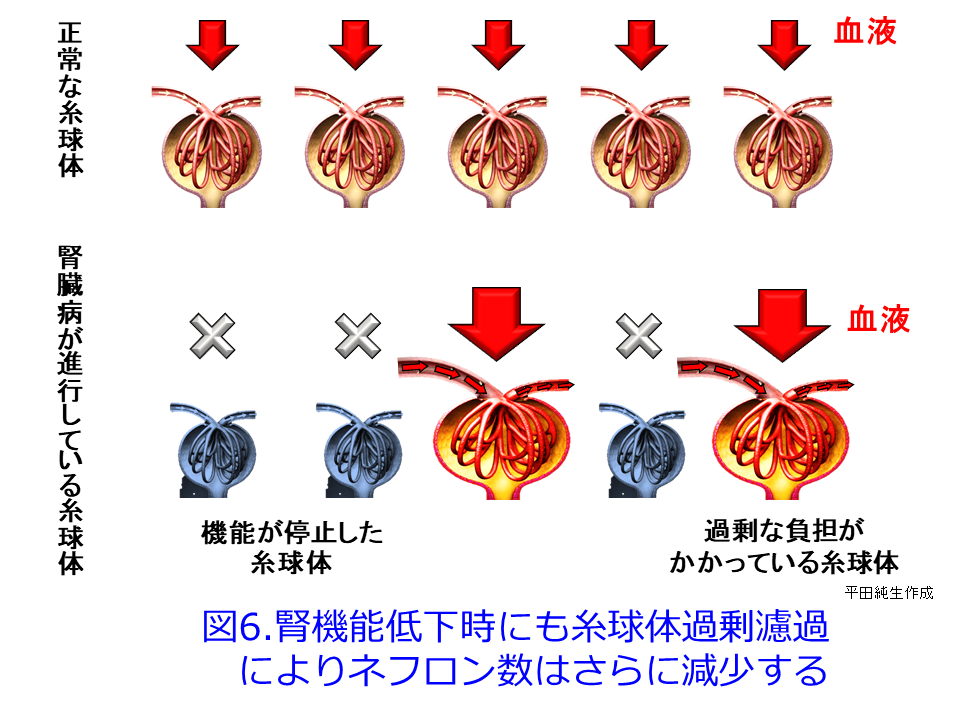
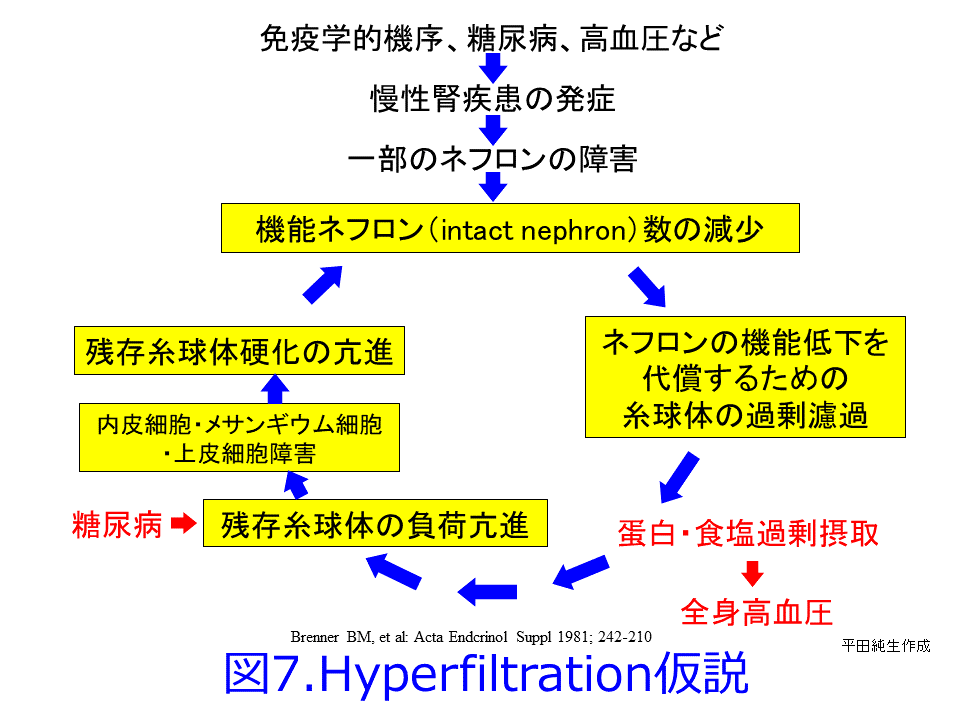
って、残存糸球体の負荷が増大して、機能ネフロン数はさらに減少するという悪循環であるhyperfiltration仮説(糸球体過剰濾過仮説)なのです(図7)。SGLT2阻害薬の腎保護作用のメインはこの糸球体高血圧による過剰濾過を正常化するとともに糸球体やメサンギウムの負荷を軽減し、アルブミン尿を減少させることが期待できますが(図1右および図5右)。それによって糸球体にかかる圧負荷を取り除いて糸球体を守り、尿細管が過剰にアルブミンを取り込んで、ライソゾームが破壊されるのを防いでいることと思われます。
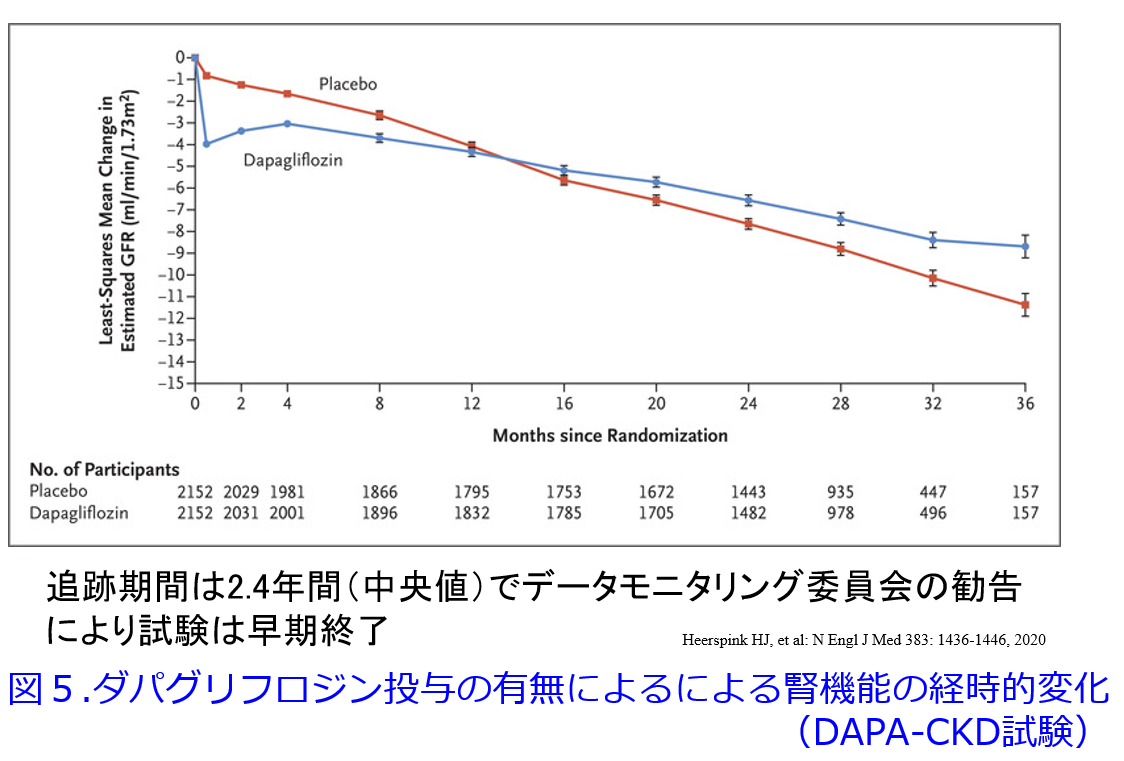
ただし非糖尿病CKD患者では尿細管糸球体フィードバックの改善度は糖尿病患者と比べると劣るはずです。DAPA-CKD試験では全患者での主要アウトカム(eGFRが50%以上持続して低下、末期腎疾患または腎・心血管系の原因による死亡)の軽減は39%でしたが、糖尿病よりもむしろ非糖尿病CKD患者の方がHRが低い、つまり糖尿病でのリスク軽減は36%に対し、非糖尿病でのリスク軽減が50%とむしろ高かった結果(図8)2)に対して、誰もが驚嘆したはずです。しかも尿中アルブミンの重さに関わらず、また腎機能の良否に関わらず、SGLT2阻害薬はまたしても有意に主要アウトカムの改善を示しています。
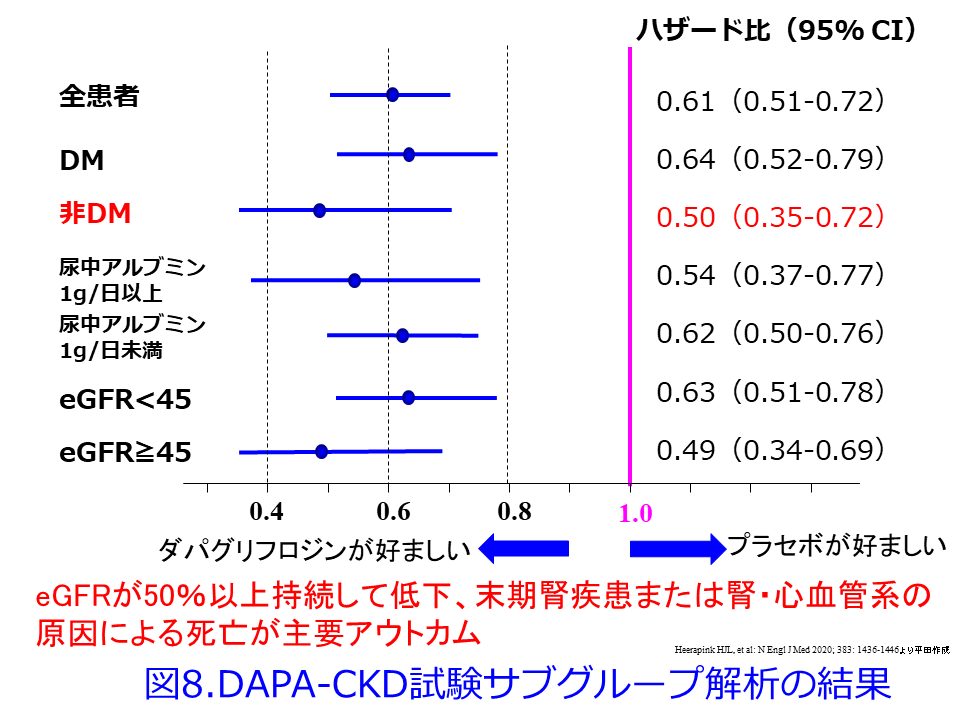
さらにDAPA-CKD試験のIgA腎症サブグループ解析では複合主要エンドポイントのHRは0.29(95%CI0.12-0.73、P=0.005)とリスクを71%減少させるという驚異的な結果が確認されました(図9)3)。IgA腎症は日本人で最も多い慢性糸球体腎炎で、血尿は多いものの蛋白尿はまれであるため、平田もSGLT2阻害薬がこれほどの効果を示すとは信じられませんでした。図9を一見すると大した結果じゃないように見えるかもしれませんが、HRが0.29では普通軸では表しにくいため対数軸を使っているためです。尿細管糸球体フィードバックの正常化による糸球体過剰濾過の改善だけではこれらの驚異的な結果を説明できません。この他にも、腎機能の悪化を抑制する強力なメカニズムがあるはずなのです。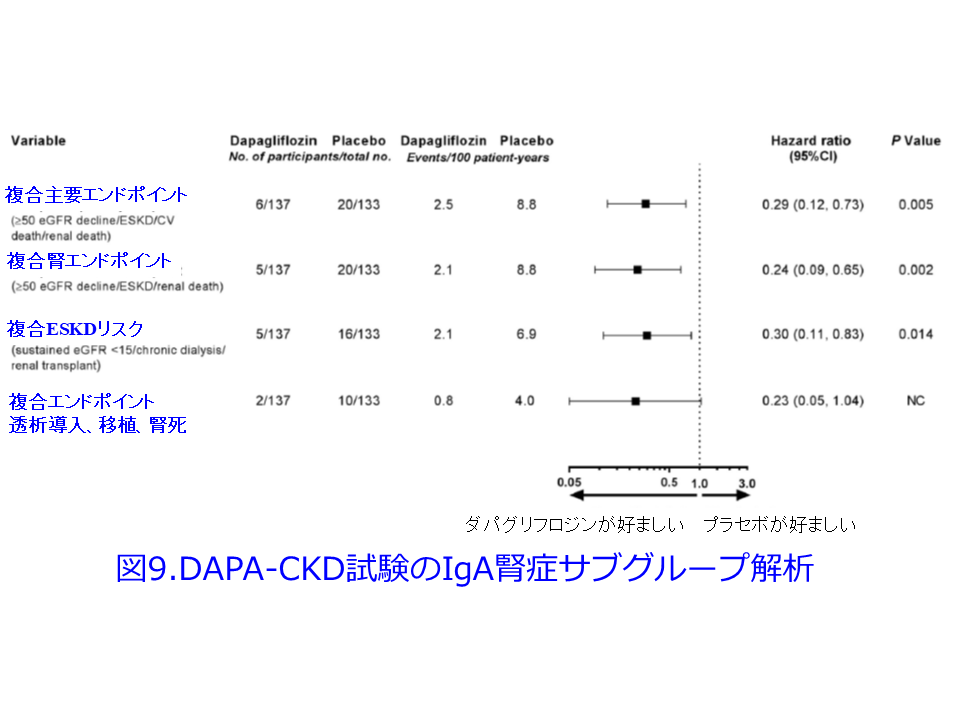
引用文献
1) Mudaliar S, et al: Diabetes Care 39: 1115-1122, 2016
2) Heerapink HJL, et al: N Engl J Med 383: 1436-1446, 2020
3) Wheeler DC, etal: Kidney Int 100: 215-224, 2021
SGLT2阻害薬による心腎保護作用と急性腎障害抑制作用~ケトン体って何よ?~
3日目 SGLT2阻害薬によるAKIの報告が少ない、
それどころかAKIを明らかに減らすのはなぜ?
SGLT2阻害薬の大規模臨床試験ではほとんどの患者でRAS阻害薬と併用されており、腎予後を主要アウトカムにしたCREDENCE試験では100%の患者が併用されています。また利尿薬も多くの報告で処方割合が多かったのですが、利尿降圧作用を有するSGLT2阻害薬は果たしてAKIを増やしたのでしょうか?実は調べてみるとSGLT2阻害薬はAKIを増やすに違いないというバイアスがあったからでしょうか、日本でも海外でも症例報告は脱水による腎機能低下などの報告はたくさんありました。そのころの平田は「やっぱりね」と思い込んでいました。
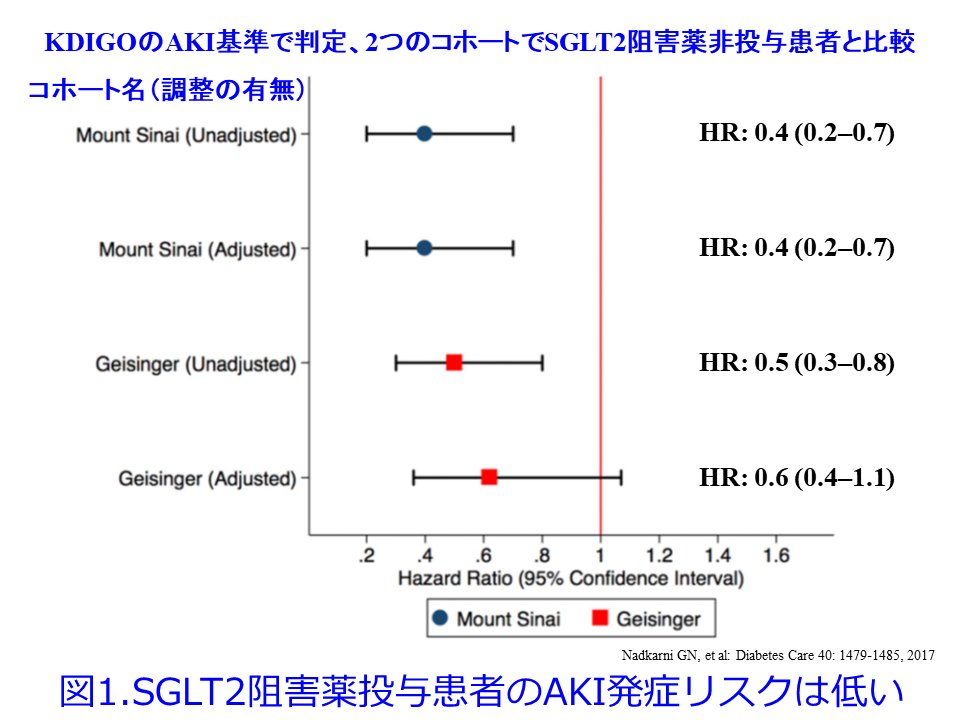
しかしDiabetes Careの2017年8月21日オンライン版1)ではSGLT2阻害薬を投与した群は、非投与群に比しKDIGO分類によるAKIの発症が50~60%低いという驚異的なデータが載りました。ただしMount Sinai, Geiingerという2つのコホートでSGLT2阻害薬によるKDIGOのAKI基準を用いてAKI発症率を調査したものでRCTではありません(図1)。2019年にはSGLT2阻害薬を投与されたRCT3試験のメタアナリ
シスによってAKIの可能性が増加するのではなく、一貫して確実に減少することが明らかになり(ハザード比0.66, 95%信頼区間0.54-0.80)2)、その3か月後にもSGLT2 阻害薬を投与されたRCT4試験のメタアナリシスによってAKIの可能性が増加するのではなく、相対危険度が0.75(95%信頼区間0.66-0.85)、つまりAKIの発症を25%減少することが明らかになりました(図2)3)。この論文を見てからは平田
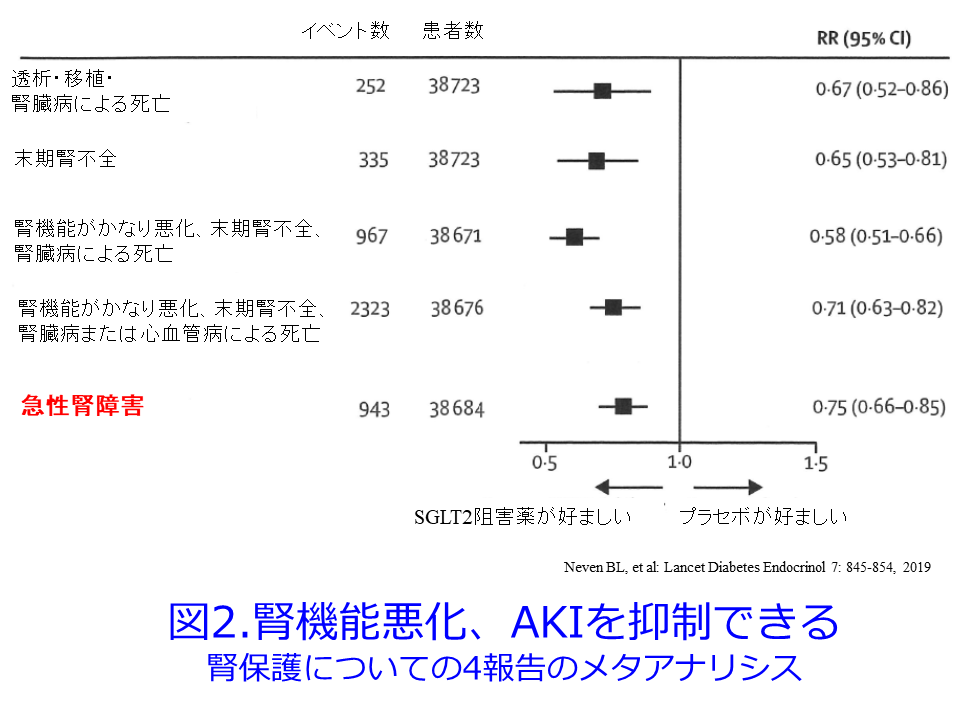
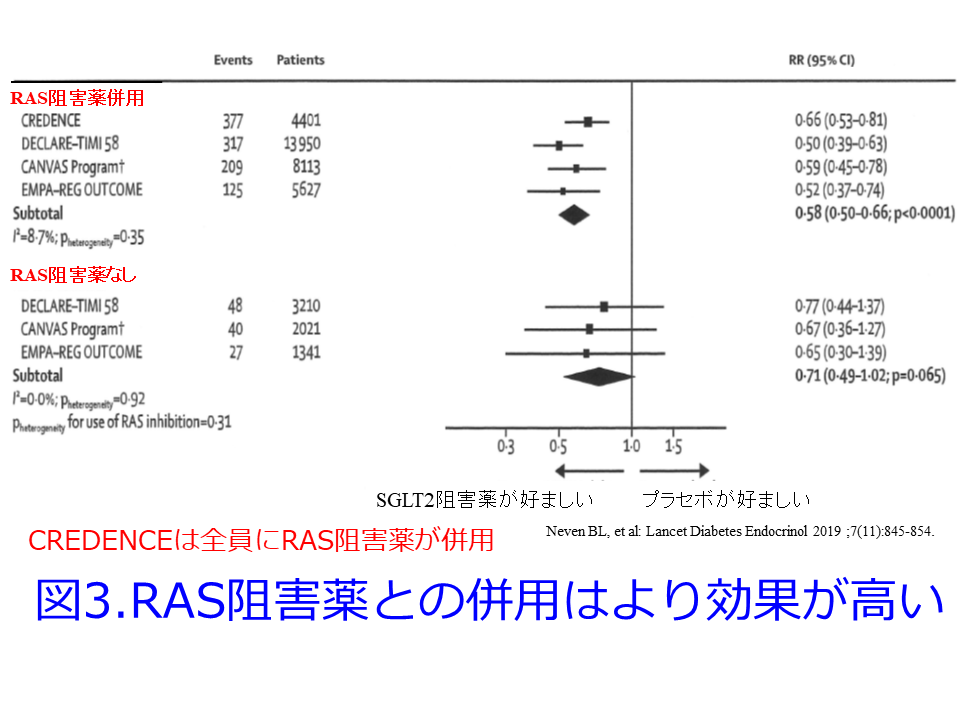
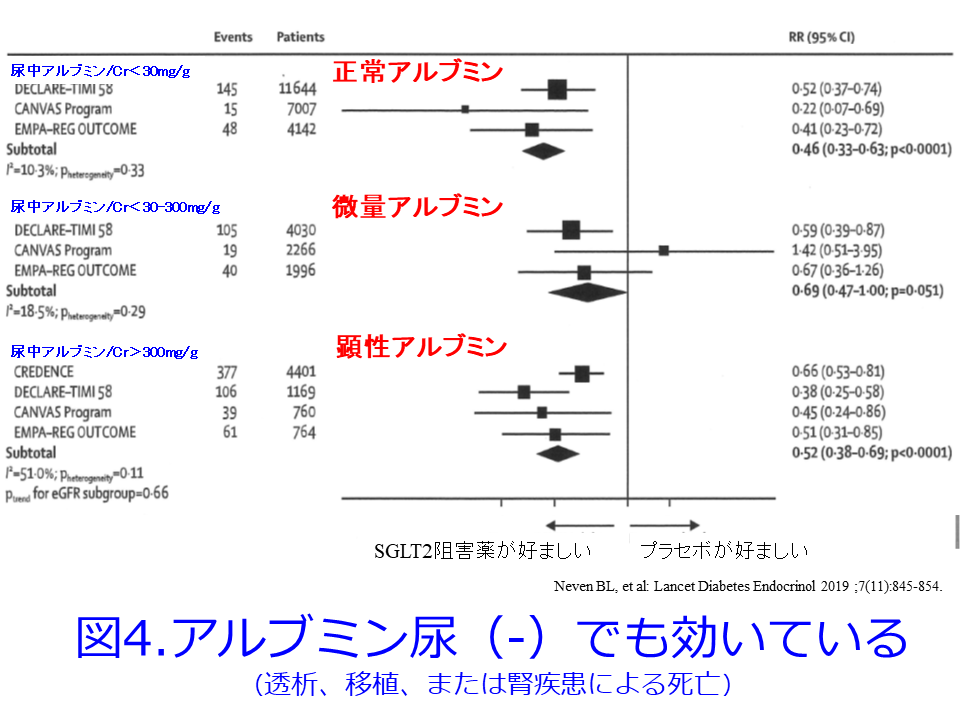
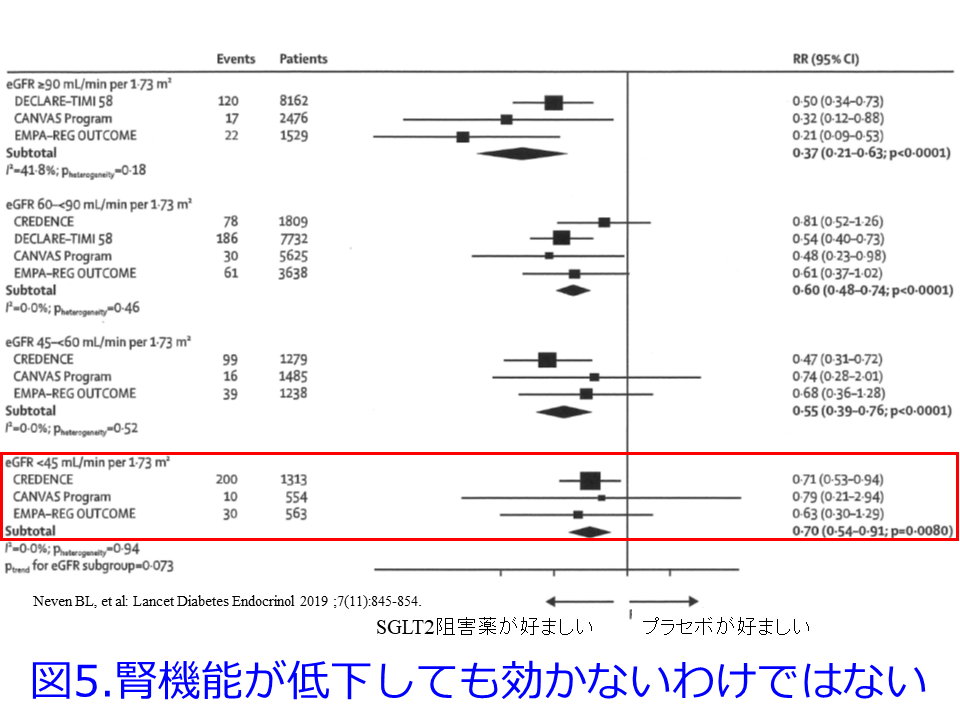
も急性腎障害原因薬物一覧表からSGLT2阻害薬を除外しています。さらにSGLT2阻害薬を投与された41の研究で循環血液量減少に関連する副作用は、SGLT2阻害薬治療を受けた患者でより一般的に報告された(OR 1.20, 95%CI 1.10-1.31, p <0.001)ものの、AKIのオッズを0.64にしました(95%CI 0.53-0.78, P<0.001)4)。その後のメタアナリシスでも一貫してSGLT2阻害薬はCKDの進行を抑制するだけではなく、AKI予防効果も持つということが確認されています。しかもRAS阻害薬との併用はより効果が高いこと(図3:この理由は後述)、アルブミン尿(-)でも効いていること(図4)、eGFRは45mL/min/1.73m2min未満になった群、つまり腎機能が低下しても効かないわけではないことなども明らかにされました(図5)3)。SGLT2阻害薬は腎機能低下とともに効果が減弱すると言われていましたが、GFR<30mL/minでは血糖値は改善しないものの、体重・血圧は低下することが確認されています4)。
これらの結果については4日目に解説するDAPA-CKD試験でも同様なのですが、平田は以下のような疑問を持ちました。
しかしeGFR 45mL/min/1.73m2未満の患者でも効いている3)。これはDAPA-CKDでの対象患者はeGFR25~75 mL/min/1.73m2で試験期間中に15mL/min/1.73m2未満になった患者も数%います5)。日本のダパグリフロジンの添付文書にはeGFR 25mL/min/1.73m2未満では「腎保護作用が十分に得られない可能性がある」と記載があるものの、適応症は「末期腎不全または透析患者を除く」とあるため、15mL/min/1.73m2まででも投与できないわけではないと読み取れますし、透析導入になるまで使い続けることもあると思われます。SGLT2阻害薬がどこまで効果が期待できるのか今のところ誰も知らないのですから。
しかしメタ解析では正常アルブミン(尿中アルブミン/Cr<30mg/gCr)の方が微量アルブミン(尿中アルブミン/Cr30-300mg/gCr)よりもRRが低値(図4)3)でした。DAPA-CKDでもアルブミン/Cr比 1000未満でも1000mg/gCr以上と同様に効いています。また非糖尿病CKD患者でもDAPA-CKD試験で腎保護効果があることが確認されています。高齢高血圧患者の腎硬化症であれば蛋白尿(-)のケースが多いでしょうが、機能ネフロン数が減少すれば糸球体過剰濾過は起こっているはずと考えればいいのでしょうが、このような患者ではRAS阻害薬との併用は両刃の剣となって、AKIを起こすはずという次の疑問につながります。
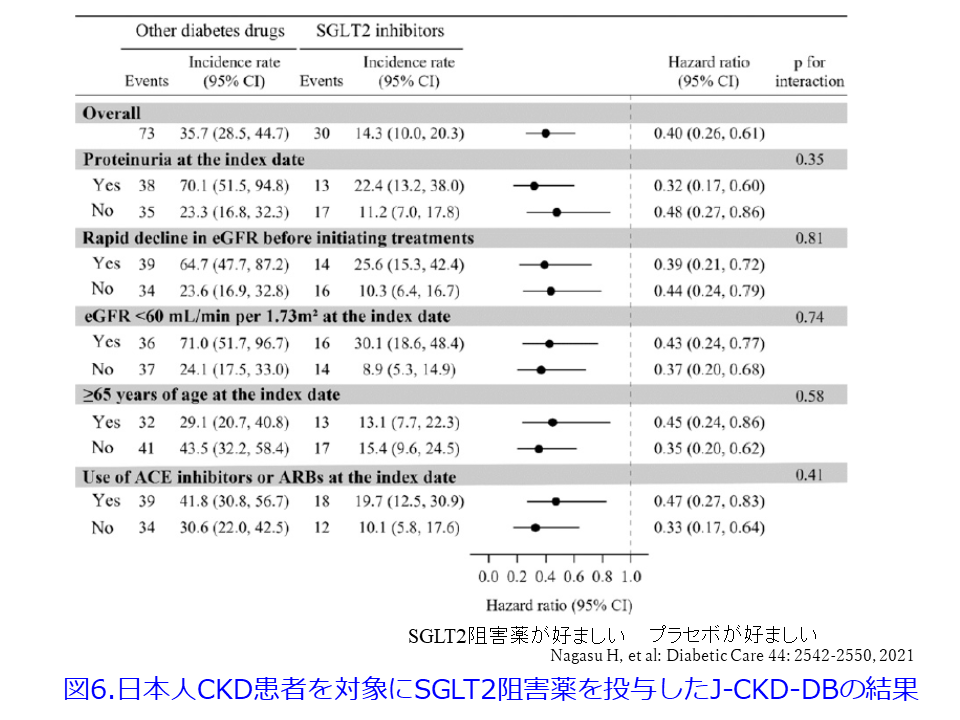
しかし実際にはRAS阻害薬と併用した方が腎保護作用の成績がよかったのです1)3)6)。日本人CKD患者を対象にしたレジストリー(Japan Chronic Kidney Disease Database(J-CKD-DB)ではRAS阻害薬の有無に関わらずSGLT2阻害薬が効果的であったことが報告されています(図6)7)。また、蛋白尿の有無、投与前のeGFRが60mL/min/1.73m2以上か未満か、eGFRの急速低下の有無に関わらず、65歳以上と65歳未満に関わらずSGLT2阻害薬が効果的であったことが報告されています。そしていずれもeGFRの50%低下と末期腎不全への移行を複合エンドポイントにしてHRが0.5未満ですから50%以上の改善が認められました。
これらのほかにも投与を中止した後でも、腎機能悪化抑制効果やアルブミン尿改善効果が持続するなど、非常に謎が多い薬です。さて、どうしたことか……。CKDの進行抑制のメカニズムもAKIの発症抑制のメカニズムも分からない。これから論文を精査して得た情報から、解説してみたいと思います。
引用文献
1)Nadkarni GN, et al: Diabetes Care 40: 1479-1485, 2017
2)Gilbert I, Thorpe KE: Diabetes Obes Metab 21: 1996-2000, 2019
3)Neven BL, et al: Lancet Diabetes Endocrinol 7: 845-854, 2019
4)Menne J, et al: PLoS Med 2019 Dec 9;16(12):e1002983.doi: 10.1371/journal.pmed.1002983.
5)Heerspink HJ, et al: N Engl J Med 383: 1436-1446, 2020
6)Qui M, et al: Diab Vasc Res Mar-Apr 2021;18(2):doi: 10.1177/14791641211011016
7)Nagasu H, et al: Diabetic Care 44: 2542-2550, 2021
◆連載◆2日目 SGLT2阻害薬の目覚ましい臨床試験結果
SGLT2阻害薬による心腎保護作用と急性腎障害抑制作用~ケトン体って何よ?~
2日目 SGLT2阻害薬の目覚ましい臨床試験結果
(1)驚異的なエンパグリフロジンの心・腎保護作用
2015年、エンパグリフロジン投与によるEMPA-REG OUTCOME試験が報告され1)、心疾患による死亡、非致死性の心筋梗塞、非致死性の脳卒中の複合を主要アウトカムとし、二次アウトカムは不安定狭心症での入院としました。RAS阻害薬が投与された方は81%、利尿薬が投与された方は43%で、主要アウトカムにおいてエンパグリフロジン群4,687人中490人(10.5%)に対しプラセボ群では2,333人中282人(12.1%)(ハザード比0.86:CI 0.74-0.99)でした。脳卒中、心筋梗塞では群間で差は見られなかったのですが、心疾患による死亡、心不全による入院ではプラセボ群に比べエンパグリフロジン群において有意に低下させるという、皆さんご存知のように、驚異的なデータを示しました。
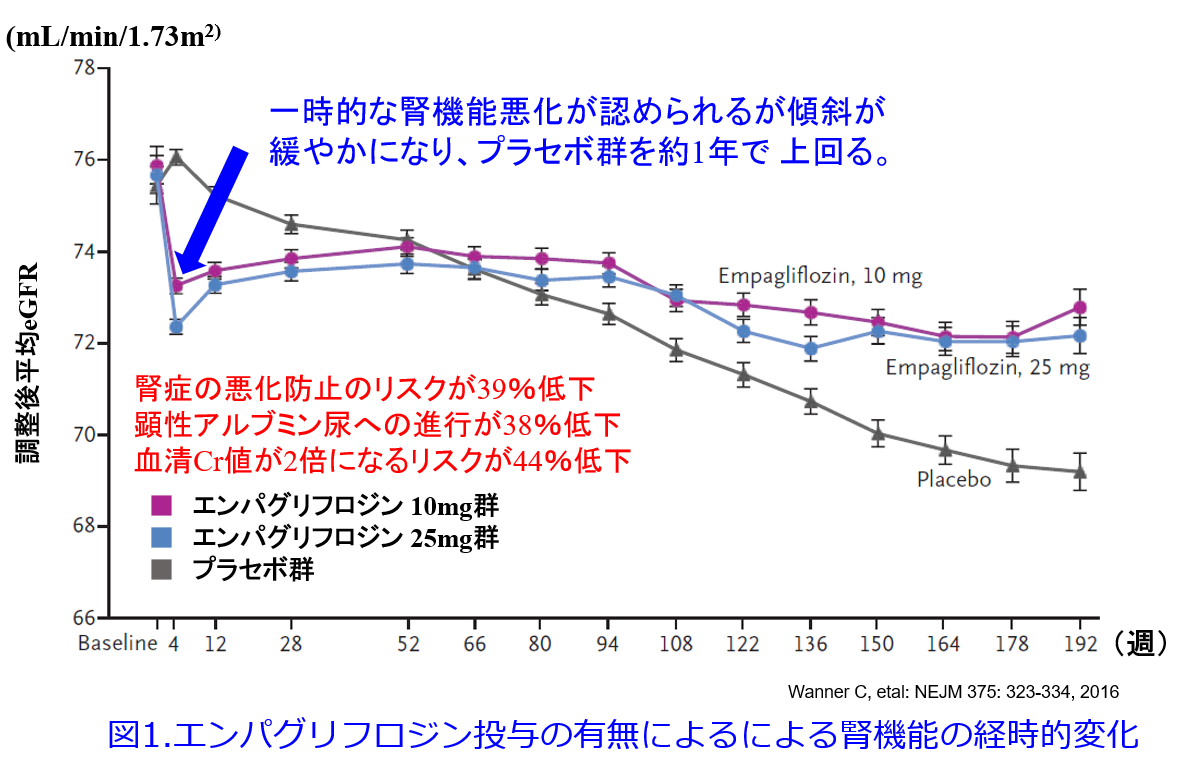
2016年にはEMPA-REG OUTCOMEの副次的評価項目である腎機能への影響に関してサブ解析した結果2)、腎障害の発症・進行はエンパグリフロジン群で4,124人中525人(12.7 %)、プラセボ群で2,061人中388人(18.8 %)に認められ、腎障害の進行を39%抑制しました(ハザード比0.61 {95 %信頼区間 0.53-0.70}, P<0.001)。血清Cr値の倍増はエンパグリフロジン群で4,645人中70人(1.5 %)、プラセボ群で2,323人中60人(2.6 %)に認められ、相対リスクは44 %減少しました。腎代替療法を開始した患者はエンパグリフロジン群で4,687人中13人(0.3 %)、プラセボ群で2,332人中14人(0.6 %)に認められ、相対リスクは55 %減少し、腎に関してもエンパグリフロジンは驚異的なデータを示したのです。ちなみにアルブミン尿陽性の糖尿病性腎症を対象にしたRENAAL試験3)でARBのロサルタンが通常治療に比し、透析導入・腎移植の発症を低下できたのは28%でしたから、いかにEMPA-REG OUTCOME試験の結果が驚異的であったかというのが分かると思います(相対リスク同士を比較するのは科学的ではないかもしれあせんが…)。これらをまとめますと、腎症の悪化防止のリスクが39%低下し、顕性アルブミン尿への進行が38%低下、血清Cr値が2倍になるリスクが44%低下し、腎機能低下群(eGFR30~59mL/min/1.73m2)でも複合腎イベントが46%低下するなど、心保護作用だけではなく腎保護作用も大いに注目されたのです2)。
図1はこの試験でのエンパグリフロジン投与群はプラセボ群に比し、初期に腎機能の低下があったものの(これをdippingと言います)、その後のeGFRの低下が極めて緩徐であり、約1年後からプラセボ群とeGFRの変化曲線が交叉し、以後は高いeGFRを保っていました。一時的な腎機能悪化が認められたものの、腎機能悪化速度を表す傾斜が緩やかになり、プラセボ群を約1年で上回ることを示し、10mgでも25mgでも同様の作用が認められたため、用量依存性はないことも明らかになりました(ただし尿中ブドウ糖等排泄、血糖降下作用は用量依存的です(図2 )4)。平田はこの当時、熊本大学薬学部育薬フロンティアセンター長でしたから、近隣薬剤師・医師を招いての抄読会でこれらの論文を取り上げ、興奮し
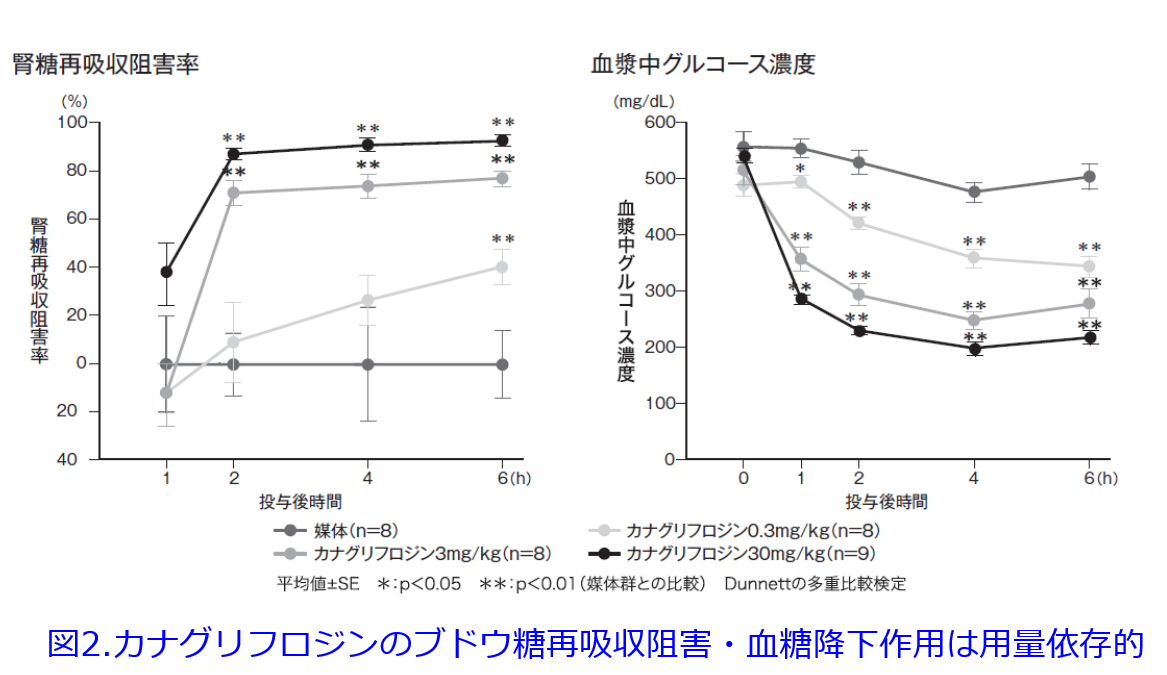
て熱いディスカッションを繰り広げていたことを思い出します。
(2)ダパグリフロジンのDAPA-CKD試験
SGLT2阻害薬は臨床的には血糖低下,体重減少,血圧低下,脂質改善(中性脂肪およびLDLの減少,HDLの増加)、尿酸低下効果などがすでに明らかにされており、EMPA-REG OUTCOME試験後にも、CANVAS Program試験、DECLARE-TIMI 58 試験、CREDENCE試験など様々な大規模臨床研究で主要評価項目である主要血管イベントのMACE(心血管死,非致死性心筋梗塞あるいは脳卒中)をプラセボと比較して有意に減少させることが明らかになりました。
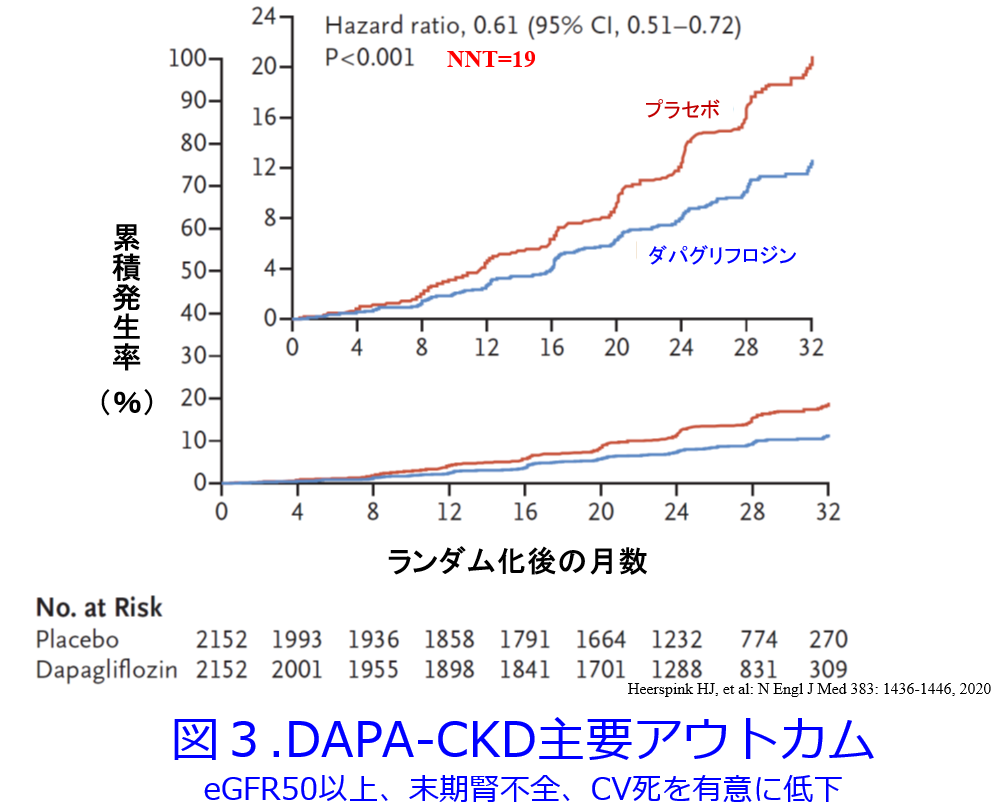
DAPA-HF 試験では2型糖尿病患者および非糖尿病患者を含む患者層でダパグリフロジンの複合心エンドポイント(心血管死+心不全による入院)に対する有効性が報告されています。DAPA-CKD試験5)では腎機能低下を伴う2型糖尿病患者のみならず、非糖尿病患者32.5%を含めて、SGLT2阻害薬の腎機能と心血管疾患への影響を検討したはじめての試験になります。eGFRが30mL/min/1.73m2未満の高度腎機能低下患者が14.5%含まれていたことも特筆すべきでしょう。その結果、ダパグリフロジンeGFRの50%以上の持続的な低下、末期腎不全への進展、心血管死または腎臓死の主要複合エンドポイントを全体ではハザード比(HR) 0.61(プラセボ群に比し39%低い)と有意に減少させました(図3)。治療必要例数NNT(number needed to treat)は19でしたが、これは19人に投薬して1人のイベントを予防できるという治療効果を示す指標で、小さいほど有効性が高いのです。NNTが19ということは、ほぼ使わなきゃいけない有効性の高い薬と考えられます。しかも糖尿病合併患者のHR 0.64(95%CI: 0.52-0.79)だけでなく、非糖尿病患者でもHR 0.50(95%CI: 0.35-0.72)と驚異的な有意な低下が認められました。
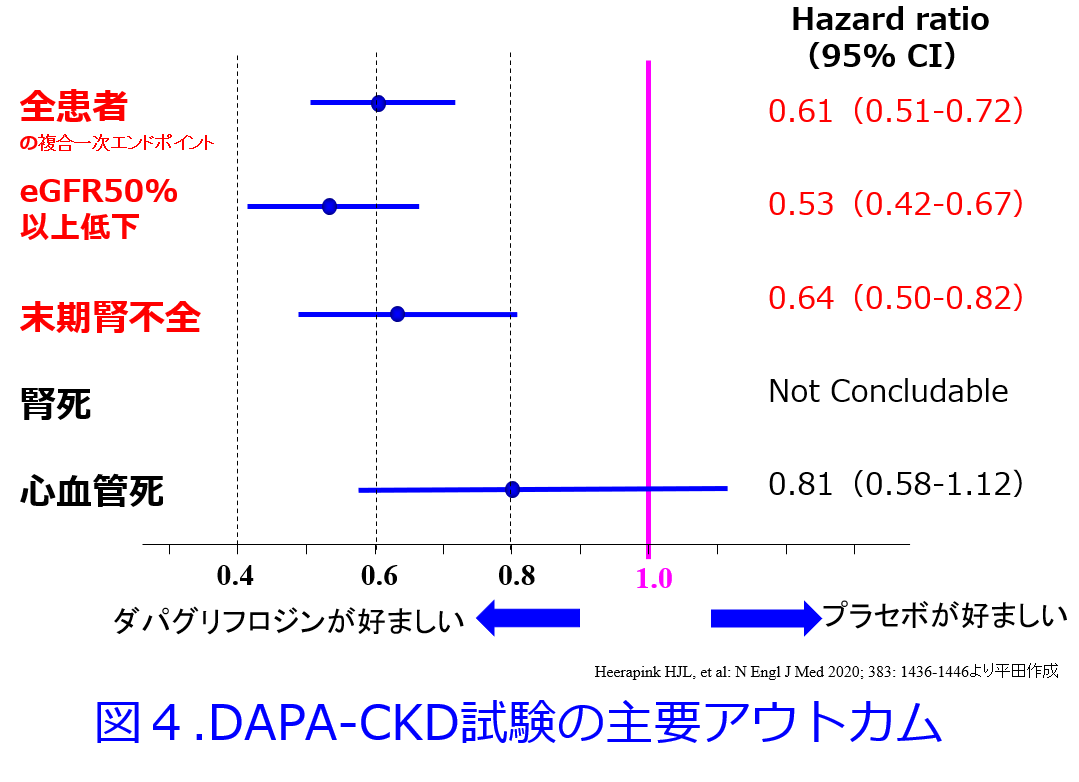
eGFRが50%以上低下した患者はHR 0.53と有意に減少しましたが、腎死はN数が少なかったため、検定できず、心血管死はHR 0.81でしたが有意ではありませんでした(図4)。二次エンドポイントである複合腎エンドポイントあるいは複合心エンドポイント(心血管死+心不全による入院)についても、ダパグリフロジンはHRをそれぞれ 0.56と0.71と有意に減少させました。初期に腎機能の低下があったものの、その後のeGFRの低下は緩徐で、他のSGLT2阻害薬と同様に約1年後にプラセボ群とeGFRの変化曲線が交叉し、以後は高いeGFRを保っていました(図5)。一次エンドポイントについて、糖尿病患者と非糖尿病患者で層別しても、HRは前述のように、それぞれ0.64と0.50であり、非糖尿病患者においても、ダパグリフロジンの腎・心保護作用が証明されたのです。またeGFR 45mL/min/1.73m2未満か以上か、アルブミン/gCr比 1000未満か、それ以上かで層別しても、両群でダパグリフロジンの腎・心保護作用に差異
はありませんでした。
引用文献
1)Zinman B, et al: N Engl J Med 373:2117-2128, 2015
2)Wannar C, et al: N Engl J Med 375:323-334, 2016
3)Brenner BM, et al: B Engl J Med 345: 861-869, 2002
4)田辺三菱株式会社: カナグルⓇ錠100mg医薬品インタビューフォーム, 2021年10月24日閲覧
5)Heerspink HJ, et al: N Engl J Med 383: 1436-1446, 2020
第9回 薬剤師塾 開催案内
第9回 基礎から学ぶ薬剤師塾 2022年1月4日(火)18時~20時まで の申し込みを始めます。テーマは「透析患者の薬~基礎編 病態と薬物療法~」です。
透析患者は高リン血症、二次性副甲状腺機能亢進症、腎性貧血、高カリウム血症、アシドーシス、尿毒症と腸内細菌叢の変化・腸腎連関、高血圧、低血圧、腸管穿孔と便秘といった様々な合併症とともに、栄養状態の不良、易感染性、高齢化など様々な問題を抱えています。薬物療法も複雑で多彩ですが、慢性腎不全の病態を知るためにはわかりやすい疾患です。今回は透析患者の病態とそれに対して用いられる薬物療法の基本について解説します。
参加を希望される方は 申し込みフォーム に記入のうえ、送信してください。
薬剤師塾への参加者はどなたでも構いませんが、ぜひ学会発表を目指している方に参加していただきたいと思います。そしてその先には原著論文を書き、海外の学会で発表し、英語論文をまとめて博士号を取るんだというような大きな夢を持つ人になっていただきたいと思います。300名まで参加可能ですが、最近の登録者数は200名を超えていますので、早めに登録してください。
★NSAIDsによる腎障害 テキストダウンロード
『NSAIDsによる腎障害 ~Triple whammyを防げ~』のテキスト(PDF)ダウンロードができます。
◆連載◆1日目 SGLT2阻害薬の登場と副作用報告
SGLT2阻害薬による心腎保護作用と急性腎障害抑制作用~ケトン体って何よ?~
1日目 SGLT2阻害薬の登場と副作用報告
(1)SGLT2阻害薬の驚異的な心・腎保護作用
ダパグリフロジンが非糖尿病心不全患者を含むDAPA-HF試験の結果を踏まえて2020年11月に慢性心不全(ヘフレフ HFrEF: heart failure with reduced ejection function左室駆出率の低下した慢性心不全)の適応症を取得しました。また非糖尿病CKD患者を含むDAPA-CKD試験によってRAS阻害薬との併用で腎機能の悪化、末期腎不全への進行、心血管死または腎不全による死亡のいずれかの発生による複合主要評価項目のリスクを、プラセボと比較して39%低下させ、全死亡の相対リスクを有意に31%低下させました。これらの試験結果から、アステラス製薬は2020年12月14日に糖尿病のないCKD患者への適応を申請していましたが、2021年8月25日にやっと「慢性腎臓病(ただし、末期腎不全又は透析施行中の患者を除く)」の効能又は効果の追加承認を取得しました。米国、EU、台湾などではすでに2型糖尿病合併の有無に関わらず、CKDの治療薬として承認を取得しています。これからわが国でも透析導入を防ぐ腎保護薬の決め手として積極的に使われていくものと考えられます。
ダパグリフロジンは慢性心不全の成人患者さんの治療薬としてはすでに承認されており、これから心不全・腎臓病治療が大きく変わると思われます。ダパグリフロジンだけではありません。エンパグリフロジン、カナグリフロジンなどのSGLT2阻害薬による心腎効果を検証した大規模臨床試験が多数報告され、それらのほとんどが既存の糖尿病治療薬、腎保護薬、心保護薬の概念を覆すくらいのクラスイフェクトの数々です。
これまで、HFpEF(ヘフペフ: heart failure with preserved ejection function:左心駆出率の保たれた心不全)は左心室が硬化して拡張できず、心臓へ血液が戻る力が弱くなるため、うっ血が起こり、むくみなどの症状が起こりやすいといった特徴があり、高齢者に多い心不全です。臨床的に有効と証明された治療法がなく、心血管領域で最大のアンメットニーズとされていましたが、2021年9月にはエンパグリフロジンが心不全だけではなく、HFpEFの治療薬(正確には治療補助薬ですが)としてFDAからブレークスルーセラピー(画期的治療)の指定を受けました。Walters Kluwer社のUpToDateⓇには「 2型糖尿病の有無にかかわらず、一貫してベネフィットが証明された」と記載されております。ということで今更ですが、今回は話題沸騰中のSGLT2阻害薬について解説したいと思います。
(2)SGLT2阻害薬の基礎知識
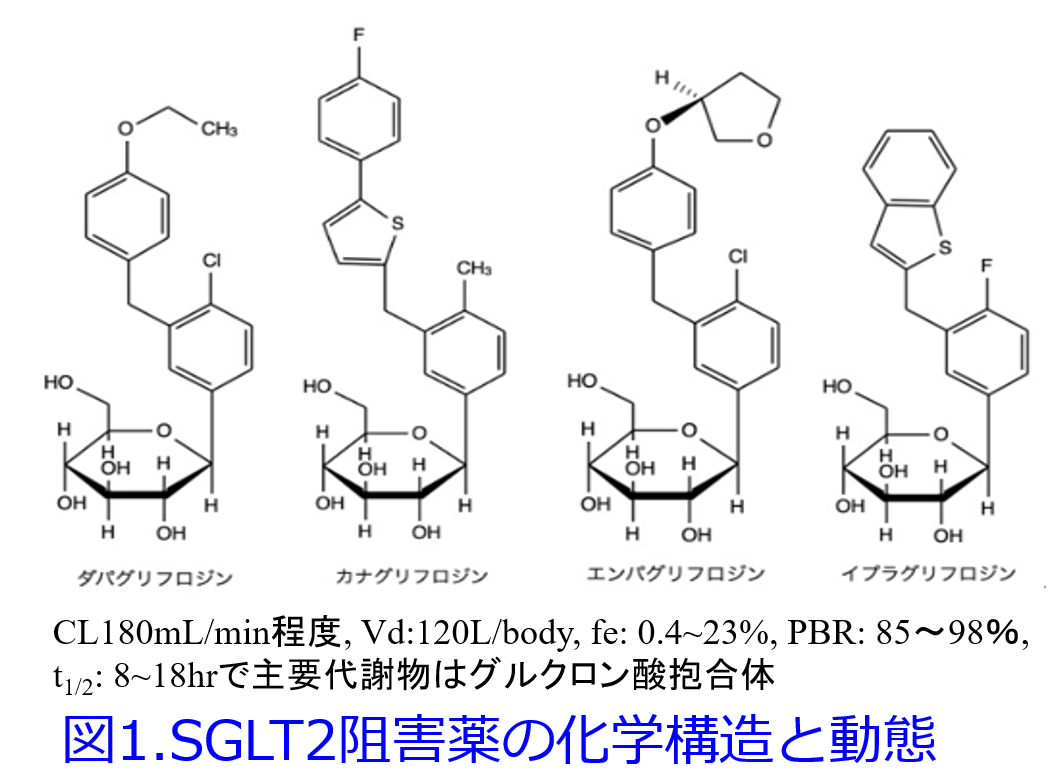
ブドウ糖は親水性の小分子化合物であるため、糸球体濾過されても受動拡散で再吸収することはできませんが、重要な栄養物であるため、近位尿細管の前半部(S1, S2セグメント)では輸送能力の高いトランスポータであるナトリウム-グルコース共輸送体2、つまりSGLT2(sodium/glucose co-transporter 2)によって90%が再吸収されます。残りの10%は近位尿細管の後半部のS3セグメントに存在するSGLT1によって再吸収されるため、健常者では尿中にブドウ糖が排泄されることはありません。ただしトランスポータはその基質濃度が上昇すると飽和するため、血糖値が170mg/dL以上になると、完全に再吸収することができなくなって尿糖が発現します。SGLT1は小腸にも発現しており、強く抑制すると下痢を起こしてしまうので、臨床使用するにはSGLT2選択性が高い必要があります。ブドウ糖を認識して再吸収するため、SGLT2阻害薬もブドウ糖構造を持っていることから(図1)、SGLT2がこれらの薬物をブドウ糖と誤認識して結合して、作用を表すと予測されます。要するにSGLT2阻害薬はブドウ糖を再吸収させずに、尿中にダダ洩れにして血糖値を下げる薬です。日本人で多い痩せた高齢者には使いにくいですが、前述の凄まじい心保護作用・腎保護作用から、使用量が増えつつあります。
SGLT2阻害薬の薬物動態学的特徴は蛋白結合率が82~98%と高く、尿中排泄率は0~22%と低いです。半減期は図1には載せておりませんが、トホグリフロジンが約5時間と短いのですが、そのほかは10~18時間なので、夜間頻尿を訴える患者にはトホグリフロジンが適しているかもしれません。ただしトホグリフロジンには今のところ2型糖尿病の適応しかありません。
(3)SGLT2阻害薬の安全性

SGLT2阻害薬は2014年に発売され、翌年1月にはSGLT2阻害薬投与中に下痢・嘔吐が頻回に発現していたが水分摂取が不十分であり、脱水によって死に至った症例、おそらくこれも脱水に起因する心筋梗塞や脳梗塞による死亡症例が新聞報道されました(図2)。脱水の原因として、SGLT2阻害薬併用時の下痢、嘔吐、入浴による発汗、利尿薬併用が脱水を助長することが原因と考えられています。発売当初から、メーカーから「適正使用のお願い」が発行され、水分摂取を心がけるよう注意喚起がされていましたが、SGLT2阻害薬の特徴的な副作用として利尿作用による脱水の助長、頻尿・多尿、皮膚乾燥に起因する発疹、大量のブドウ糖の尿中排泄による膀胱炎・性器感染症、サルコペニア、ケトアシドーシスなどがあげられています。そのため、投与を避けたい患者は認知症・うつでは特に摂食中枢の異常を起こしやすいので脱水になりやすい、両総頚動脈狭窄も脱水による脳梗塞になりやすい、下腿切断になると動けないので性器や尿路感染しやすいので避け、BMI 18.5未満のやせ、フレイル、サルコペニア患者なども投与を避けたい患者になります。
SGLT2阻害薬は特に投与初期に利尿作用があるため、RAS阻害薬、利尿薬、NSAIDsのTriple Whammy処方などとの併用はとても危険で、腎前性の急性腎障害を頻発するに違いないと、発売当初から平田は思っており、自ら作成した急性腎障害原因薬物一覧表の腎前性腎障害原因薬物の中にSGLT2阻害薬を明記しました。その後、FDAも2016年6月14日、2型糖尿病に対するSGLT2阻害薬のカナグリフロジンとダパグリフロジンの急性腎障害に関する安全性情報を発出し、添付文書に急性腎障害に関する警告を含めるよう指示を出しています。日本糖尿病学会はSGLT2阻害薬の適正使用のRecommendations1)として、特に後期高齢者には慎重に投与すること、脱水防止について患者に指導し、利尿薬の併用の場合には特に注意すること、発熱・下痢・嘔吐などがあるとき、ないしは食思不振で食事が十分摂れないような場合(シックデイ)には必ず休薬することなどが記載されています。このようにSGLT2阻害薬には利尿作用も降圧作作用もあるし、脱水もきたしやすいので、RAS阻害薬や利尿薬と同様に腎前性腎障害を起こすだろうということは誰もが予想していたと思います。
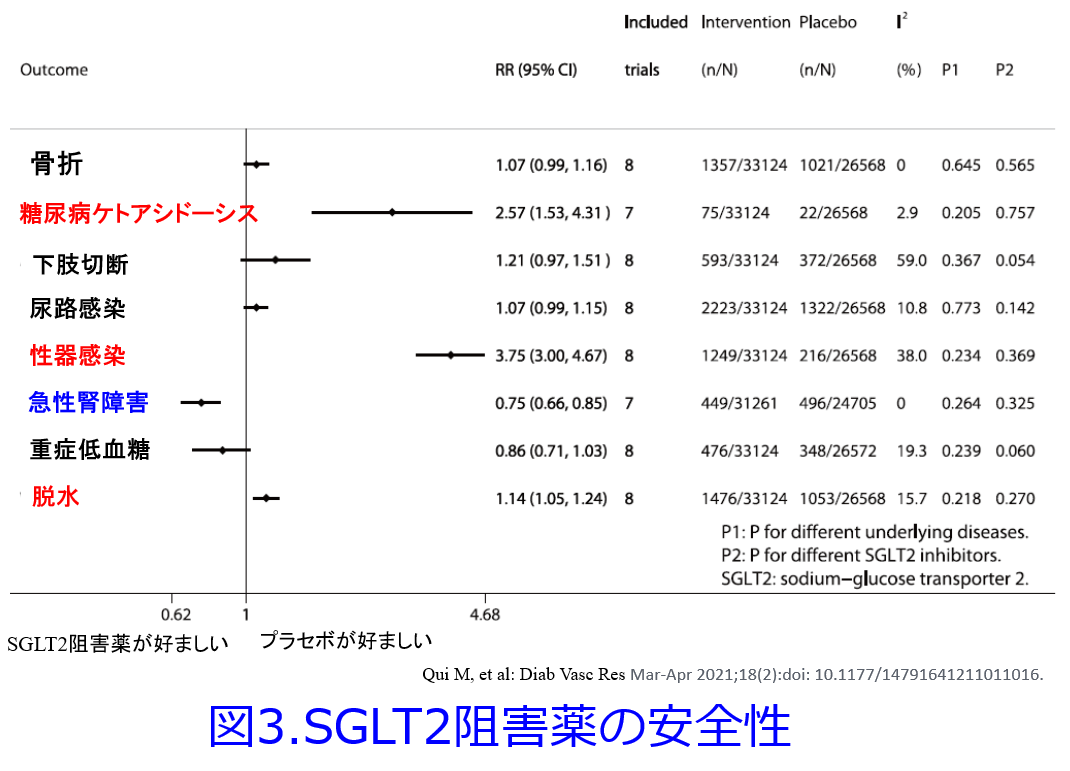
ということでSGLT2阻害薬についての最新の副作用の関する論文についてまとめてみました(図3)2)。8つの大規模試験をまとめたもので、赤色で書いてある糖尿病ケトアシドーシス、性器感染、脱水が統計的に有意に起こりやすい副作用と言えますが、発売当初から注目されていた低血糖や下肢切断、尿路感染は有意ではありません。急性腎障害(AKI)に関しては1をまたがず左側にありますし、RR(相対危険度)が0.75になっていますので、AKIはSGLT2阻害薬の投与によって有意に減少したといえます。「えぇっ!なんで?」と思う方がいると思いますが、実はSGLT2阻害薬がAKIを防ぐということは2016年ころから言われ続けています。今に始まったことではないのです。2019年以降になって、平田も薬剤性腎障害原因薬物一覧表からSGLT2阻害薬を削除しています。これについては4日目に詳述したいと思います。
引用文献
1)日本糖尿病学会: SGLT2阻害薬の適正使用のRecommendations 2020年12月25日.
2)Qui M, et al: Diab Vasc Res Mar-Apr 2021;18(2):doi: 10.1177/14791641211011016.

