◆連載◆4日目 SGLT2阻害薬の心・腎保護効果のメカニズムは?
SGLT2阻害薬による心腎保護作用と急性腎障害抑制作用~ケトン体って何よ?~
4日目 SGLT2阻害薬の心・腎保護効果のメカニズムは?
(1)SGLT2阻害薬の主作用は尿細管・糸球体フィードバックの正常化?
糖尿病ではSGLT2の発現量が増大しており、それによるブドウ糖・Naの再吸収の亢進につながり、尿細管・糸球体フィードバック(TGF: Tubuloglomerular feedback )の抑制を来たして、糖尿病初期の糸球体過剰濾過、GFRの上昇につながっているのを改善することが主要な薬理作用と考えられています。また糖毒性、つまり食後高血糖による血糖値の乱高下が動脈硬化や認知症を起こすのを軽減できる、あるいは利尿降圧作用によって心・腎の負荷を軽減するのは当然ですが、単に血糖降下作用、利尿降圧作用によるものではないことは、既存の血糖降下薬や降圧薬でこれほどまでの心・腎保護作用を示さなかったことからも明らかです。ほんの数カ月で対照群との差が明らかになり始めているので、SGLT2阻害薬による血糖低下を介した動脈硬化の抑制や長期的な病態の改善が心・腎保護作用につながっていると考えるのは不自然だと考えられます。またSGLT1は基本的に腎臓だけでなく小腸や心臓にも発現していますが、SGLT2は心臓にはほとんど発現していないので、SGLT2阻害が直接心不全改善につながらないのではという考え方もできます。さらに心筋細胞や血管内皮細胞・腎臓に直接作用しているだけであれば用量依存的になるはずですが、EMPA-REG OUTCOME試験以外の他の試験でも用量依存性は認められていません。
ただし2日目の図1,図5に示すようにGFRは一時的に低下しているため、RAS阻害薬と同様、糸球体過剰濾過を抑制してくれていることに間違いはありません。RAS阻害薬が輸出細動脈を拡張してGFRを低下させるのに対し、SGLT2阻害薬はTGFの障害を是正して、特に糖尿病性腎症初期に顕著な多飲・多尿および糸球体過剰濾過によるGFR高値、それに伴うアルブミン尿を是正する効果が期待できます(図1)。これに
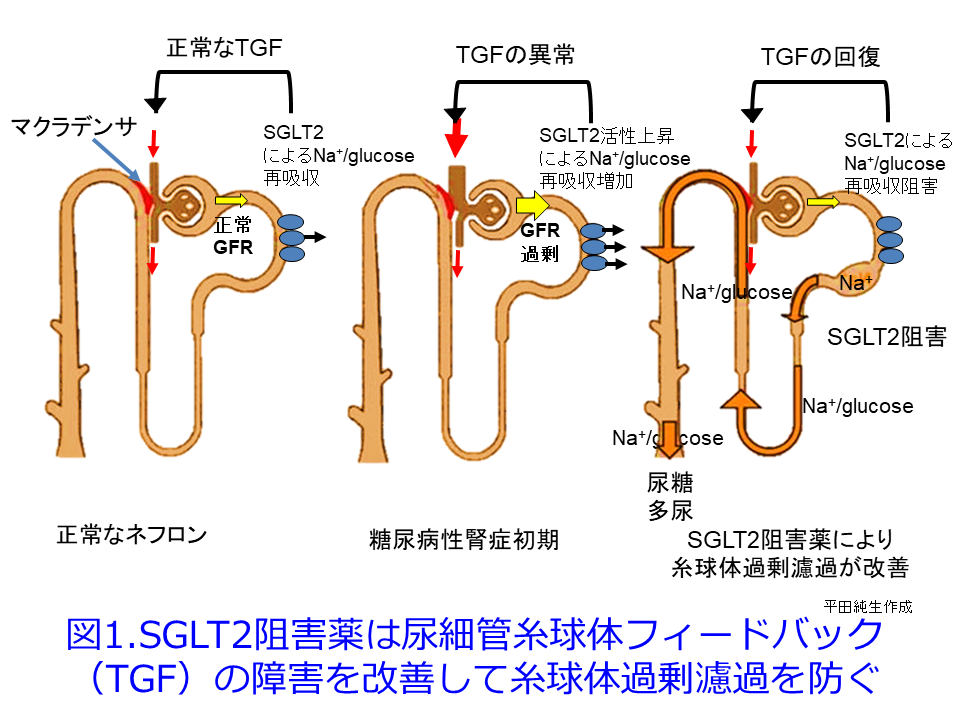
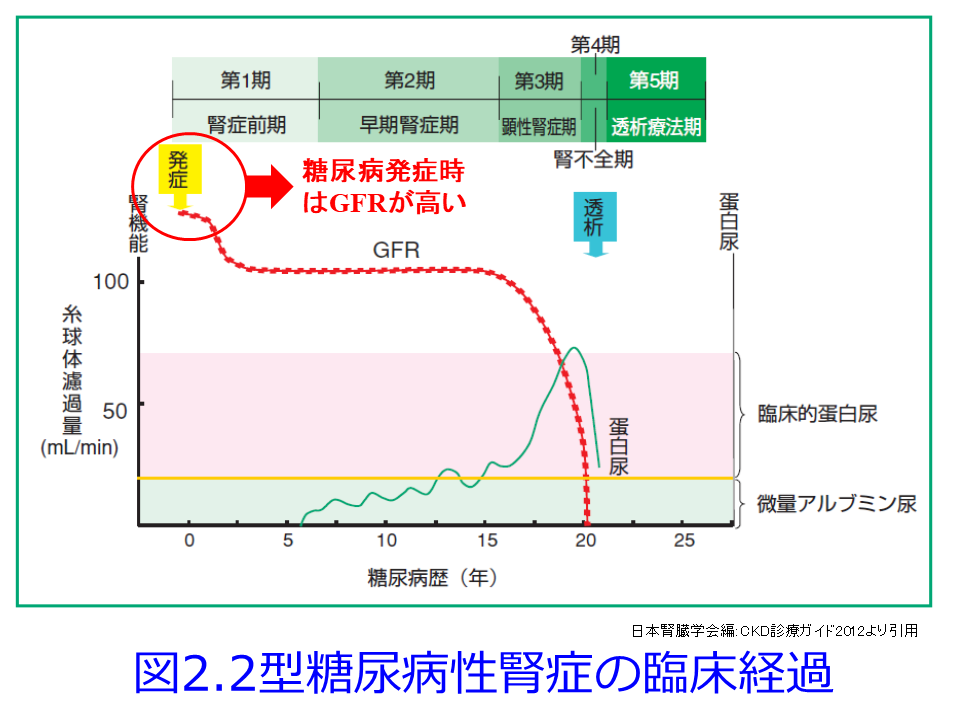
ついては図を用いて説明させていただきます。糖尿病性発症初期は高血糖のため多飲・多尿が続き、糸球体ろ過圧が高くなるためGFRが高くなってアルブミン尿も出やすく、その後に腎機能が悪化しやすくなります(図2)が、この典型的な糖尿病性腎症初期のGFRの上昇について考えてみましょう。血糖値が高い糖尿病発症初期には、SGLT2の活性が上昇してNa+/glucoseの再吸収を高めようとします。SGLT2はsodium-glucose cotransporter-2が正式名称で、ブドウ糖とNaを一緒に再吸収する役目を担っていますから、それにより遠位尿細管の塩濃度(正確にはCl–濃度)が低値となったことをマクラデンサ(緻密斑)がキャッチして、血管収縮物質のアデノシン分泌抑制を介して、輸入細動脈を拡張して糸球体濾過量を増やそうとするTGFの異常によって、多尿・多飲、腎機能(GFR)が高いという現象が起こります(図1中の図, 図2の赤丸)。
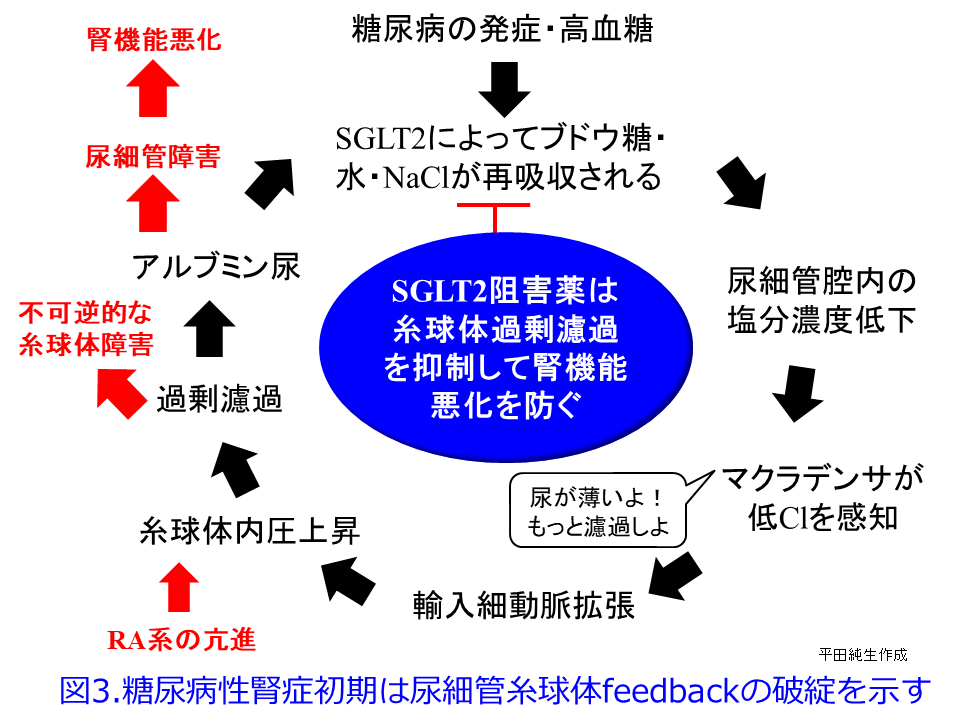
糖尿病患者にSGLT2阻害薬を投与するとNa+/glucoseの再吸収が阻害されるため、Na利尿・浸透圧利尿によって大量の尿糖が排泄されて血糖値を下げます。それとともに近位尿細管におけるSGLT2が阻害されているため、尿細管管腔中の塩濃度が高くなってTGFが正常化して糸球体過剰濾過が収まり、腎機能は一時低下するものの、長い目で見ると糸球体の過負荷が軽減されて腎機能の悪化速度が非常に緩徐になります。これが腎保護効果の1つのメカニズムと考えられています。このメカニズムは図3を見ると分かりやすくなると思います。平田の個人的な発想ですが、RAS阻害薬が無理やり輸出細動脈を拡張し、NSAIDsが輸入細動脈を無理やり収縮して、ともに糸球体内圧を下げてGFRを低下させるのに対して、SGLT2阻害薬は遠位尿細管のCl–濃度依存的に輸入細動脈を収縮させる方向に「調節」している点が異なるのではないかということです。つまりSGLT2阻害薬はRAS阻害薬やNSAIDsのような無理やりではなく、濾過量の増加の程度に応じて輸入細動脈を「調節」するために過度の虚血や腎機能低下にならない、つまりAKIを防いでくれているのではないかと思っています。
(2)糸球体過剰濾過の軽減による腎保護作用
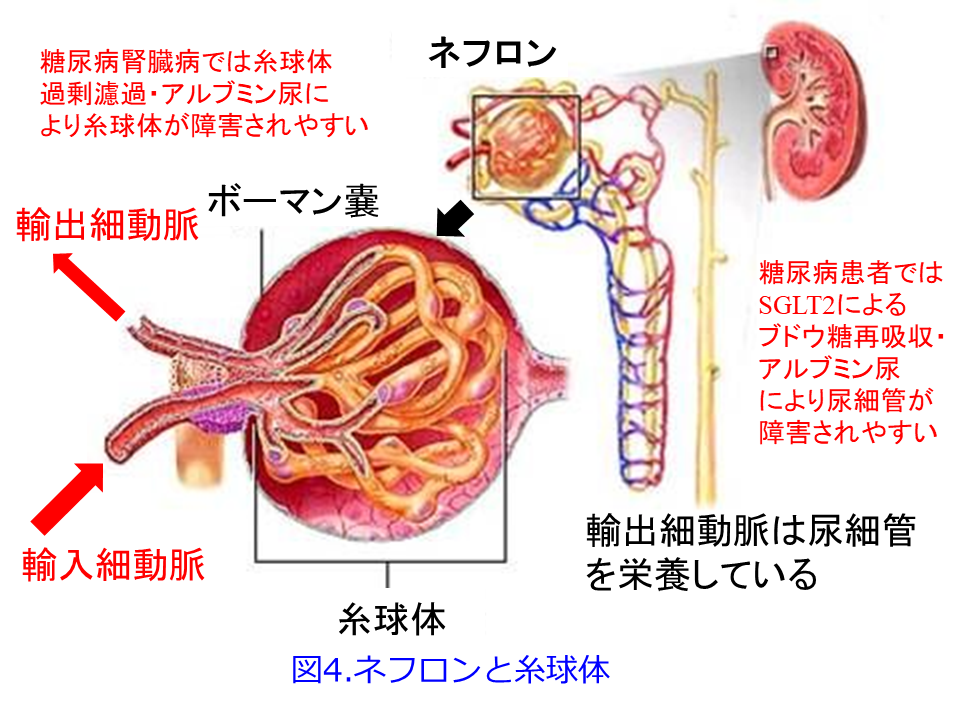
SGLT2阻害薬にはNa利尿作用+浸透圧利尿作用もあり、血圧も下げ、糖尿病腎臓病、あるいは減少したネフロンの糸球体の前負荷(図4の輸入細動脈)・後負荷(図4の輸出細動脈)を軽減することが期待できます。さらに大量のブドウ糖を尿中に排泄することによって全身の糖毒性(高血糖に伴うインスリン抵抗性、インスリン分泌能低下、動脈硬化、内臓脂肪の増加など)を低化させ、インスリン濃度が低下し、インスリン感受性を改善し、中性脂肪が低下し、体重が減少することもCKDの悪化を抑制することが期待できます。ただしSGLT2阻害薬が初めて注目されたEMPA-REG OUTCOME試験による心・腎イベント発生がエンパグリフロジン投与3 か月後から減少し(効果が出るのが早すぎる…)、3年後まで続くことが血糖や血圧の是正などでだけでは説明できません1)。
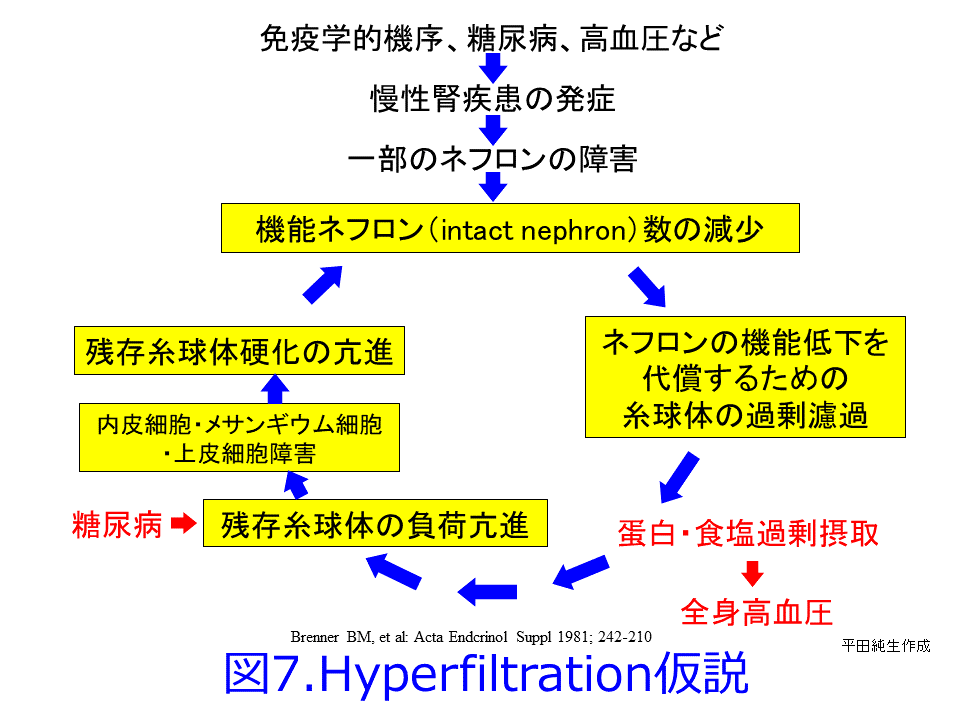
糸球体過剰濾過は糖尿病ではなくても、CKDになって機能するネフロン数が激減してくると(図6上)、RASが刺激され、残った機能ネフロンが機能しなくなったネフロンの分まで肩代わりしようとしてGFRを上げようとして(図6下)、腎小体が肥大して過剰濾過を起こし、さらにネフロン数が減少してしまうのと同じ現象です。糸球体高血圧は糸球体硬化を惹起して糸球体数が減少し、残存ネフロンの糸球体あたりの負荷が増大して肥大化して疲弊し(図5左、図6下)、食塩・蛋白質の過剰摂取によ
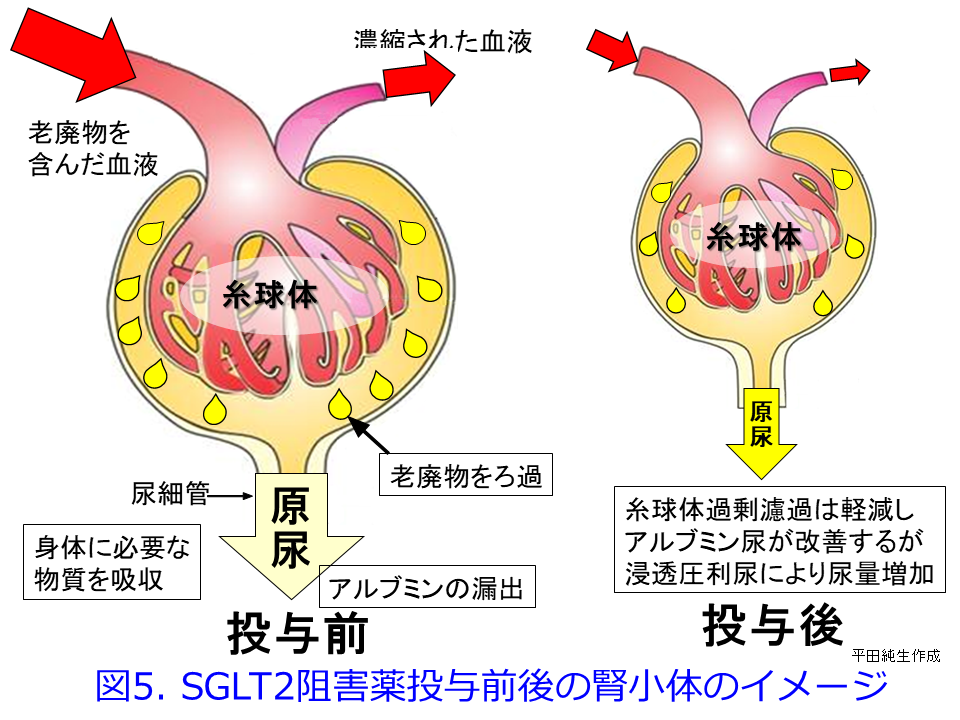
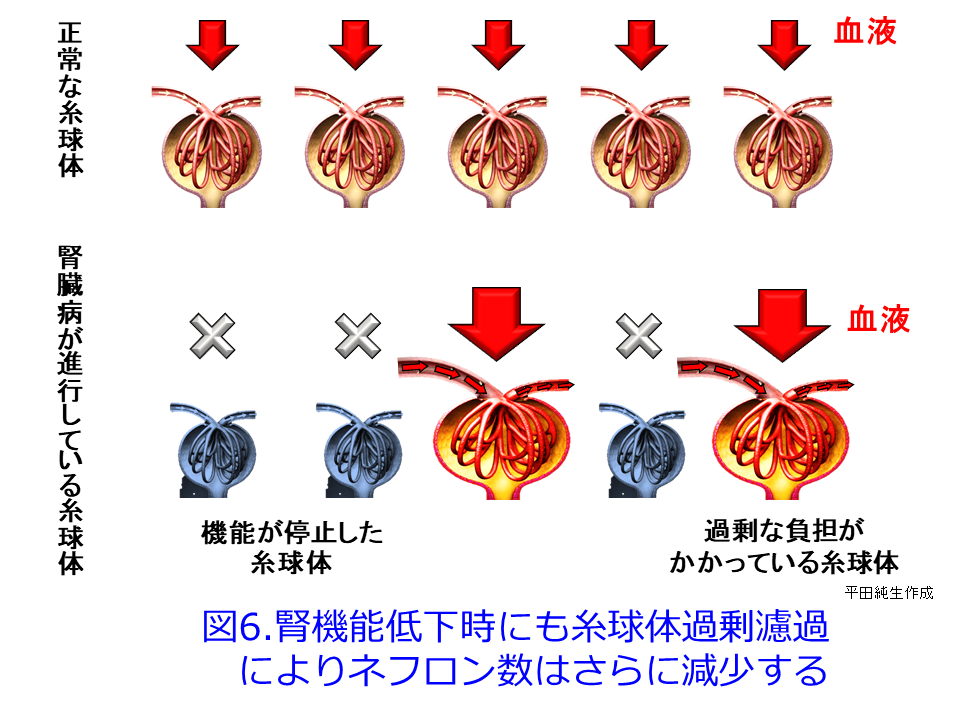
って、残存糸球体の負荷が増大して、機能ネフロン数はさらに減少するという悪循環であるhyperfiltration仮説(糸球体過剰濾過仮説)なのです(図7)。SGLT2阻害薬の腎保護作用のメインはこの糸球体高血圧による過剰濾過を正常化するとともに糸球体やメサンギウムの負荷を軽減し、アルブミン尿を減少させることが期待できますが(図1右および図5右)。それによって糸球体にかかる圧負荷を取り除いて糸球体を守り、尿細管が過剰にアルブミンを取り込んで、ライソゾームが破壊されるのを防いでいることと思われます。
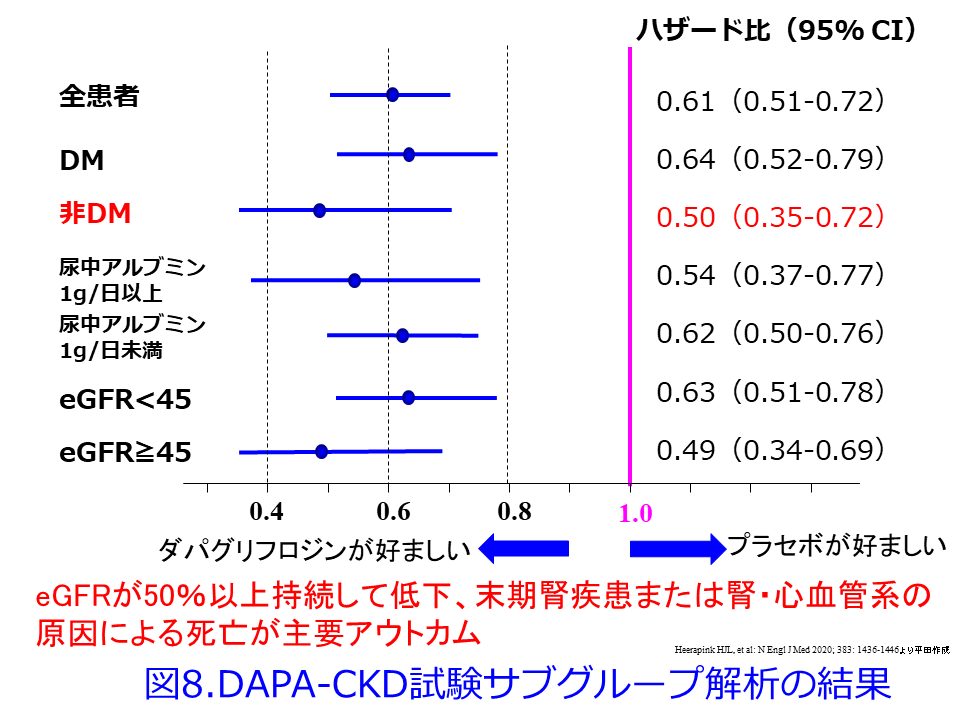
ただし非糖尿病CKD患者では尿細管糸球体フィードバックの改善度は糖尿病患者と比べると劣るはずです。DAPA-CKD試験では全患者での主要アウトカム(eGFRが50%以上持続して低下、末期腎疾患または腎・心血管系の原因による死亡)の軽減は39%でしたが、糖尿病よりもむしろ非糖尿病CKD患者の方がHRが低い、つまり糖尿病でのリスク軽減は36%に対し、非糖尿病でのリスク軽減が50%とむしろ高かった結果(図8)2)に対して、誰もが驚嘆したはずです。しかも尿中アルブミンの重さに関わらず、また腎機能の良否に関わらず、SGLT2阻害薬はまたしても有意に主要アウトカムの改善を示しています。
さらにDAPA-CKD試験のIgA腎症サブグループ解析では複合主要エンドポイントのHRは0.29(95%CI0.12-0.73、P=0.005)とリスクを71%減少させるという驚異的な結果が確認されました(図9)3)。IgA腎症は日本人で最も多い慢性糸球体腎炎で、血尿は多いものの蛋白尿はまれであるため、平田もSGLT2阻害薬がこれほどの効果を示すとは信じられませんでした。図9を一見すると大した結果じゃないように見えるかもしれませんが、HRが0.29では普通軸では表しにくいため対数軸を使っているためです。尿細管糸球体フィードバックの正常化による糸球体過剰濾過の改善だけではこれらの驚異的な結果を説明できません。この他にも、腎機能の悪化を抑制する強力なメカニズムがあるはずなのです。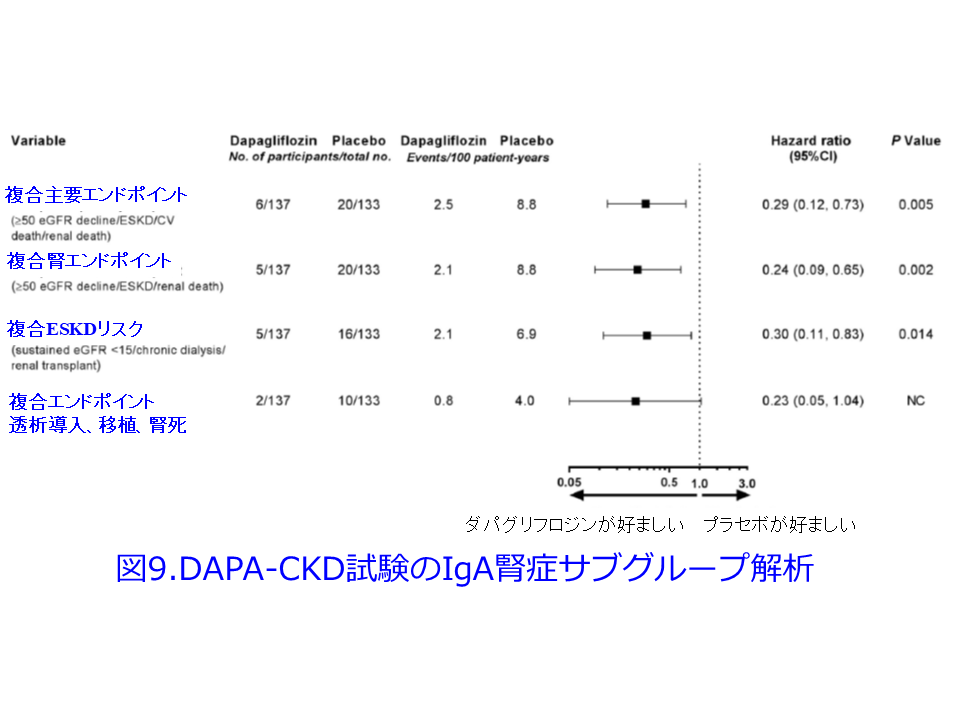
引用文献
1) Mudaliar S, et al: Diabetes Care 39: 1115-1122, 2016
2) Heerapink HJL, et al: N Engl J Med 383: 1436-1446, 2020
3) Wheeler DC, etal: Kidney Int 100: 215-224, 2021

