2021年5月
臨床で使用可能な薬物除去率予測式 Murakami&Hirata式について
はじめに
透析除去率の計算式、Murakami&Hirata式なるものを何の前触れもなく、2021年の初めに本ホームページに掲載しましたが、その紹介する文章が遅れて申し訳ありません。この式は、生体内の薬物量が1回の血液透析で何%除去されるかを正確に(今のところ)予測することができる式です。ようやく臨床使用に耐える予測式が完成し、Blood Purification誌に掲載されましたので、急ぎ、にホームページに掲載しましたが、それまでのいきさつ、薬物の透析性についてまとめてみました。
薬物の透析性
透析で除去されやすい薬は透析後に補充投与しないと効かなくなる。例えばアミノグリコシド系の抗菌薬は細胞外液のみに分布し、アルブミンなどの蛋白質にほとんど結合しないため、透析で半分以上が除去されてしまう。当然、濃度依存性の抗菌作用を示すこの抗菌薬の殺菌力は期待できなくなってしまうであろう。βラクタム系抗菌薬も細胞外液のみに分布するが、蛋白結合率(PBR)は薬によってさまざまだ。汎用されているカルバペネム系抗菌薬のメロペネムのPBRは5%足らずで、アミノグリコシド系と同様なので、半分以上は透析で抜ける。ただし第3世代セフェムのセフトリアキソンやセフォペラゾンのPBRは90%なので、ほぼ除去できないので透析後の追加投与は必要ない。グリコペプチド系のテイコプラニンのPBRは90%と高いだけではなく、分子量が1,564~1,894Da(6種の薬物の混合物である)と大きいため、主に拡散の原理によって生体内物質を除去する血液透析では全く除去できない。
薬物の透析性予測式なんて、必要ないと思っている方もいるかもしれないが、体中から抜けた薬物を抜けた分だけ補充する必要があるとすれば、「抜けやすい」「抜けにくい」だけではなく明確に何%抜けるという精度の高い予測式があれば、それは有用なものになるであろう。たとえば抗がん薬を透析患者に投与された報告は極めて乏しい。投与量も論文によって実にさまざまだ。そして透析による除去について体系的に言及された論文はさらに少ない、というかほとんどない。抗がん薬の場合、効きすぎれば、当然、有害反応が起こるであろうし、効かなければがんの悪化によって生死を分けるかもしれないのに、透析によってどれくらい除去されるかどうかについて分かっているものは、シスプラチンなど特殊な抗がん薬を除いてほとんどないのが現実だ。
米国では麻薬の濫用が大きな問題になっており、オピオイドの透析性についてはかなり探求されている。横紋筋融解症やQT延長といった重篤な副作用の多いメサドンに関しては、PBRが89.4%で分布容積(Vd)が1~8L/kgであることから、動態的に見て透析では抜けないことは明らかである(後述)。透析で抜けないという報告が古くからすでに複数あり1)2)、最近の報告ではメサドンの1日投与量の2.3%(範囲、1,25-3,70%)であったという報告3)や古い報告でも1%しか抜けないという報告4)があるにもかかわらず、メサドン専用の透析性の予測式を作ったという報告もあるが5)、ほとんど臨床的な価値はないと思う。
個々の薬物の透析性は論文になりやすいのだ。例えばAという新薬の透析性については検討がされていなければ、動態的には除去されないことが分かり切っていたとしても、医師が査読をすると「新規性がある」とみなされ、容易にアクセプトされる。そしてCHDならノイエス、CHDFの報告は初だからノイエス、CHFでもノイエス、CVVHDFでもノイエスとみなされアクセプトされる。もっとひどい文献だと、知りうる限り最大の分布容積の薬物「アミオダロンによる透析性」についての英語論文の査読を依頼されたことがあるが、本来、筆者は教育的な配慮からrejectしない方針であるが、さすがにこれは「透析で全く除去されないことは動態的に明らかなことなのに、数名の透析患者で頻回採血を行って透析性を調べた」ことは倫理的に間違っているということでrejectしたことがある。このように薬物個々の報告、様々な血液浄化法での報告もまた、あまたとあるが、このような報告を待たなくても、あるいは文献を検索しなくても、1つの予測性の高い式ができれば、有用なことは間違いないのだが、これに関する報告は極めて少ないのが現実なのだ。
薬物の透析性に関わる因子
1983年にKellerら6)がPBR, 分布容積の逆数(1/Vd), 分子量を基に薬物の透析性の予測式を作成したが、R2=0.27と低く、臨床では全く使えないものであった。ただしこの報告により薬物の透析性に関わる因子はPBRと分子量以外にも、Vdが重要であることが明らかにされた。
Vdは薬物の組織移行性を表す指標で、前述のようにアミノグリコシド系の抗菌薬やβラクタム系抗菌薬は親水性であるため細胞膜の脂質二重層を通過できないので細胞外液のみに分布する。細胞外液が体重の20%であるためこれらの薬物のVdは0.2~0.3L/kg(重症感染症では炎症によってアルブミンが間質液に漏出するため0.3L/kg近くになる)となるが、PBRが90%のセフォペラゾン、セフトリアキソンはアルブミンにトラップされているため、間質液内濃度は血清濃度の1/10になるので、Vdは0.2L/kg以下になる(図1)。 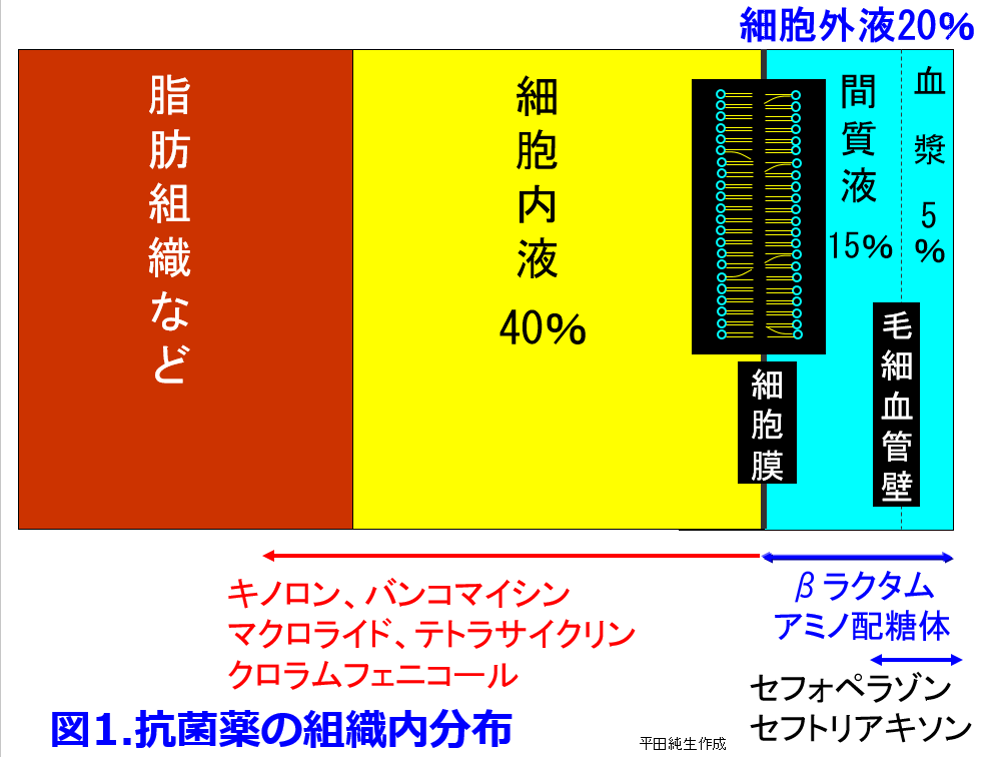
尿素、炭酸リチウム、エタノールなどは分子量が100Da以下の水溶性物質であるため、脂質二重層の細孔を自由に行き来できるため(図2)、細胞内液・細胞外液に均等に分布する。 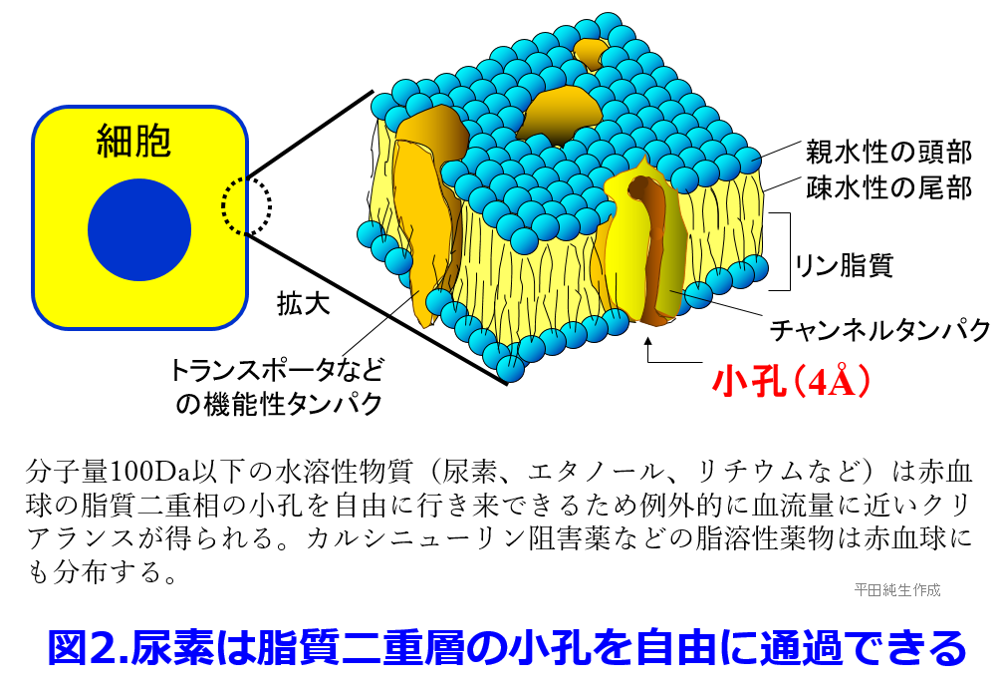 そのためこれらのVdは体内水分量に等しい0.6L/kgになり、これらの物質は分子量が小さいため拡散性能が極めて高く、血漿中だけでなく赤血球中からも除去可能である。
そのためこれらのVdは体内水分量に等しい0.6L/kgになり、これらの物質は分子量が小さいため拡散性能が極めて高く、血漿中だけでなく赤血球中からも除去可能である。
では強心配糖体のジゴキシンはどうだろうか?ジゴキシンはNa+-K+-ATPase阻害薬であるためこの酵素が多く存在する心筋や骨格筋に高濃度で分布し、心筋では血清濃度の30~70倍、骨格筋には10~20倍の高濃度で分布するため、血清濃度は相対的に低くなる。Vd=体内薬物量/血清薬物濃度で表されるため、ジゴキシンのVdは4~8L/kgと高い。血清及び間質液、つまり細胞外液を中心に浄化している血液透析だが、ジゴキシンは体内総量の4%しか細胞外液には存在しない(図3)。 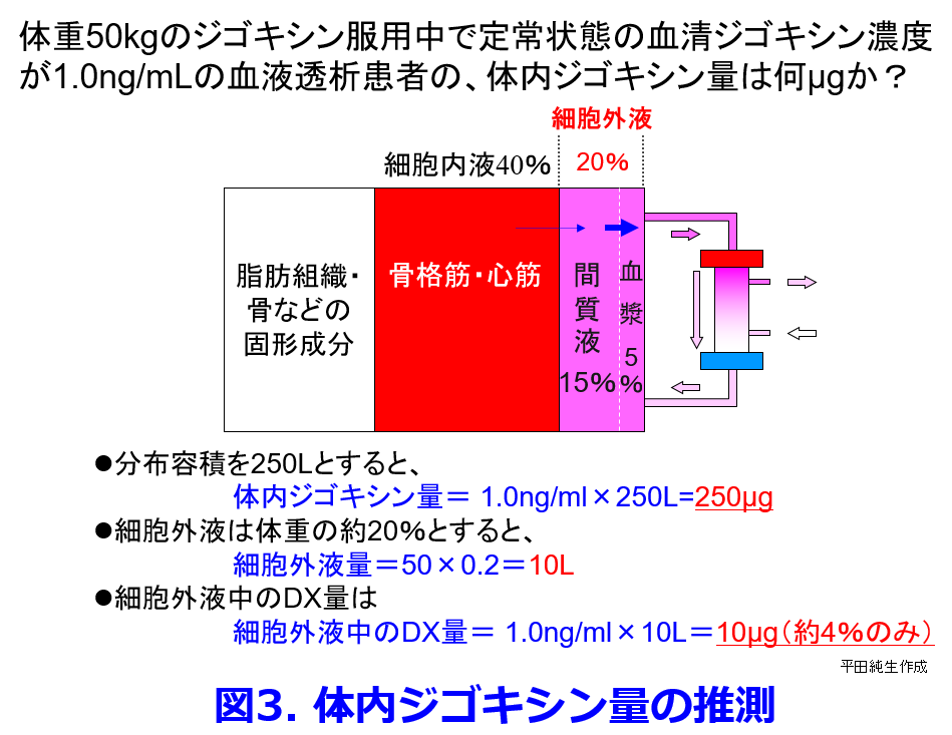 また組織から細胞外液へのジゴキシンの移行速度が透析による除去速度に比し極めて遅いため、Vdの大きいジゴキシンは透析では除去不可能だ。PBRが高くても活性炭による血液吸着や血漿交換によって除去可能であるが、Vdが大きい薬物は透析だけでなく、いかなる血液浄化法によっても除去されにくいのである。
また組織から細胞外液へのジゴキシンの移行速度が透析による除去速度に比し極めて遅いため、Vdの大きいジゴキシンは透析では除去不可能だ。PBRが高くても活性炭による血液吸着や血漿交換によって除去可能であるが、Vdが大きい薬物は透析だけでなく、いかなる血液浄化法によっても除去されにくいのである。
ただしVdが小さいと透析で除去されやすいかというと、そうではない。例えば動物実験で血漿量を測定するために用いられるアゾ染料のエバンスブルー(医療用ではない)は血漿中でアルブミンとの親和性が極めて高いためPBRが100%なので、Vdは0.05L/kgとVdの最小の薬物だし、分子量がアルブミンよりもはるかに大きい抗体製剤も0.05L/kgとVdは最小だが、透析で抜けるわけがない。ワルファリンのPBRは99%以上であるため、Vdは0.15L/kgと細胞外液量よりも小さい。NSAIDsのPBRは90%以上のものが多いが、イブプロフェン、ジクロフェナク、ナプロキセンのPBRは99%でVdは0.10~0.17L/kgとワルファリンとよく似ているが、PBR 93.1%のスリンダクのVdは2L/kgと大きい。Vdが小さくてもPBRが90%以上であれば透析によって全く抜けることはない。
血液透析で除去されにくい薬物
1997年に筆者は血液透析で除去されにくい薬物の共通点はPBRの高い薬物、脂溶性の高い薬物、腎排泄性の低い薬物、Vdが大きい薬物、分子量の大きい薬物であると推測した7)。さらに2004年に筆者は血液透析による除去率とVdの関係は図4に示すように双曲線を描くため8)、 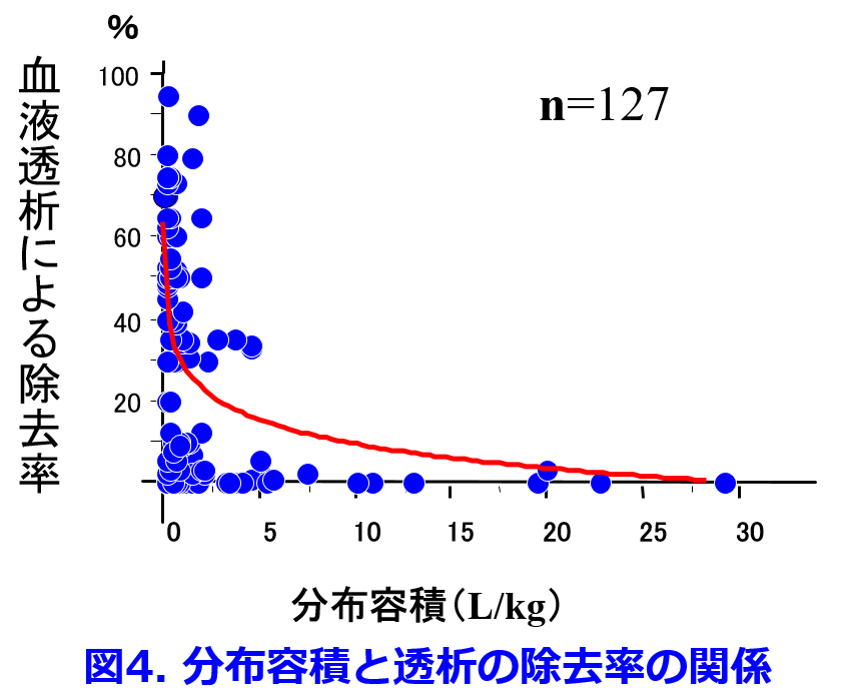 直線回帰では1/Vdの方が相関性は高くなるというKellerら6)の報告を再確認できた。そのうえで、
直線回帰では1/Vdの方が相関性は高くなるというKellerら6)の報告を再確認できた。そのうえで、
①PBR>90%以上の薬物は血液透析によって除去されない(図5)
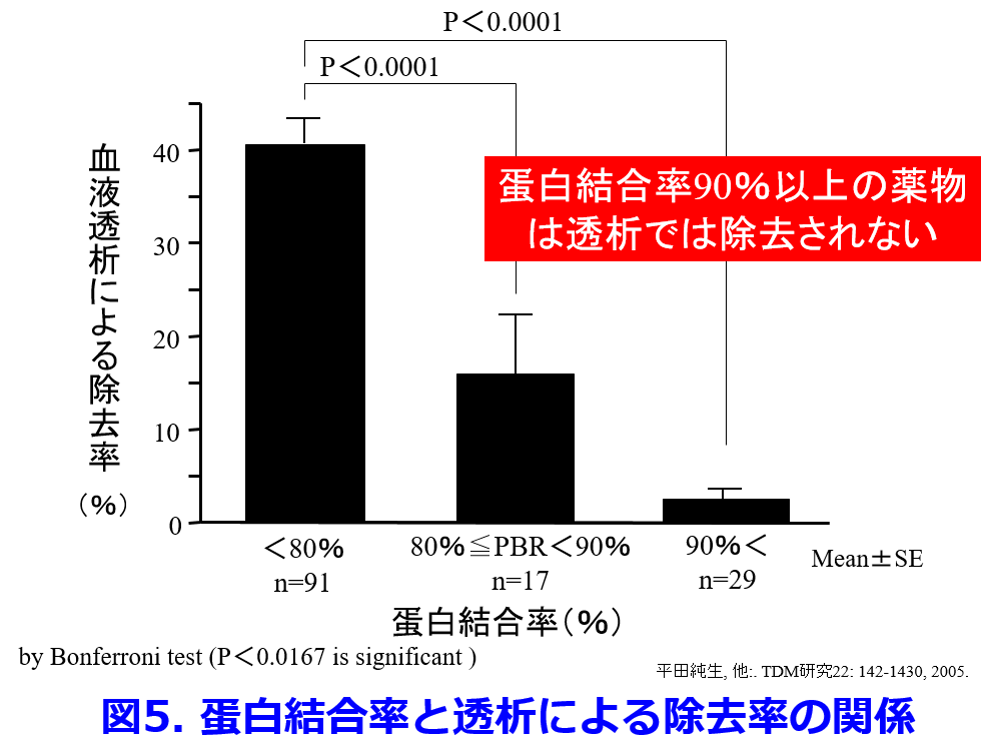 ②Vd>2.0L/kgの薬物は除去されにくい(図6)
②Vd>2.0L/kgの薬物は除去されにくい(図6)
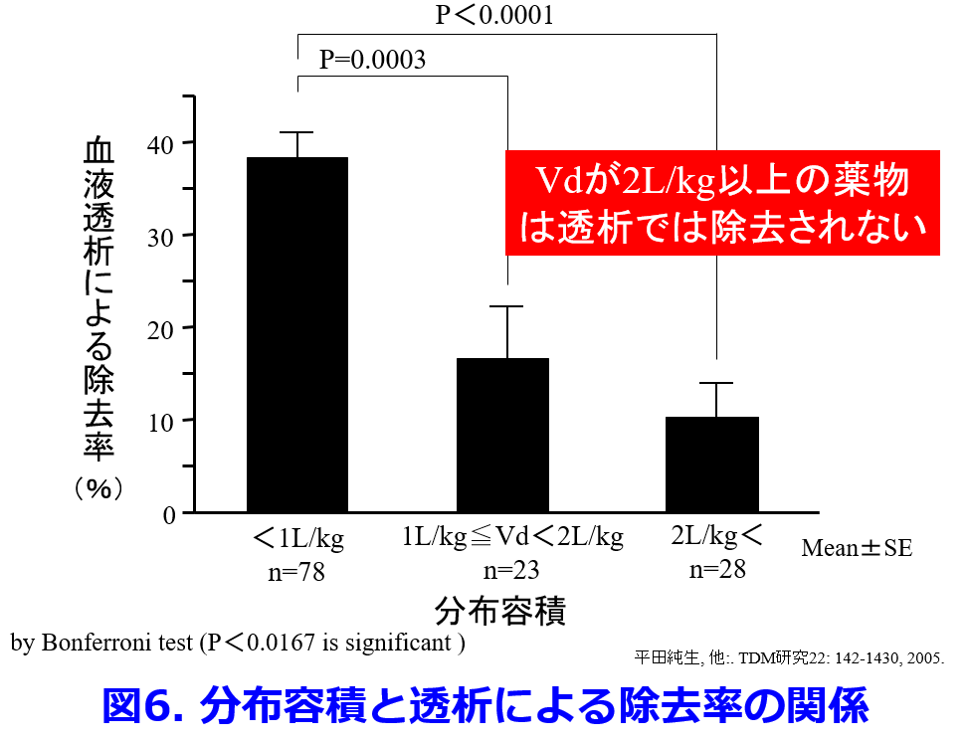 ③PBR>80%かつVd>1.0L/kgの薬物は除去されにくい(図7)
③PBR>80%かつVd>1.0L/kgの薬物は除去されにくい(図7)
ことを明らかにした9)。 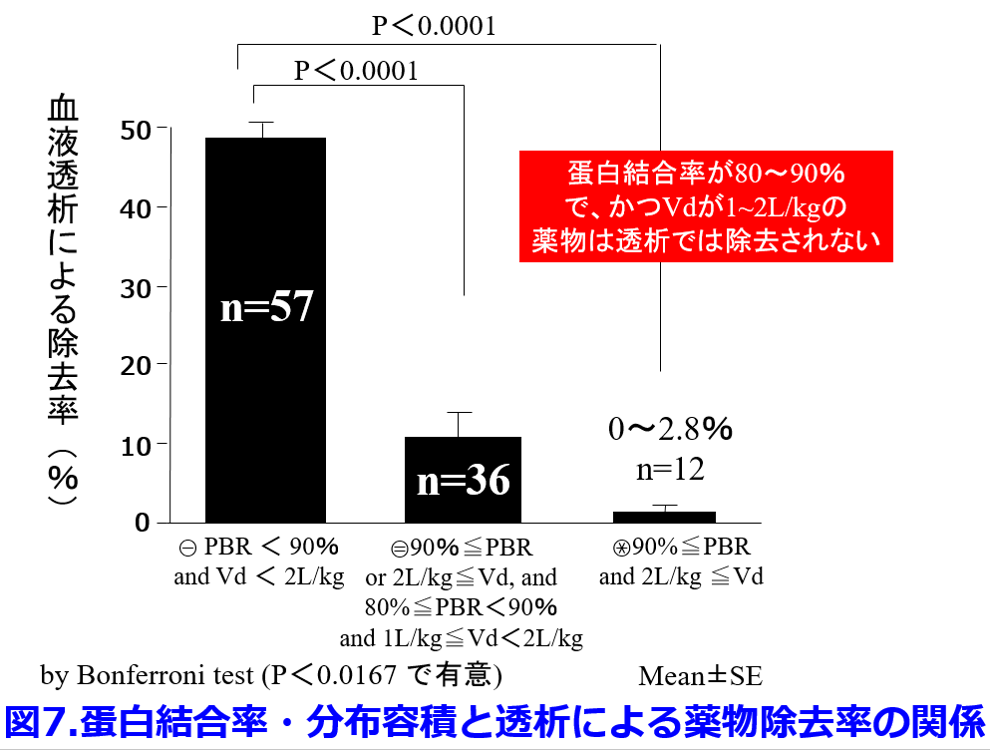
重回帰分析を行うとPBR、1/Vdは薬物の透析性に関与する有意な因子になったが、分子量は有意な因子ではなかった(表1)8)。 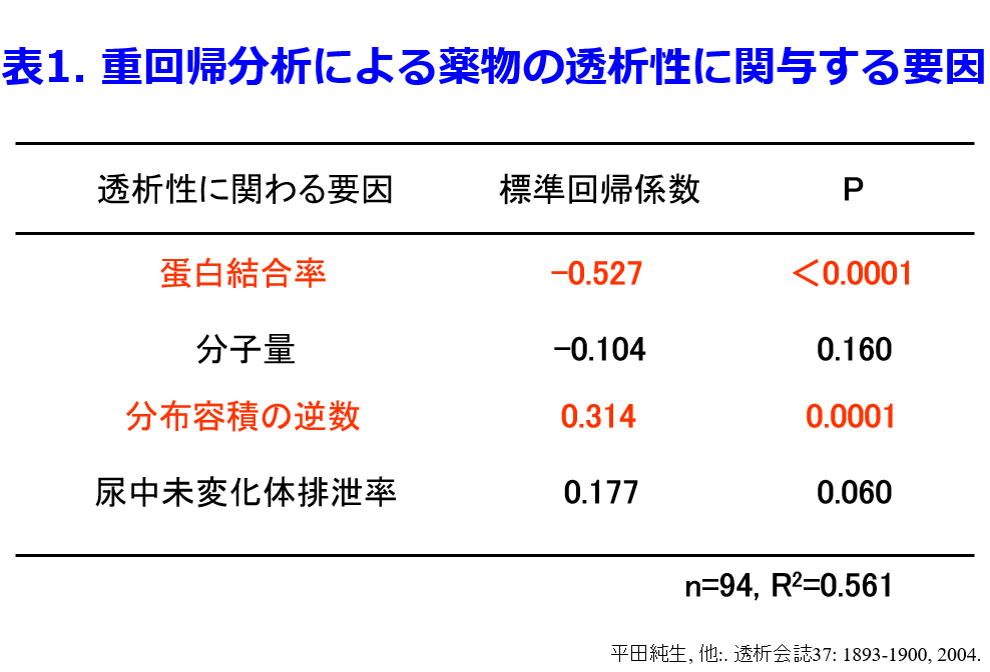 分子量と除去率の間に相関性は認められなかったものの(図8)、分子量の大きい薬物(MW>2,000)は拡散能が低いため除去されにくく、アルブミン以上の分子量の薬物(MW>66,000)は全く除去されないことは予測できた。
分子量と除去率の間に相関性は認められなかったものの(図8)、分子量の大きい薬物(MW>2,000)は拡散能が低いため除去されにくく、アルブミン以上の分子量の薬物(MW>66,000)は全く除去されないことは予測できた。 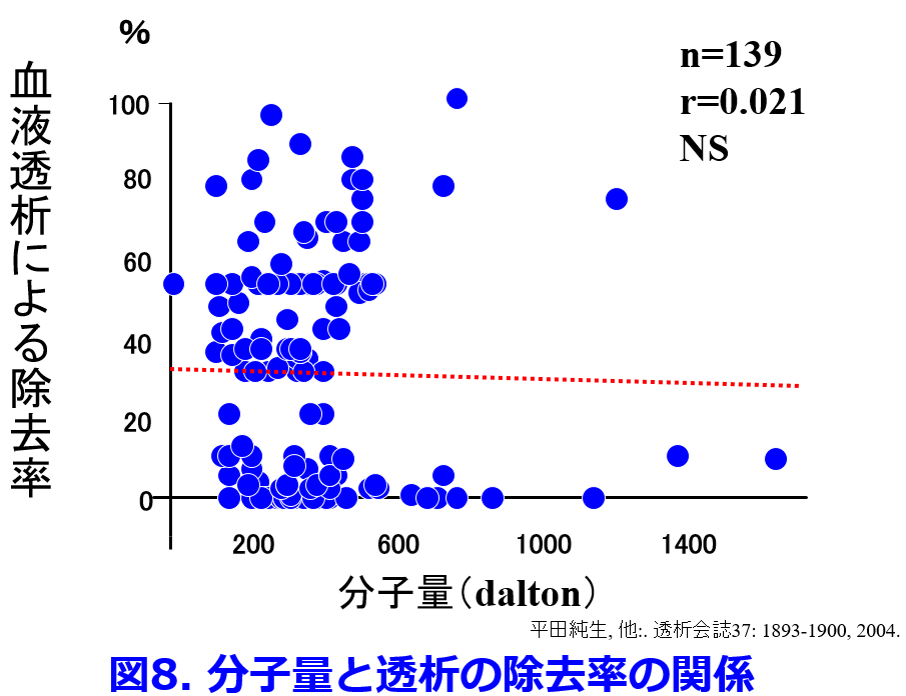 これらの取り組みによって透析によって抜けるか抜けないかを定性的に示すことはできるようになったが、透析による薬物除去率が何%で、透析後に薬物をどれだけ追加すべきかを推算する式、つまり定量的に推算できる薬物除去率推算式については、その後の浦田元樹博士、村上鞠奈氏の貢献が大きいが、その予測式の構築はややこしい話になるので、ここでは省略する。知りたい方は文献を読んでいただきたい10)11)。
これらの取り組みによって透析によって抜けるか抜けないかを定性的に示すことはできるようになったが、透析による薬物除去率が何%で、透析後に薬物をどれだけ追加すべきかを推算する式、つまり定量的に推算できる薬物除去率推算式については、その後の浦田元樹博士、村上鞠奈氏の貢献が大きいが、その予測式の構築はややこしい話になるので、ここでは省略する。知りたい方は文献を読んでいただきたい10)11)。
村上&平田式の予測性
薬物の特性を以下の特徴的な6つのカテゴリーに分類し、予測式に用いなかった薬物を主に用いてMH式による予測性を再確認した(図9)。  ①分子量100Da未満の水溶性物質は極めて除去されやすい、②PBRが低く水溶性の薬物で細胞外液のみに分布する薬物の除去率はとても高い、③水溶性の薬物で細胞外液のみに分布する薬物の除去率はPBRに依存して変化する、④Vdが小さいもののPBRが95%以上の脂溶性薬物は除去されない、⑤分子量が数万Da以上のものおよびPBR 100%の薬物は除去されない、⑥Vdが5L/kg以上の脂溶性薬物は除去されない。それぞれのカテゴリーに合致した特徴的な薬物でMW、PBR、fe、Vdの4つのパラメータが既知の薬物を2~3個ずつ、ランダムに示した。実測値と予測値の間にはy=1.009x-2.113でR2=0.924, P<0.0001の有意な正相関が認められた。
①分子量100Da未満の水溶性物質は極めて除去されやすい、②PBRが低く水溶性の薬物で細胞外液のみに分布する薬物の除去率はとても高い、③水溶性の薬物で細胞外液のみに分布する薬物の除去率はPBRに依存して変化する、④Vdが小さいもののPBRが95%以上の脂溶性薬物は除去されない、⑤分子量が数万Da以上のものおよびPBR 100%の薬物は除去されない、⑥Vdが5L/kg以上の脂溶性薬物は除去されない。それぞれのカテゴリーに合致した特徴的な薬物でMW、PBR、fe、Vdの4つのパラメータが既知の薬物を2~3個ずつ、ランダムに示した。実測値と予測値の間にはy=1.009x-2.113でR2=0.924, P<0.0001の有意な正相関が認められた。
Kellerら6)の予測式はR2=0.27、平田は定性的にHDで除去されない基準を作成した9)。そして浦田氏の簡易式の予測性はR2=0.64になり10)、MH式でR2=0.81に向上し11)、臨床使用可能な高い予測性を示すことができるようになった(図10)。

透析による薬物除去率予測式をどのように活用するか?
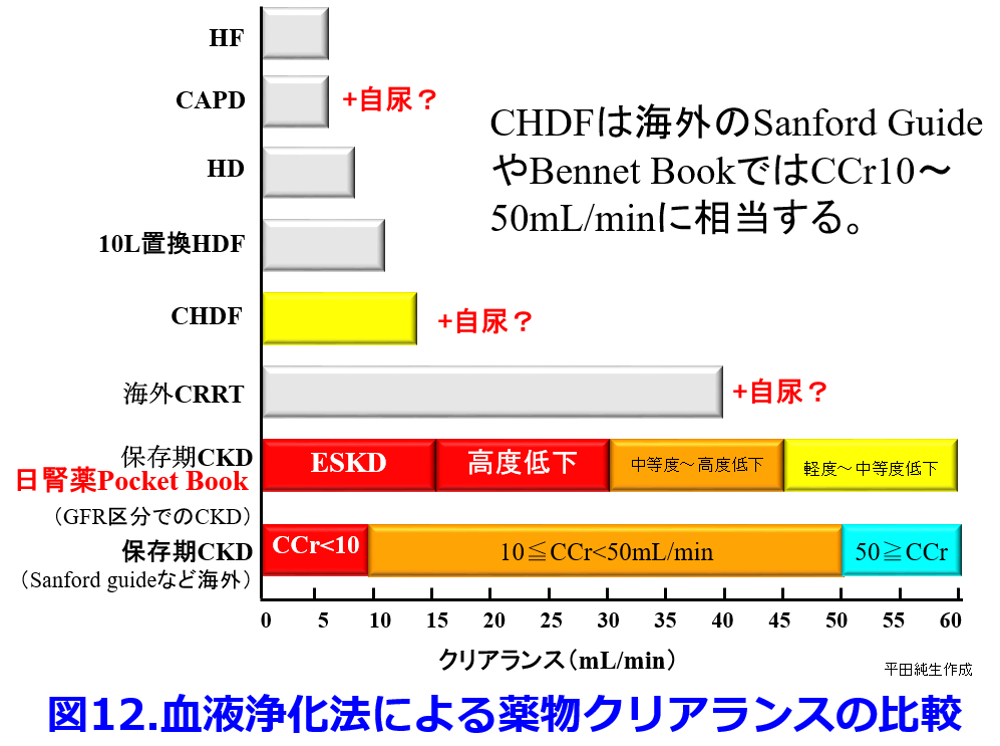
2020年9月に神戸国際会議場で開催された第66回化学療法学会学術大会のハイブリッド形式でのシンポジウムでは「SARS-COV-2感染症でCHDFを施行している患者にはアビガン?を多めに投与しているが、どれくらい量を投与したらよいかわからない」ということが話題になったが、MH式を使用する際に必要なVdが「0.34L/kg未満」となっているが、その値を代入すると透析による除去率は「少なくとも32.5%」と推算され(図11)、 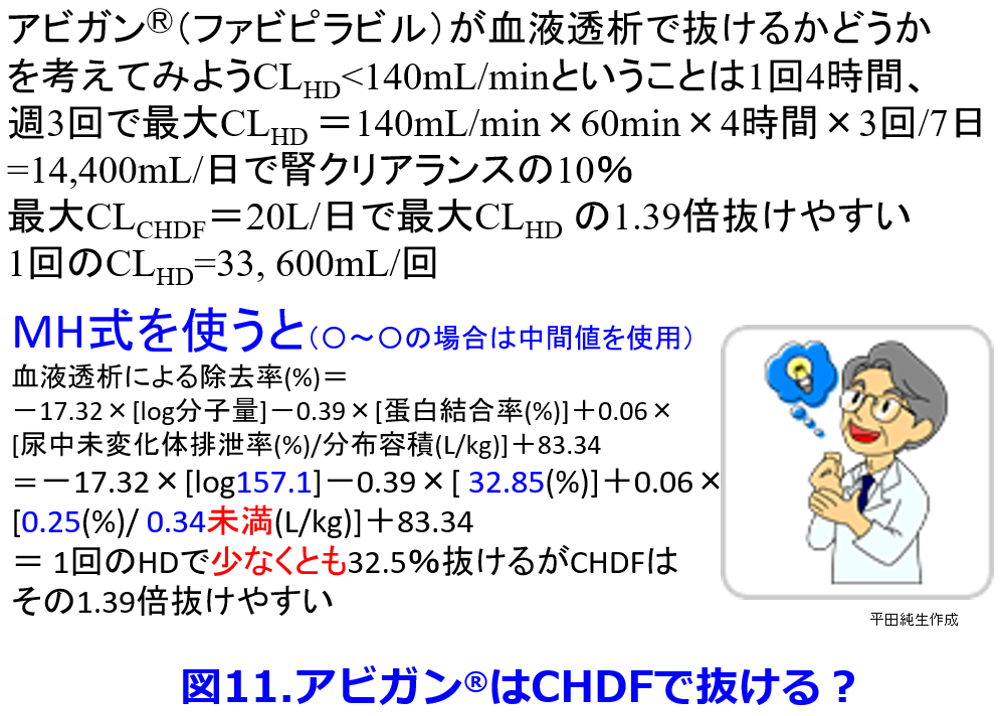 透析とCHDFのクリアランスを比べるとクレアチニンに関しては、透析療法は週に3回、1回4時間だが常時行われると仮定すると5~10mL/min、CHDFで13~14mL/min(尿量があればさらにクリアランスが高くなる)なので、CHDF患者では透析患者よりも多めに投与する必要があることが分かる(図12)。
透析とCHDFのクリアランスを比べるとクレアチニンに関しては、透析療法は週に3回、1回4時間だが常時行われると仮定すると5~10mL/min、CHDFで13~14mL/min(尿量があればさらにクリアランスが高くなる)なので、CHDF患者では透析患者よりも多めに投与する必要があることが分かる(図12)。
引用文献
1)Furlan V, et al: Methadone is poorly removed by haemodialysis. Nephrol Dial Transplant 14: 254-255, 1999
2)Perlman R, et al: Intradialytic clearance of opioids: methadone versus hydromorphone. Pain 154: 2794-2800, 2013
3)Opdal MS, et al: Effects of Hemodialysis on Methadone Pharmacokinetics and QTc. Clin Ther 37: 1594-1599, 2015
4)Kreek MJ, et al: Methadone use in patients with chronic renal disease. Drug Alcohol Depend 5: 197-205, 1980
5) Linares OA, et al: In silico ordinary differential equation/partial differential equation hemodialysis model estimates methadone removal during dialysis. Daly AL. J Pain Res. 8: 417-429, 2015
6) Keller F, Wilms H, Schultze G, Offerman G, Molzahn M: Effect of plasma protein binding, volume of distribution and molecular weight on the fraction of drugs eliminated by hemodialysis. Clin Nephrol 19: 201-205, 1983
7) 平田純生, 金 昌雄, 上野和行, 田中一彦: 薬物の透析性. TDM研究, 14: 277-287, 1997
8) 平田純生, 和泉 智, 古久保拓, 太田美由希, 藤田みのり, 山川智之: 血液透析による薬物除去率に影響する要因. 透析会誌37: 1893-1900, 2004
9) 平田純生, 和泉 智, 古久保拓, 太田美由希, 藤田みのり, 山川智之: 血液透析による薬物除去率に影響する要因. TDM研究22: 142-1430, 2005
10) Urata M, Narita Y, Fukunaga M, Kadowaki D, Hirata S: A simple formula for predicting drug removal rates during hemodialysis. Ther Apher Dial 22: 485-493, 2018
11) Murakami M, Narita Y, Urata M, Ichigi M, Nakatani S, Fukunaga F, Kondo Y, Ishitsuka Y, Irie T, Kadowaki D, Hirata S: Revised Formula for Predicting Hemodialyzability of intravenous and oral drugs. Bllod Purif 9: 1-11, 2021
腸内細菌叢の改善は腎機能悪化を防ぐ
腎機能をよくするための薬に食塩やNSAID?
腎機能は基本的に良くはならない。腎臓の糸球体の一部は再生できないからだ。ただし見かけの腎血流を一時的に高めれてやれば腎機能は改善したように見える。例えば終戦直後には腎機能をよくするためにその当時の医師は食塩摂取を勧めたそうだ。これによって循環血漿量が増え(腎臓への負荷をかけて)、糸球体内圧が上がってGFRが上がる。それによって一時的に血清クレアチニン値が下がれば、腎機能がよくなったように見えるのだ。ただし食塩摂取は長い目で見て血圧が上がり腎臓への負担を上げて、長い目で見ると腎機能は悪くなるだけでなく、高血圧を助長して心血管病、特に脳出血を増やすことはよく知られている。
これは良かれと思って慢性心不全にカテコラミンなどのβ刺激薬などの強心薬を用いると一時的に心機能は良くなるものの、長い目で見ると心臓の負荷が増大して予後が悪化する治療法によく似ている。現在は慢性心不全には「逆転の発想」でβ遮断薬を用いて前負荷を軽減して心臓を休ませ、レニン-アンジオテンシン系阻害薬を用いて後負荷・前負荷を軽減する薬物療法が主流になっている(図1)。 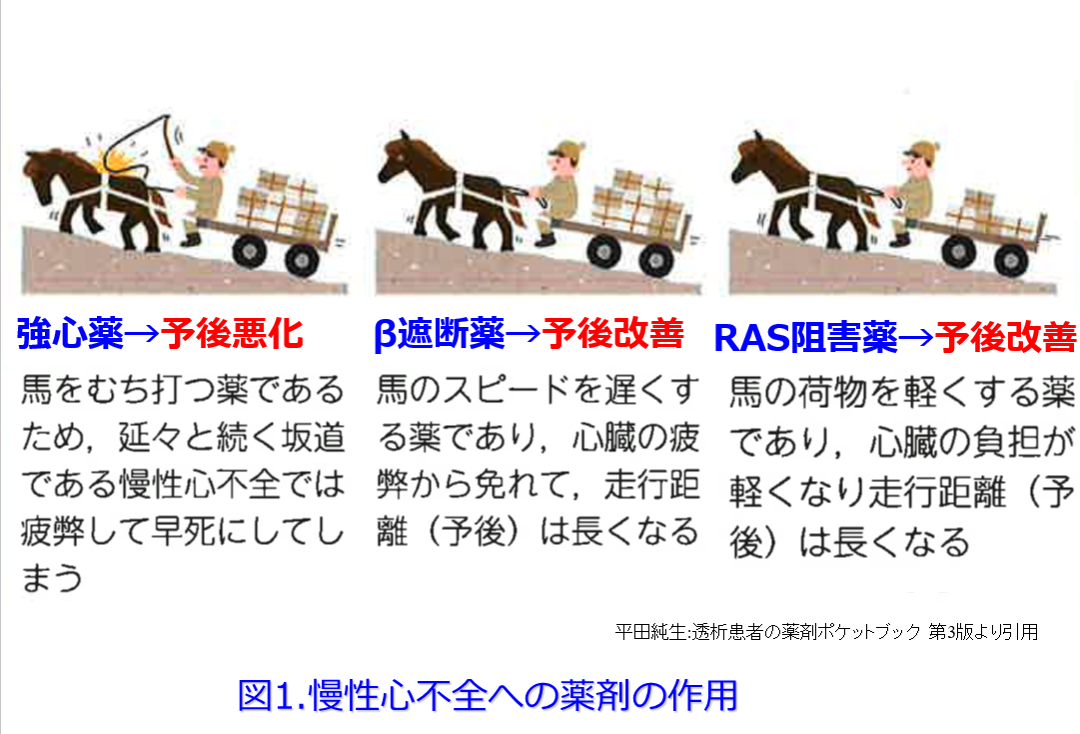
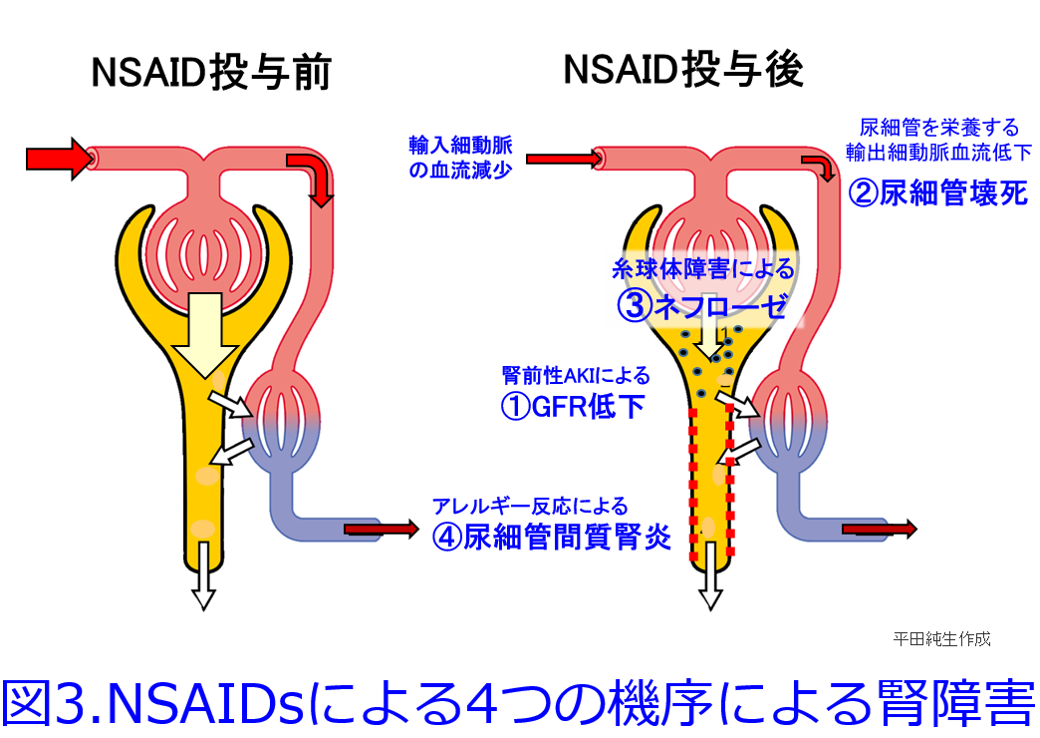
筆者が新米薬剤師のころ、つまり1980年前後にはネフローゼ症候群で蛋白尿を抑制するためにNSAIDのインドメタシンが用いられていたし、「今日の治療指針」にも書かれていた。確かにNSAIDは輸入細動脈を収縮することによって糸球体内圧を下げるので、蛋白尿は減少するはずだ。RAS阻害薬が輸出細動脈を拡張して、糸球体内圧を下げて(腎臓への負荷を軽減して)、蛋白尿を減少させるのと似た考え方だ(図2)。 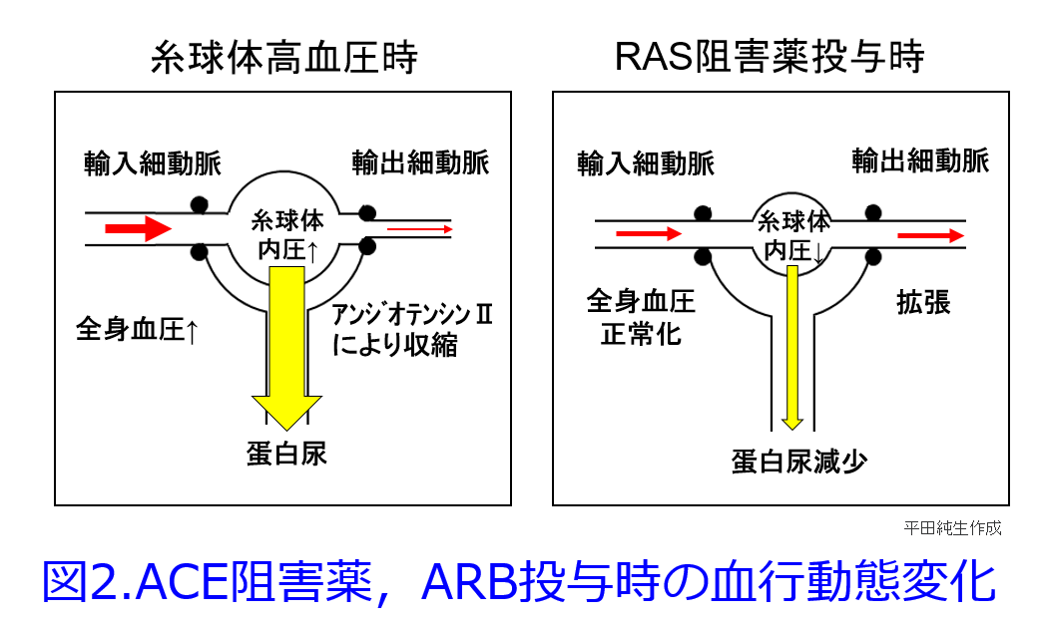 しかし休ませすぎると腎虚血によって急性腎障害になりやすい要注意の薬物なので、RAS阻害薬は蛋白尿のある患者にはとても効果的だが、蛋白尿のない症例ではうまく使わないと腎機能を悪化させてしまうことがある。NSAIDsは①輸入細動脈の血流減少によって腎前性急性腎障害の原因薬物になるだけではなく、②脱水時などにも連用すれば尿細管を栄養する輸出細動脈の血流が著明に低下すると重篤な尿細管壊死に至ることもあるし、③糸球体障害によるネフローゼをきたすこともあり、アレルゲン性の高い薬物であるため④アレルギー反応による尿細管間質性腎炎をきたすこともあるため、腎機能をよくする薬物にはなりえないのだ(図3)。
しかし休ませすぎると腎虚血によって急性腎障害になりやすい要注意の薬物なので、RAS阻害薬は蛋白尿のある患者にはとても効果的だが、蛋白尿のない症例ではうまく使わないと腎機能を悪化させてしまうことがある。NSAIDsは①輸入細動脈の血流減少によって腎前性急性腎障害の原因薬物になるだけではなく、②脱水時などにも連用すれば尿細管を栄養する輸出細動脈の血流が著明に低下すると重篤な尿細管壊死に至ることもあるし、③糸球体障害によるネフローゼをきたすこともあり、アレルゲン性の高い薬物であるため④アレルギー反応による尿細管間質性腎炎をきたすこともあるため、腎機能をよくする薬物にはなりえないのだ(図3)。
低栄養高齢者への低たんぱく療法の是非
炭水化物や脂肪はエネルギーを産生するとH2OとC2Oになるクリーンな栄養素だが、たんぱく質は尿素やクレアチニンといった老廃物、つまり燃えカスができる。このような尿毒素が腎不全になると蓄積して尿毒症を起こし、腎機能を悪化させる。老廃物の蓄積を抑えるためにはその発生源となるたんぱく質を制限すればよいのだが、制限しすぎると栄養状態が悪化する。CKD患者のほとんどが高齢者であり、加齢に伴い筋肉が脂肪に置き換わり、筋力が低下し活動が低下してエネルギーの消費をしなくなるから食事量が減少すると、蛋白異化が亢進してさらに筋肉量が減ってサルコペニアになってしまうというフレイルサイクルに陥ってしまう(図4)。 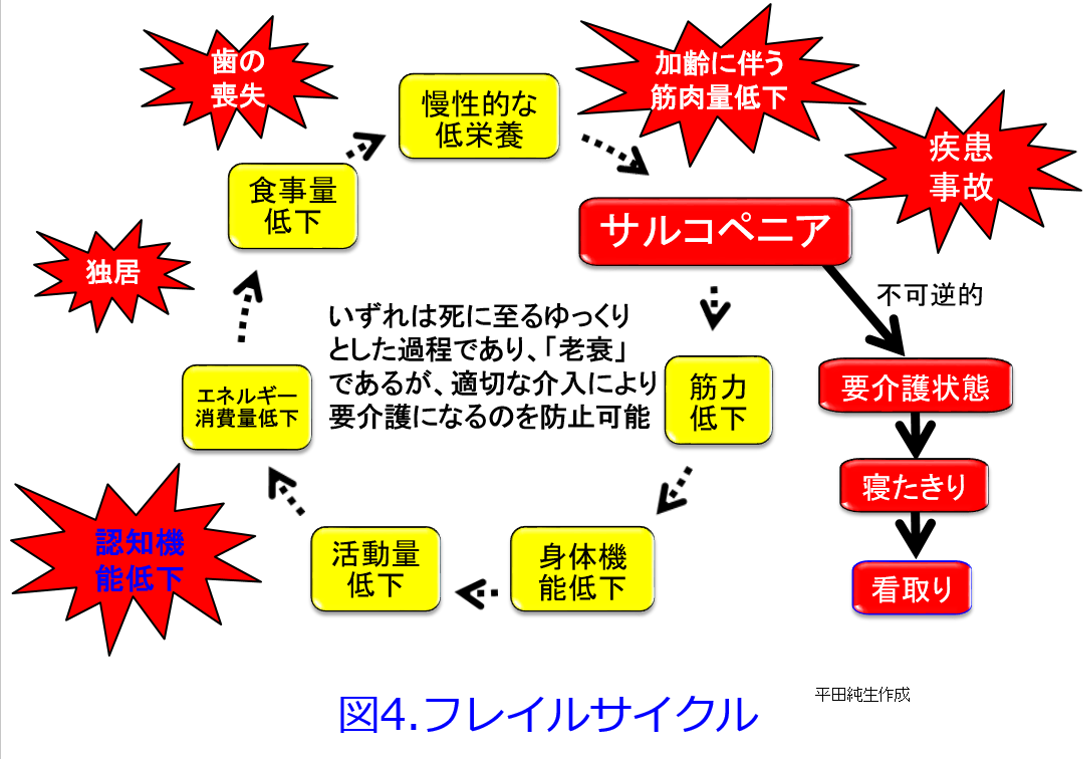 低栄養は免疫能の低下も引き起こすから肺炎の死亡率順位は加齢とともに上がってゆく(表1)。
低栄養は免疫能の低下も引き起こすから肺炎の死亡率順位は加齢とともに上がってゆく(表1)。 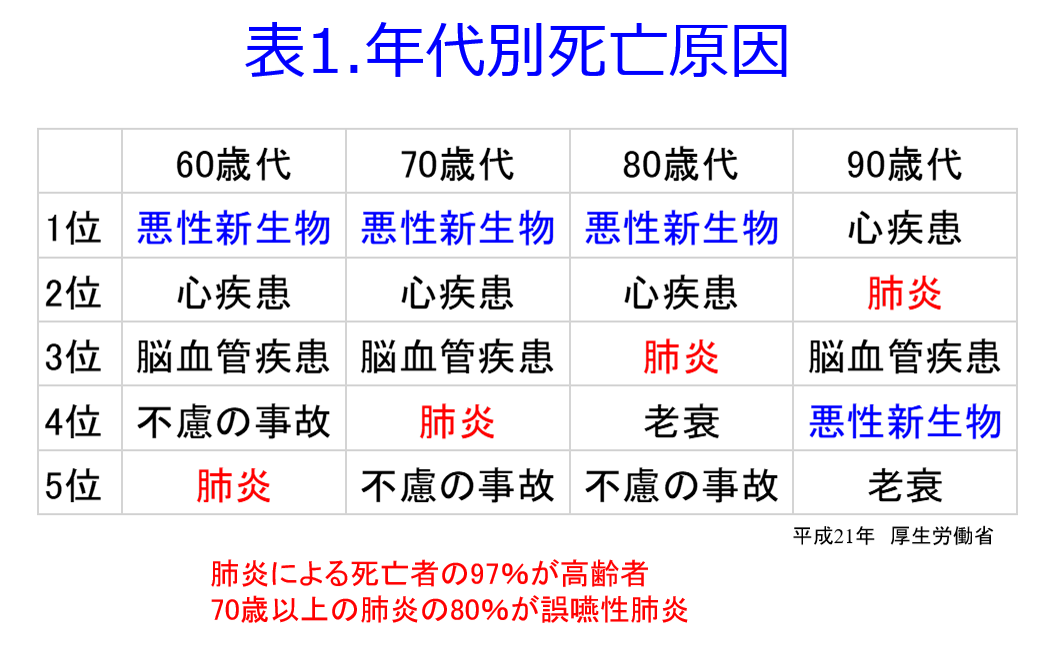 腎機能の悪化を防ぐにはたんぱく質摂取制限は重要な治療法ではあるが、低栄養状態の高齢者となると非常に悩ましい。一般的にはCKDステージ3aでは0.8~1.0 g/kg・標準体重/日、CKDステージ3b以降では0.6~0.8 g/kg・標準体重/日の摂取制限が推奨されている。高齢 CKD 患者においては、CKDステージ4~5 であっても十分な余命が見込まれる場合においてのみ、現状の BMI を維持すべき十分なエネルギー量を確保した上で,たんぱく質の摂取量を考慮する必要があるというところが妥当な落としどころであろう。現在の妥協点は高齢患者においても、0.8 g/kg・標準体重/日を目安にたんぱく質摂取制限が推奨されている。しかし高齢者が十分なエネルギー摂取ができれば体蛋白異化を防げて問題ないのだが、食欲の低下した高齢者に白米をたくさん食べていただくことには無理がある。筆者の個人的な考えではカロリーの多い中鎖脂肪酸(MCT)などをうまく活用していただくなどで、体蛋白の崩壊を防ぐ、あるいは後期高齢者・超高齢者では肉、魚、卵などの良質な動物性たんぱくは制限せずに、もちろんカリウムやリン値などには気を付けながら好きなものを何でも食べていただき、筋肉を減らさないようにしていただきたいと思っている。
腎機能の悪化を防ぐにはたんぱく質摂取制限は重要な治療法ではあるが、低栄養状態の高齢者となると非常に悩ましい。一般的にはCKDステージ3aでは0.8~1.0 g/kg・標準体重/日、CKDステージ3b以降では0.6~0.8 g/kg・標準体重/日の摂取制限が推奨されている。高齢 CKD 患者においては、CKDステージ4~5 であっても十分な余命が見込まれる場合においてのみ、現状の BMI を維持すべき十分なエネルギー量を確保した上で,たんぱく質の摂取量を考慮する必要があるというところが妥当な落としどころであろう。現在の妥協点は高齢患者においても、0.8 g/kg・標準体重/日を目安にたんぱく質摂取制限が推奨されている。しかし高齢者が十分なエネルギー摂取ができれば体蛋白異化を防げて問題ないのだが、食欲の低下した高齢者に白米をたくさん食べていただくことには無理がある。筆者の個人的な考えではカロリーの多い中鎖脂肪酸(MCT)などをうまく活用していただくなどで、体蛋白の崩壊を防ぐ、あるいは後期高齢者・超高齢者では肉、魚、卵などの良質な動物性たんぱくは制限せずに、もちろんカリウムやリン値などには気を付けながら好きなものを何でも食べていただき、筋肉を減らさないようにしていただきたいと思っている。
食物繊維の摂取は腎機能悪化を防ぐ
クレメジン?がインドールを吸着して糞便中に排泄することによって、尿毒素のインドキシル硫酸の産生を抑制して腎機能の進行を阻止することはよく知られている(図5)。 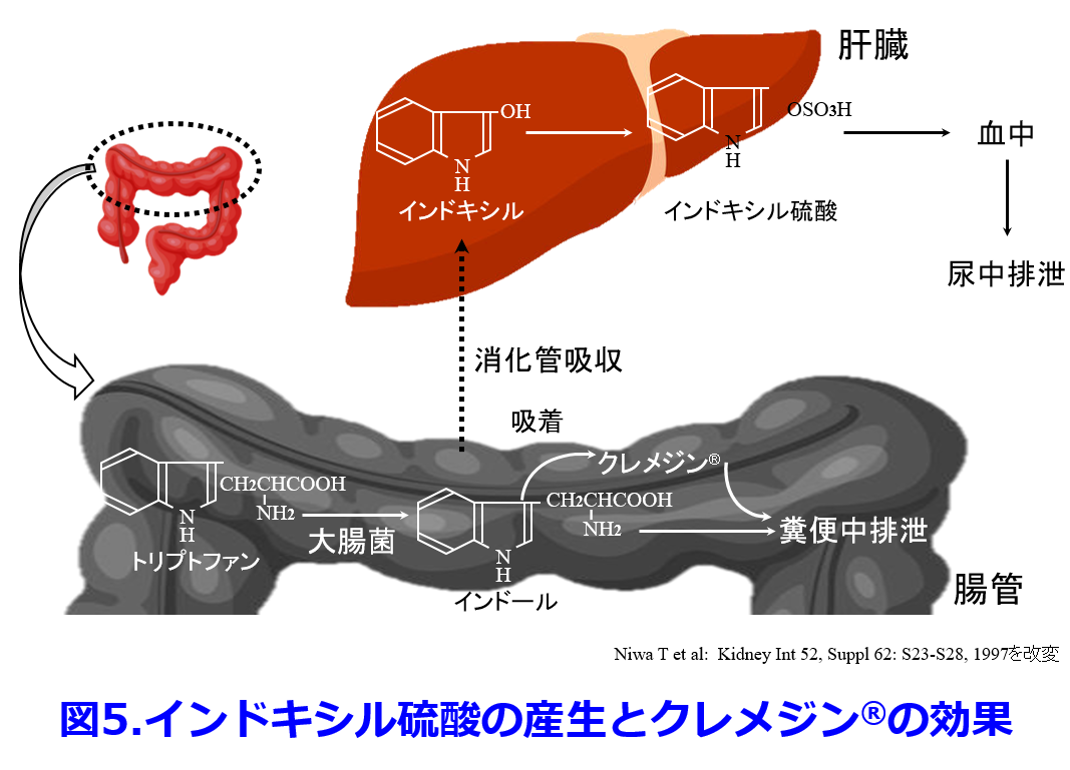 ただしこの図5でトリプトファンからインドールに変換する細菌は近年、大腸菌よりもBacteroides属がメインだといわれている。たんぱく質の摂取は窒素代謝産物の産生を助長し、その中には腎機能を悪化させる尿毒素も産生されている。以前に本HP内「わかりやすい細菌と抗菌薬の話」の第11回、12回で解説したようにインドキシル硫酸だけでなく、p-クレジル硫酸、トリメチルアミン-N-オキサイド(TMAO)の蓄積はいずれも死亡率を上げ、腎機能を悪化させたり、心血管病変を惹起する。そしてこれらすべての尿毒素の産生には腸内細菌が関わっており(図6)
ただしこの図5でトリプトファンからインドールに変換する細菌は近年、大腸菌よりもBacteroides属がメインだといわれている。たんぱく質の摂取は窒素代謝産物の産生を助長し、その中には腎機能を悪化させる尿毒素も産生されている。以前に本HP内「わかりやすい細菌と抗菌薬の話」の第11回、12回で解説したようにインドキシル硫酸だけでなく、p-クレジル硫酸、トリメチルアミン-N-オキサイド(TMAO)の蓄積はいずれも死亡率を上げ、腎機能を悪化させたり、心血管病変を惹起する。そしてこれらすべての尿毒素の産生には腸内細菌が関わっており(図6) 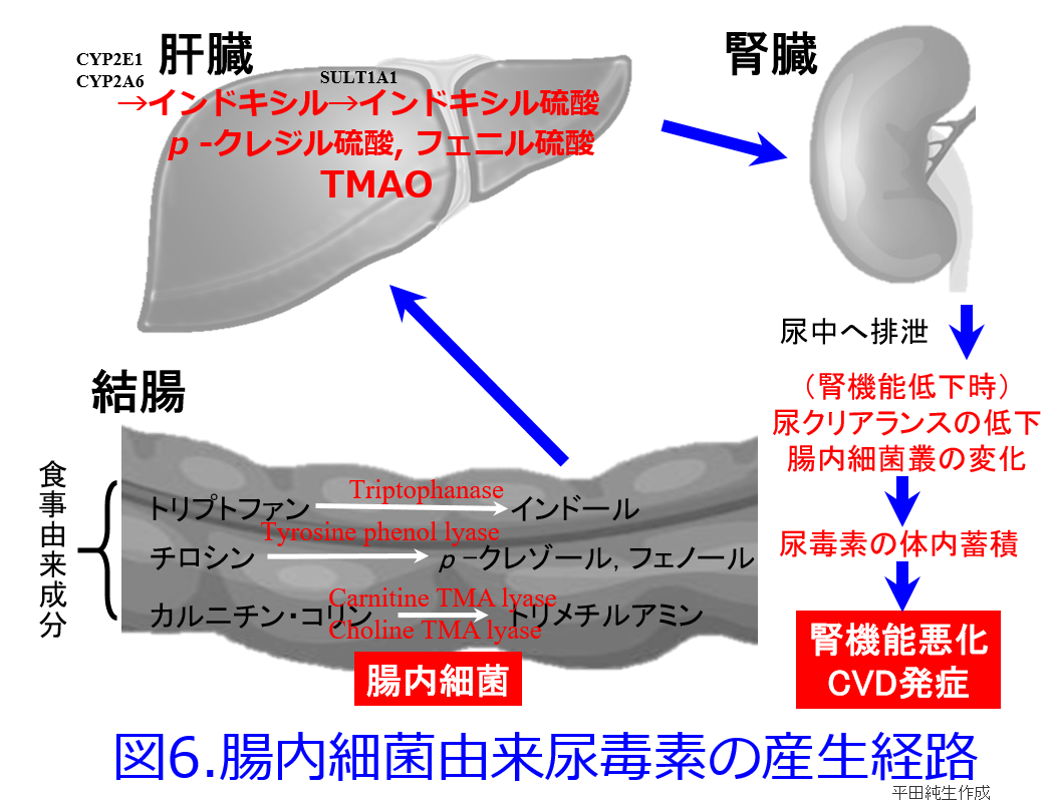 、便秘や肉食、食物繊維不足、肥満などによって尿毒素の産生はさらに助長される。
、便秘や肉食、食物繊維不足、肥満などによって尿毒素の産生はさらに助長される。
Mishimaら1)はアデニン誘発慢性腎不全のマウスに新規下剤のルビプロストン500μg/日を投与し効果を検証した。投与マウスでは腸液の分泌が増加し、腸壁の悪化・善玉菌の減少が改善した。TMAOやインドキシル硫酸などの尿毒素の蓄積も軽減し、BUNの上昇・尿細管間質障害・腎線維化が抑制された。腸内細菌叢の改善に伴ってインドキシル硫酸・馬尿酸・ trans-aconitateの血漿濃度が低下した。これによって腸内細菌叢・腸内環境の改善によって尿毒素の蓄積を抑制することによって腎障害の進行が抑制されたことが明らかになった。
筆者らも腎不全モデルマウスに浸透圧下剤でありプレバイオティクスであるラクツロースを投与するとインドキシル硫酸やp-クレジル硫酸濃度が低下するとともに腎機能悪化が抑制されたことを明らかにした。また腎不全モデルマウスのTGF-βのmRNA発現が低下し、腎線維化が抑制されたことも明らかにした2)。しかも興味深いことにラクツロース投与群ではインドキシル硫酸産生に関与し、肉類を多く摂取する米国人に多いBacteroides属が減少し、食物繊維分解作用が強く食物繊維を多く摂取する東南アジア人に多いPrevotella属が増加した(図7)。 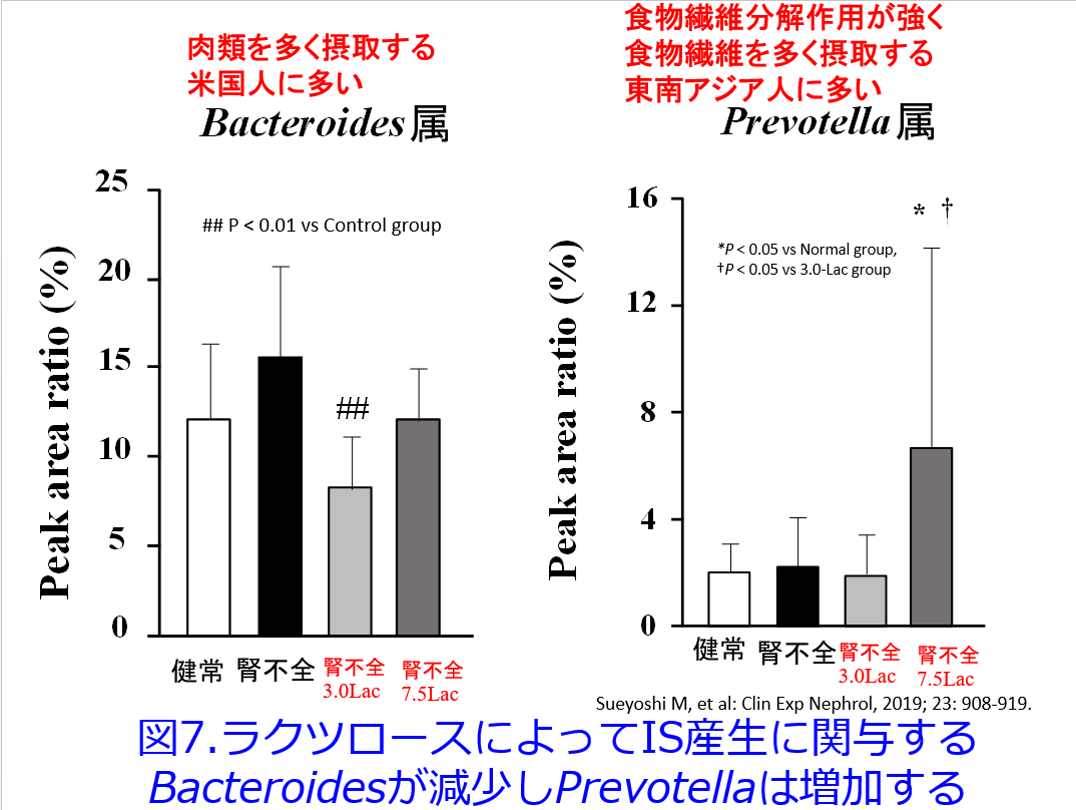
発展途上国の住民は、米国住民よりも腸内細菌叢の構成が多様で、腸管内に有益な微生物が多く存在するが米国に移住すると腸内細菌叢が変化し肥満や慢性疾患のリスクが高まることが知られている3)。さらにPrevotella属が多いタイプには認知症患者がいない4)、Prevotella属が有意に減少すると潰瘍性大腸炎が再燃しやすい5)などの報告もある。
便秘が腎機能を悪化させ透析導入を増やすことも明らかにされているが6)、以前、保存期CKD患者に大黄甘草湯を投与すると腎機能の悪化を抑制できたという報告があったが7)、これは個人的には下剤によってたんぱく質の吸収を抑える低たんぱく療法の一種だと思っていたが、ひょっとすると便秘を改善することによる腸内細菌叢改善作用だったのかもしれない。単に便秘改善だけではなく腸内細菌叢の改善あるいは多様化が腎機能悪化に関与していると筆者は考えている。21世紀以降、DNAシーケンシング分析とそのメタゲノミクスへの応用の技術的進歩は目覚ましく、複雑な細菌叢を定量化し、それらが人間の健康と病気に与える影響の解明に貢献している。腸内細菌叢の解明によって腸脳連関や腸腎連関に関する報告も増加しつつある。
腎機能正常者1,630人を6年追跡し、CKD発症率と食物繊維摂取量の三分位との関連についてみた報告では8)、総繊維摂取量の最低三分位と比較して総繊維摂取量最高の被験者のORは0.47(95% CI 0.27、0.86)。さらに、総繊維摂取量が5 g /日増加するごとに、CKDの発症リスクが11%減少したことが報告されており、交絡因子を調節しても結果は変わらず、特に野菜・豆類が良いそうだ。ということで、腎機能を悪化させない決め手は尿毒素を増やさない、低たんぱく食だけでなく、食物繊維やプレバイオティクス、プロバイオティクスの摂取による腸内細菌叢の改善による尿毒素産生低下かもしれない。
高カリウム血症には気を付けて!
このように「食物繊維は腎機能悪化を防ぐ」ことを聞いて、安易に高齢者や腎機能低下患者に野菜や果物の摂取を推奨しないでいただきたい。腎機能低下患者では高カリウム血症が起こりやすく、高カリウム血症を助長するRAS阻害薬を服用している患者が非常に多いからだ。聞くところによると、ある市ではカリウム摂取は血圧を下げるので、糖尿病やCKDを合併した高齢者に保健婦さんや栄養士さんが野菜・果物の摂取を勧めているそうだ。もしも心不全などでRAS阻害薬だけでなくスピロノラクトンやエキサセレノンなどのMRAが併用されている高齢患者では突然死のリスクになる。それとST合剤に含まれるトリメトプリムも高カリウム血症のリスクが非常に高い。ケールを主成分とする青汁もカリウム含量が非常に高いため、腎機能低下患者にはNGだ。難消化性デキストリンなどのカリウムを含まない水溶性食物繊維サプリメントやカリウムを含まない不溶性繊維サプリメントの方が安全なので、これらのことをよく知ってうえで患者指導にあたっていただきたい。
引用文献
1)Mishima E, et al: J Am Soc Nephrol , 2014
2)Sueyoshi M, et al: Clin Exp Nephrol, 2019; 23: 908-919
3)Vangay P, et al: Cell 2018; 175: 962-972 PMID: 30388453
4)Saji N, et al: Sci Rep 2019; 9(1):1008. doi: 10.1038/s41598-018-38218-7.
5)北江博晃, GI Week 2021
6)Sumida K, et al: J Am Soc Nephrol 28: 1248-1258, 2017
7)Akamatsu A, et al: 和漢医薬学雑誌5:1-12, 1988
8)Mirmiran P, et al: Br J Nutr 119: 479-485, 2018
第2回 薬剤師塾 開催案内
第2回 基礎から学ぶ薬剤師塾 6月1日(火)18時から20時(予定)の申し込みを始めます。
第1回目は110分も一方的に話し、質問タイムも短く反省点だらけでしたが、次回より質問する機会を多く取りたいと思います。
参加を希望される方は以下の申し込みフォームに入力のうえ、送信してください。
https://forms.gle/XERP6s5wfPYo5Qbf7

第2回のテーマは「高齢者のtriple whammy処方への対応~薬剤性腎障害を防ぐために薬剤師のできること~」です。後期高齢者の薬物適正使用を考えるときに腎機能低下、腎機能の評価、それによる中毒性副作用、いろいろと考えられますが、腎機能低下患者が最も薬剤性腎障害にターゲットになりやすいことに今回は注目したいと思います。Triple whammyとは3段攻撃や3重攻撃と訳されますが、NSAIDs、利尿薬、RAS阻害薬の併用です。この処方による薬剤性腎障害を防ぐキーパーソンは薬剤師ではないでしょうか?その具体的な対策について次回の薬剤師塾で考えてみたいと思います。
それと今後の参加者はどなたでも構いませんが、せめて学会発表を目指している方に参加していただきたいと思います。そしてその先には原著論文を書き、海外の学会で発表し、英語論文をまとめて博士号を出するんだというような大きな夢を持つ人になっていただきたいと思います。
300名参加可能ですので、余裕はあると思いますが、万が一のため早めに登録してください。

