2020年8月
◆連載◆抗菌薬のPK/PD理論~抗菌薬を有効かつ安全に使うために~ 第5回
前回の抗菌薬シリーズ第4回で、腎毒性のあるゲンタマイシンはPK/PD理論*から考えると1回少量投与で1日数回投与よりも1日1回大量投与の方が、腎毒性が少なく殺菌力も高い安全で有効性が高くなる投与法であると解説した。しかし若い薬剤師や医師の方は当たり前に理解しているPK/PD理論であっても、なぜ「1回少量を1日数回投与」の方が「1日1回大量投与」よりも安全性が低いのかについては理解に苦しむ方がいるのではないだろうか。ここで、抗菌薬のPK/PD理論について改めて説明したい。これらの理論は米国ウィスコンシン大学のWillian A Craig先生の研究成果1)によるもので、2008年の日本TDM学会の特別講演でCraig先生が講演していただける予定であったが、脳梗塞のため来日が急遽中止になったのが非常に残念であったことを思い出す。
またアミノグリコシド系抗菌薬投与時には不可逆的な聴覚障害*が起こることがあり、どんな医療機関でも初回問診時に「ご家族や親せきの方で薬によって耳が聞こえなくなった方はいらっしゃいますか?」というアンケートを取るのはアミノグリコシド系抗菌薬の副作用の聴覚障害になりやすいかどうかを知るためのものである。おそらく血中濃度の測定ではこの聴覚障害を防ぐことはできないであろう。日本人では350人に1人といわれるアミノグリコシド系抗菌薬難聴家系の方が難聴になりやすい遺伝子を持っており、遺伝子多型をもった方に起こりやすいことについても解説したい。
PK/PD理論*: 薬物の効果は投与量と相関し、多くの薬物は血中濃度のAUC(血中濃度-時間曲線下面積area under the blood concentration time curve)と相関するが、抗菌薬に関しては特殊なPK/PD理論が確立しており、アミノグリコシド系抗菌薬はピーク濃度/MIC(最小発育阻止濃度)が殺菌力の決め手となる(図1)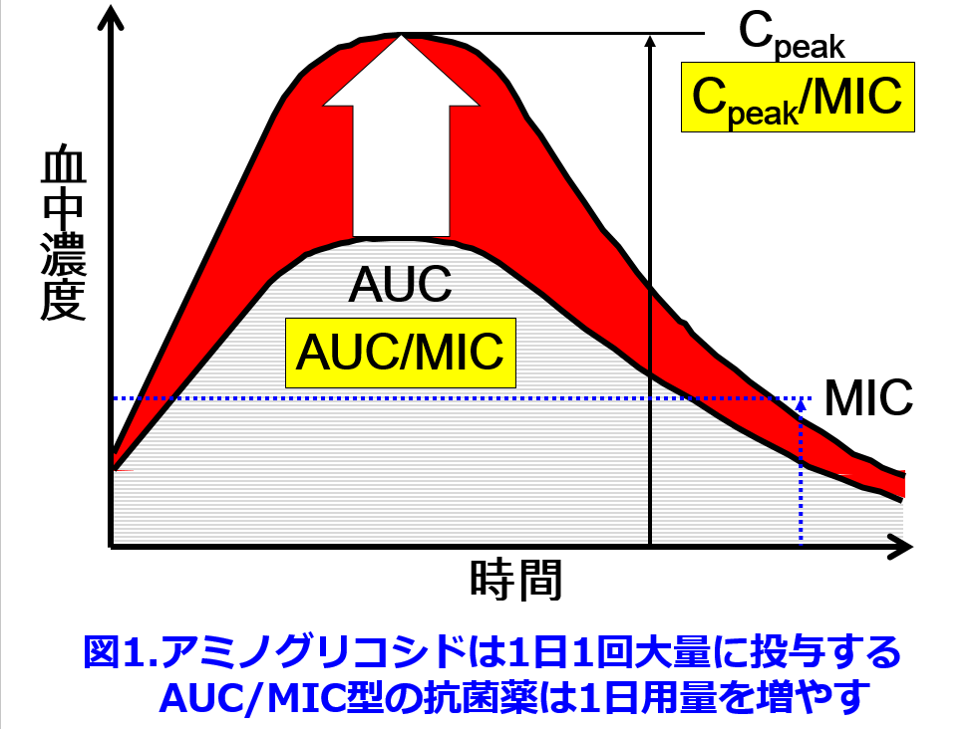 ので、1回少量を1日数回投与よりも1日1回大量投与の方が、殺菌力が強く、トラフ値が低くなるので(前回の図3及び図4を参照)、腎毒性が軽減し、安全性も高くなる。
ので、1回少量を1日数回投与よりも1日1回大量投与の方が、殺菌力が強く、トラフ値が低くなるので(前回の図3及び図4を参照)、腎毒性が軽減し、安全性も高くなる。
ピーク濃度/MIC ではなくCmax/MICと解説している総説も多いが、筆者はCmaxとCpeakは異なると考えている。アミノグリコシド系抗菌薬やバンコマイシンの点滴終了時がCmaxであり、文字通り血中濃度が最大であるが、これは組織に分布する前の血中濃度が非常に高い時であり、全く利用できないPK/PDパラメータである。ここで採血して薬物濃度を測定すると多くのTDM対象薬で致死濃度になるであろう。ピーク濃度の採血はアミノグリコシド系では点滴開始 1 時間後(30 分点滴した場合,終了 30 分後)2)、バンコマイシンでは点滴終了後1~2時間後とされているが、これらはTDMを簡便に実施するための便宜上のものである。分布相(α相)ではなく消失相(β相:薬物によってはγ相になることもある)における任意のできるだけ時間を置いた2点を結ぶ直線を延長して点滴終了時と交差する濃度がピーク濃度であると考えるのが正しい(図2)。 またバンコマイシンの分布速度は遅いため、点滴終了後1時間値と2時間値には明らかな差がある。バンコマイシンのピーク濃度の採血は推奨されていないが、もしも測定するならば分布容積を算出するためのβ相での採血は2時間以降にすべきであると筆者は考える。このため1時間採血を行っている施設のバンコマイシンの分布容積(Vd)は0.5~0.6L/kgとなっていることがあるが、β相の採血によるバンコマイシンのVdは0.9~1.0L/kgであり、後者の方が正しい値であり、前者のVdでは正確な投与設計はできないはずである。
またバンコマイシンの分布速度は遅いため、点滴終了後1時間値と2時間値には明らかな差がある。バンコマイシンのピーク濃度の採血は推奨されていないが、もしも測定するならば分布容積を算出するためのβ相での採血は2時間以降にすべきであると筆者は考える。このため1時間採血を行っている施設のバンコマイシンの分布容積(Vd)は0.5~0.6L/kgとなっていることがあるが、β相の採血によるバンコマイシンのVdは0.9~1.0L/kgであり、後者の方が正しい値であり、前者のVdでは正確な投与設計はできないはずである。
ペニシリン系やセフェム系などのβラクタム系抗菌薬はAUCやピーク濃度と殺菌力は全く相関せず(図3)3)、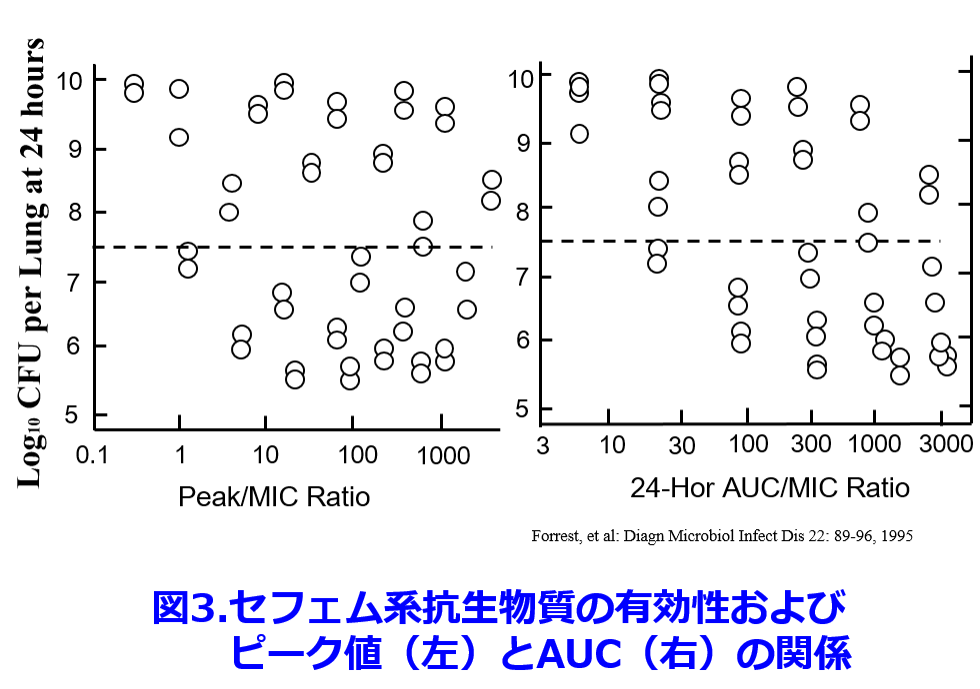 time above MIC、つまりMIC以上の時間が長ければ長いほど、殺菌力が増す(図4)4)。
time above MIC、つまりMIC以上の時間が長ければ長いほど、殺菌力が増す(図4)4)。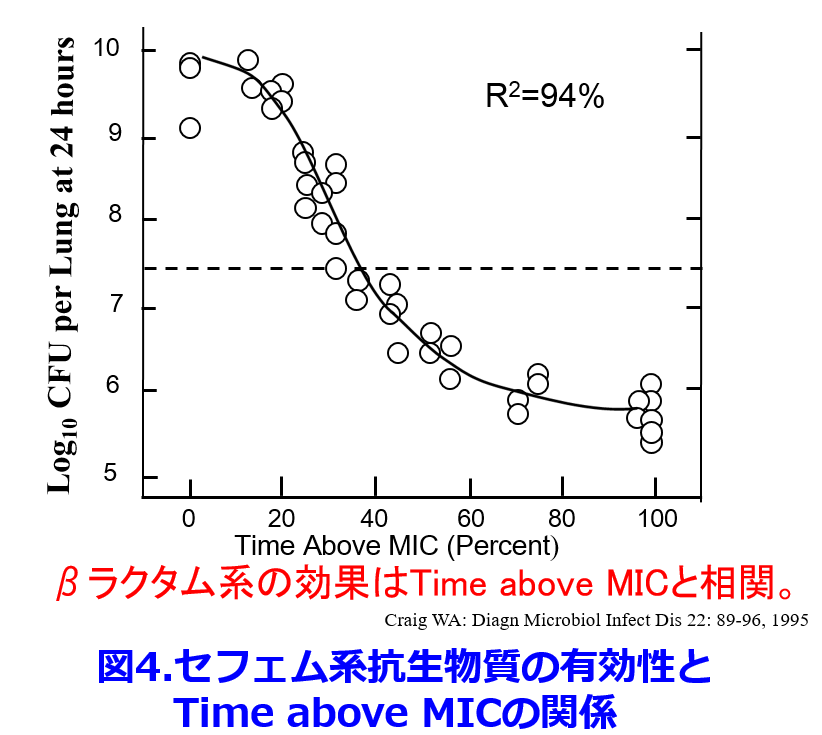 したがって半減期が30分と非常に短いペニシリンGを有効に使うには1回量を増やすよりも、少量を1日6回点滴する方が効果は高いということになる。また小児は成人よりもクリアランスが高いので半減期も短くなるため、βラクタム系抗菌薬を本気で効かせたいときには、投与量を増やすのではなく投与回数を増やした方が抗菌薬の殺菌力が強力になる。小児に何度も点滴するのはかわいそうではあるが、βラクタム系抗菌薬に関しては1日数回の点滴(点滴時間も長い方が効果的になる)をすべきである(図5)。
したがって半減期が30分と非常に短いペニシリンGを有効に使うには1回量を増やすよりも、少量を1日6回点滴する方が効果は高いということになる。また小児は成人よりもクリアランスが高いので半減期も短くなるため、βラクタム系抗菌薬を本気で効かせたいときには、投与量を増やすのではなく投与回数を増やした方が抗菌薬の殺菌力が強力になる。小児に何度も点滴するのはかわいそうではあるが、βラクタム系抗菌薬に関しては1日数回の点滴(点滴時間も長い方が効果的になる)をすべきである(図5)。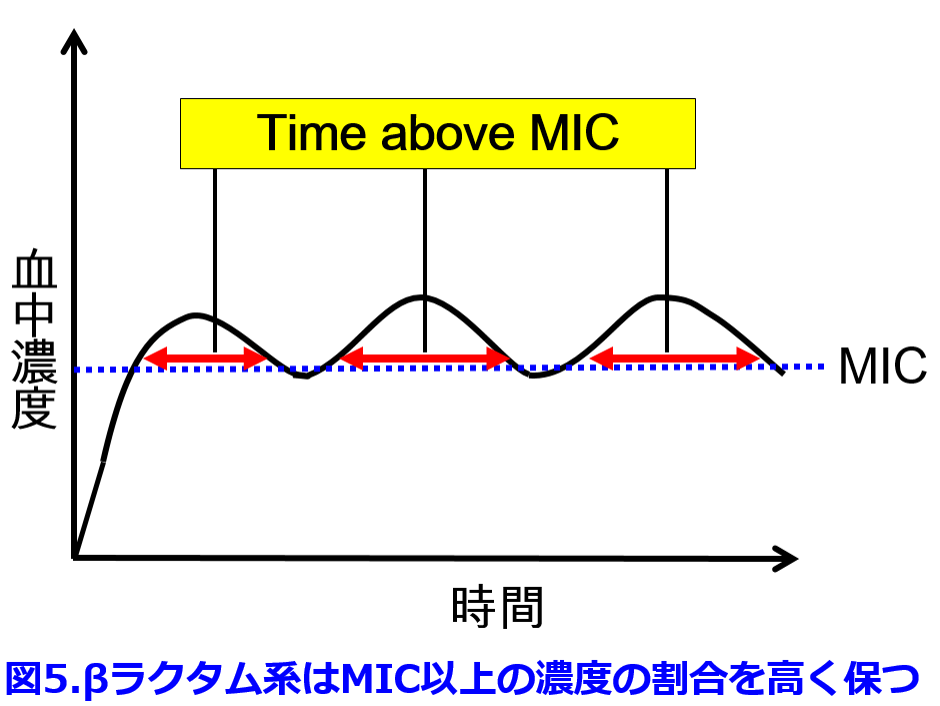
キノロン系などその他の抗菌薬は一般的な薬物と同様にAUCと相関するが、レボフロキサシン(クラビット?)などで1日1回投与が推奨されるのは単に服薬アドヒアランスを高めるためではなく、耐性菌の出現を防ぐためである。自然界に一定の割合で生ずるMICの高くなった変異株(mutant)を殺菌するには、単にMIC以上の濃度にするだけではなく、変異株も殺菌する濃度(MPC: mutant prevention concentration)まで上げるべきだという考えから1日1回大量投与することが推奨されている(図6)。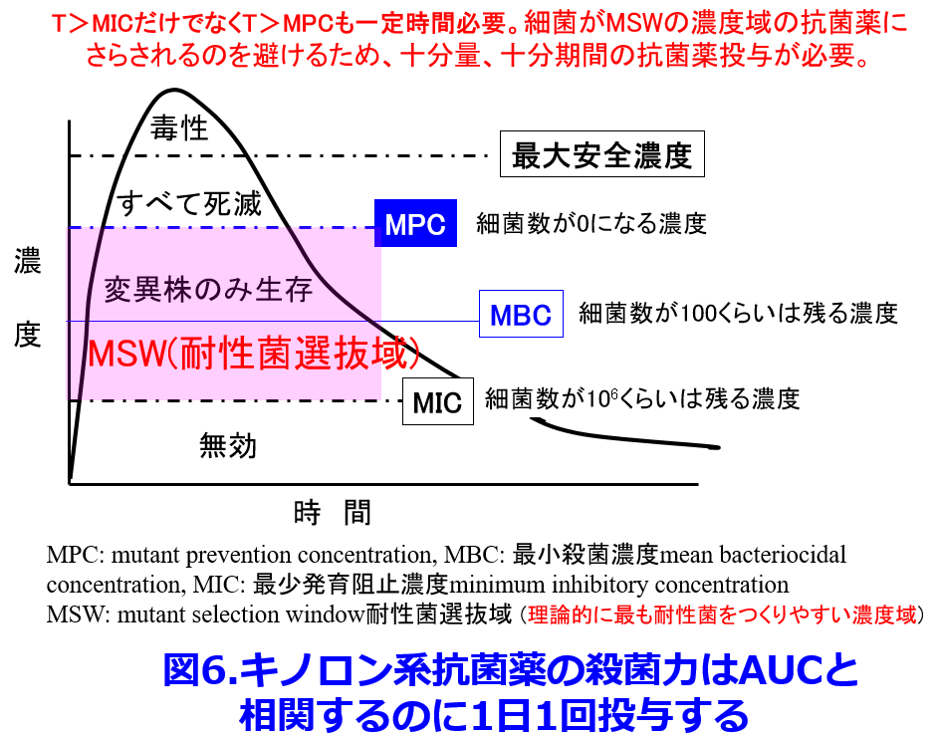 2005年くらいまでは日本の添付文書ではレボフロキサシンは1回100mgを1日3回の投与であったが、米国では以前から1日1回500mg投与になっており、日本の添付文書は遅れているなと嘆いたものであった。
2005年くらいまでは日本の添付文書ではレボフロキサシンは1回100mgを1日3回の投与であったが、米国では以前から1日1回500mg投与になっており、日本の添付文書は遅れているなと嘆いたものであった。
これらのPK/PD理論をまとめると図7および表 1,5)のようになる。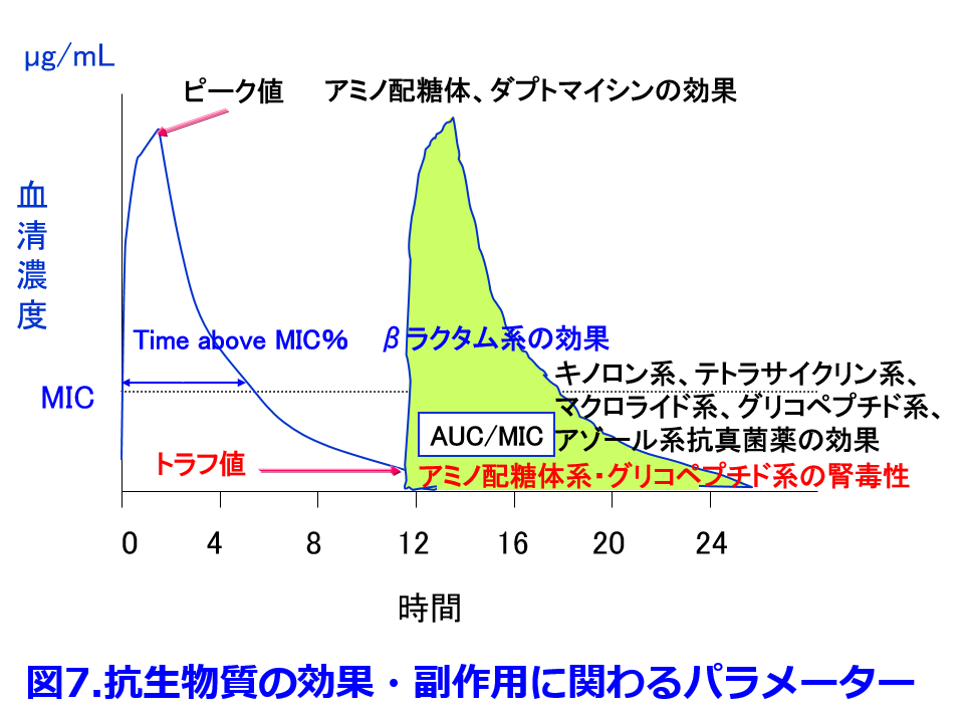 腎毒性を防ぐためにトラフ値を下げた方がよい抗菌薬にはアミノグリコシド系抗菌薬とバンコマイシンなどのグリコペプチド系抗菌薬がある。表には抗真菌薬についての知見も加えてまとめてみた。
腎毒性を防ぐためにトラフ値を下げた方がよい抗菌薬にはアミノグリコシド系抗菌薬とバンコマイシンなどのグリコペプチド系抗菌薬がある。表には抗真菌薬についての知見も加えてまとめてみた。
不可逆的な聴覚障害*:聴覚障害はミトコンドリアDNA1555番目のアデニン(A)がグアニン(G)に変わることによる遺伝子多型が原因と言われており、AがGに変換した人では内耳の蝸牛の有毛細胞のミトコンドリアにアミノグリコシド系抗菌薬が結合するとタンパク合成が阻害され、有毛細胞が壊死することによってアミノグリコシドによる難聴が起こるとされている(図8)6)。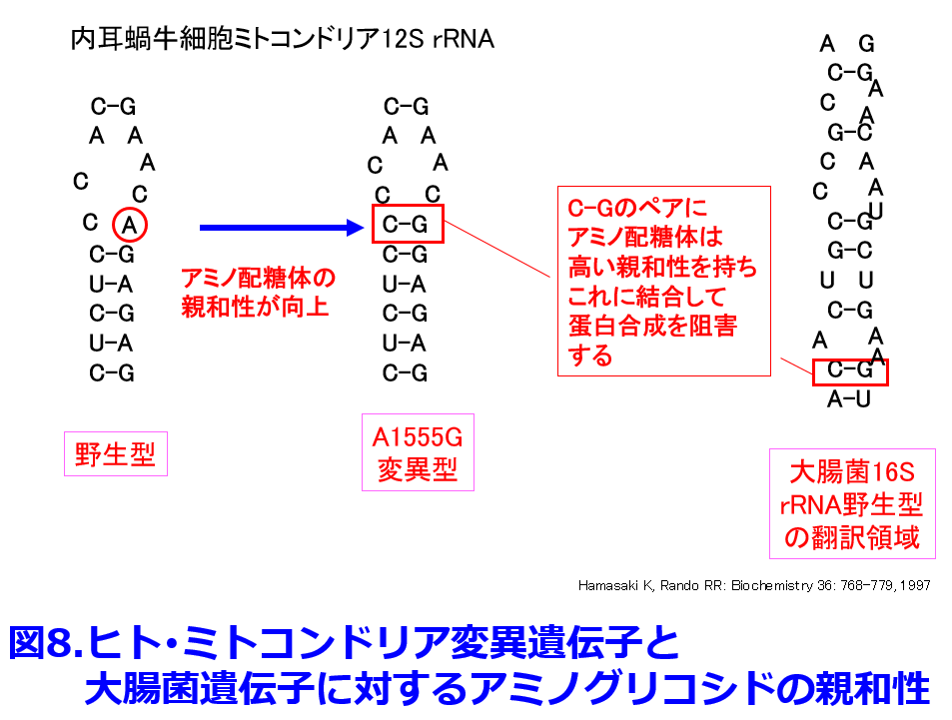 もともとアミノグリコシド系抗菌薬は細菌のC-Gのペアに高い親和性を持つことによってタンパク質合成阻害作用による殺菌作用を示すとされている。アミノグリコシド系による難聴家系では5人中5人でAがGに変換されており、突発性アミノグリコシド難聴は78人中4人(5%)でAがGに変換されているといわれている7)。日本人では350人に1人の割合でこの遺伝子変異を生じる。
もともとアミノグリコシド系抗菌薬は細菌のC-Gのペアに高い親和性を持つことによってタンパク質合成阻害作用による殺菌作用を示すとされている。アミノグリコシド系による難聴家系では5人中5人でAがGに変換されており、突発性アミノグリコシド難聴は78人中4人(5%)でAがGに変換されているといわれている7)。日本人では350人に1人の割合でこの遺伝子変異を生じる。
≪ 練習問題 ≫
症例は腎機能が正常な肺炎症例で、血液培養から緑膿菌Pseudomonas aeruginosaが検出され、メロペネム(メロペンR)1回0.5gを30分点滴で1日2回投与された。緑膿菌のMICは4μg/mLであった。効果不良のため、主治医は1回1.0gを1日2回、30分点液に増量することを考慮している。メロペネムは添付文書上では「通常、成人には1日0.5~1g(力価)を2~3回に分割し、30分以上かけて点滴静注し、発熱性好中球減少症患者では1日3gを3回に分割して投与すること」になっている。ただしメロペネムの半減期は60分と短い。あなたは薬剤師として主治医にどのような提言をしますか?
≪ 解 答 ≫
βラクタム系抗菌薬のメロペネムの殺菌作用はtime above MIC(%T>MIC)、つまりMIC以上の濃度が持続する時間/投与間隔の割合が大きいほど強力になる。0.5gを30min点滴×2回/日でMIC以上の時間は3.26時間で投与間隔が12時間であるため%T>MICは27%と計算される。1回量を2倍にしてもMIC以上の時間は4.26時間、%T>MICは35%に上昇するに過ぎない。つまり投与量を2倍に増量しても%T>MICはほとんど増加しない(図9)。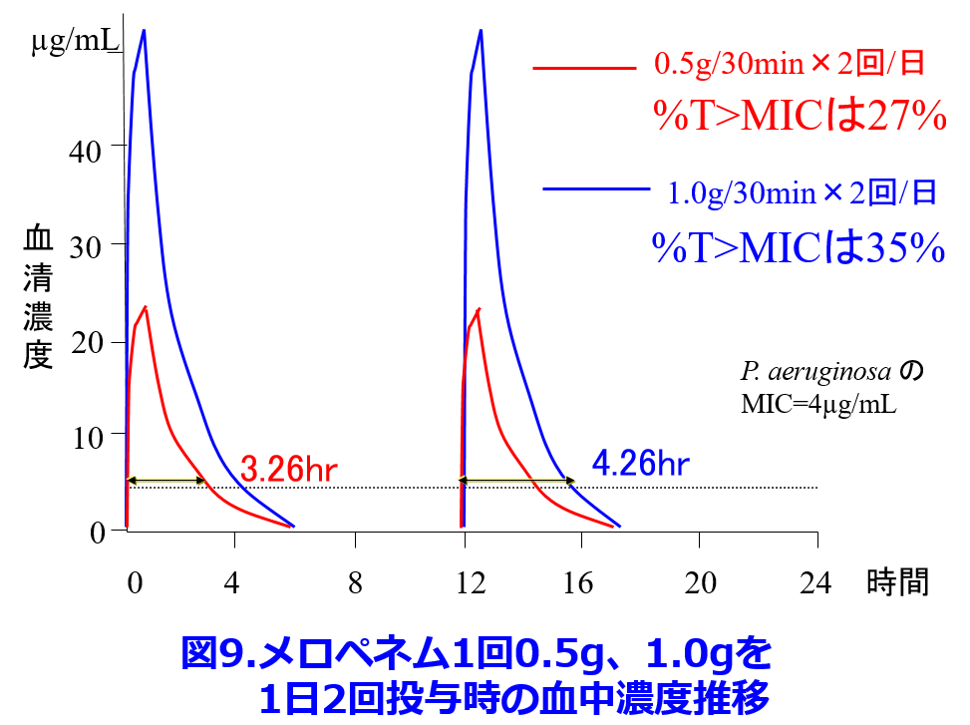 1回0.5gを30min点滴×4回/日の点滴にすれば%T>MICは55%になる(図10の赤色)。
1回0.5gを30min点滴×4回/日の点滴にすれば%T>MICは55%になる(図10の赤色)。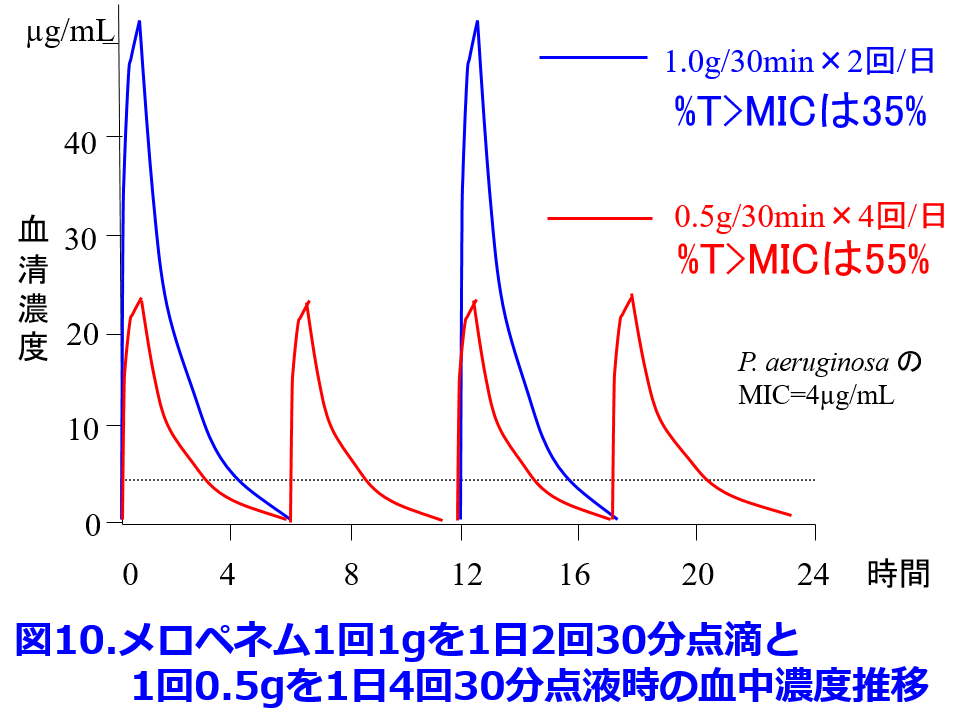 さらに点滴時間を60分にすると%T>MICがさらに増大し、殺菌力の向上が期待できる。添付文書の最大用量である1日3.0gを24時間持続点滴すれば%T>MICを100%することも可能であるが、メロペネムは室温に不安定なため3時間以上の点滴は困難といわれている。ちなみに本症例は腎機能正常者であるが、透析患者では腎排泄性のメロペネムの半減期は9.7~13.7時間と言われており8)9)、10時間として計算すると1回0.5gの点滴を1日1回で十分、%T>MICを100%にできるが、透析日には透析後に投与しないと蛋白結合率の低いメロペネムは透析で抜けてしまう(図11)。
さらに点滴時間を60分にすると%T>MICがさらに増大し、殺菌力の向上が期待できる。添付文書の最大用量である1日3.0gを24時間持続点滴すれば%T>MICを100%することも可能であるが、メロペネムは室温に不安定なため3時間以上の点滴は困難といわれている。ちなみに本症例は腎機能正常者であるが、透析患者では腎排泄性のメロペネムの半減期は9.7~13.7時間と言われており8)9)、10時間として計算すると1回0.5gの点滴を1日1回で十分、%T>MICを100%にできるが、透析日には透析後に投与しないと蛋白結合率の低いメロペネムは透析で抜けてしまう(図11)。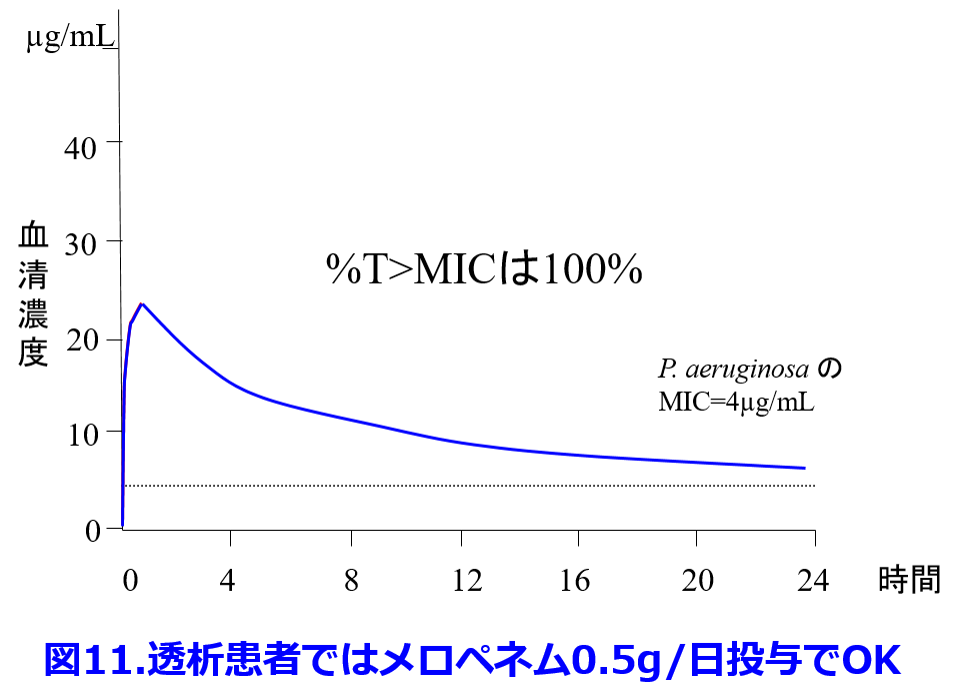 透析患者へのβラクタム系抗菌薬の 投与設計は非常に楽で、点滴回数を減らすために半減期の長いセフトリアキソンを選択しなくても効果が担保されやすい。ということでまとめると「時間依存的な殺菌効果を示すβラクタム系抗菌薬を効果的に使うには点滴回数を増やすか点滴時間を延長する!」。
透析患者へのβラクタム系抗菌薬の 投与設計は非常に楽で、点滴回数を減らすために半減期の長いセフトリアキソンを選択しなくても効果が担保されやすい。ということでまとめると「時間依存的な殺菌効果を示すβラクタム系抗菌薬を効果的に使うには点滴回数を増やすか点滴時間を延長する!」。
引用文献
1) Craig W: Clin Infect Dis 26:1-12 1998
2) 公益社団法人日本化学療法学会/一般社団法人日本TDM学会編: 抗菌薬 TDM ガイドライン 2016
3)Forrest, et al: Diagn Microbiol Infect Dis 22: 89-96, 1995
4)Craig WA: Diagn Microbiol Infect Dis 22: 89-96, 1995
5)Andes D: Antimicrob Agents Chemother 47: 1179-1186, 2003
6) Hamasaki K, Rando RR: Biochemistry 36: 768-779, 1997
7)Fischel-Ghodsian N, et al.: Am J Otolaryngol. 18: 173-178, 1997
8)Leroy A: Eur J Clin Pharmacol 42: 535-538, 1992
9)Thalhammer F: Clin Pharmacokinet 39: 271-279, 2000
◆連載◆腎機能低下患者で起こりやすい抗菌薬の副作用 第4回
前回説明したとおり、生死を分けるような重篤な感染症の時に頼りになる殺菌性の抗菌薬はほとんどが腎排泄である。ということは腎機能低下患者や高齢者では蓄積して中毒性副作用を起こすことがある。しかも腎機能低下患者や高齢者では免疫能が低下し、感染症に罹患しやすいため、抗菌薬を投与する機会が多い。致命的な感染症の時に抗菌薬の投与量不足によって有効性が現れなかったことが分かったときには、非常に後悔する。帯状疱疹におけるアシクロビル、バラシクロビルは副作用を起こさないよう、細心の注意を払って腎機能に応じた投与設計をしたいが、抗菌薬を使うときには初回投与量は十分量投与するなど、基本的に攻める投与設計を心掛けたいと思っている。ただし、腎機能低下患者に腎排泄性で薬剤性腎障害などの副作用を起こすことは避けなければならないし、副作用を起こしにくい投与設計を心がけることが必要となる。そのため今回は腎機能低下患者で起こりやすい抗菌薬の副作用についてまとめたい。
1)感染性心内膜炎に対するバンコマイシン+ゲンタマイシンの1日複数回投与による急性腎障害
薬剤性の急性腎障害(AKI)の最大のリスク因子は既存の腎機能低下および高齢者である。腎毒性のアミノグリコシド系抗菌薬であるゲンタマイシンは1日2回投与ではAUCが200mg・hr/LでAKI発症率は100%近くになるが(図1)、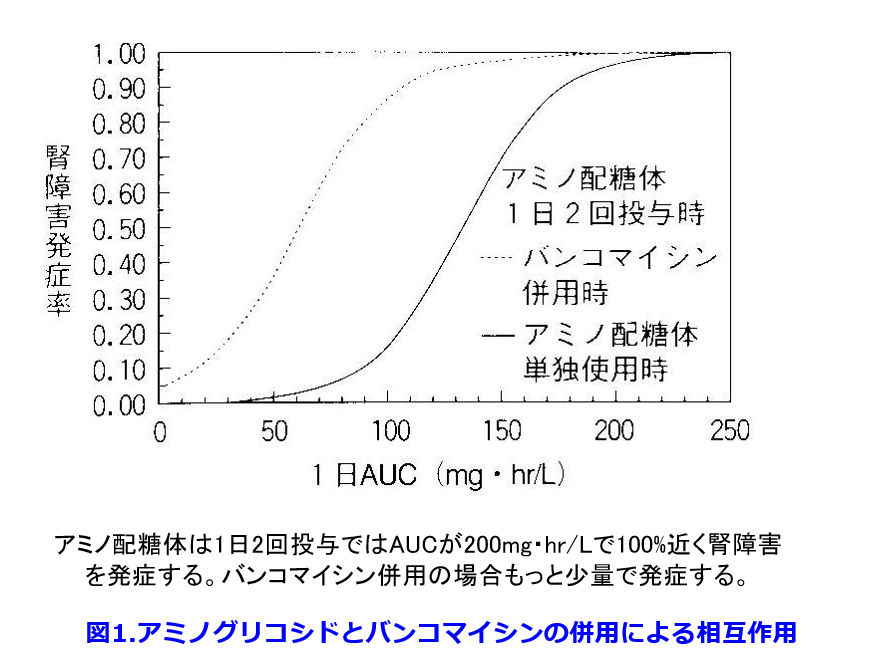 同様に腎毒性のあるバンコマイシンを併用するとさらに1/2量の100mg・hr/Lの低濃度でAKI発症率は100%近くになる1)。ゲンタマイシンの1日1回投与では腎障害発症率が100%になるのは約4倍の800mg・hr/LのAUCのときであり(図2)、
同様に腎毒性のあるバンコマイシンを併用するとさらに1/2量の100mg・hr/Lの低濃度でAKI発症率は100%近くになる1)。ゲンタマイシンの1日1回投与では腎障害発症率が100%になるのは約4倍の800mg・hr/LのAUCのときであり(図2)、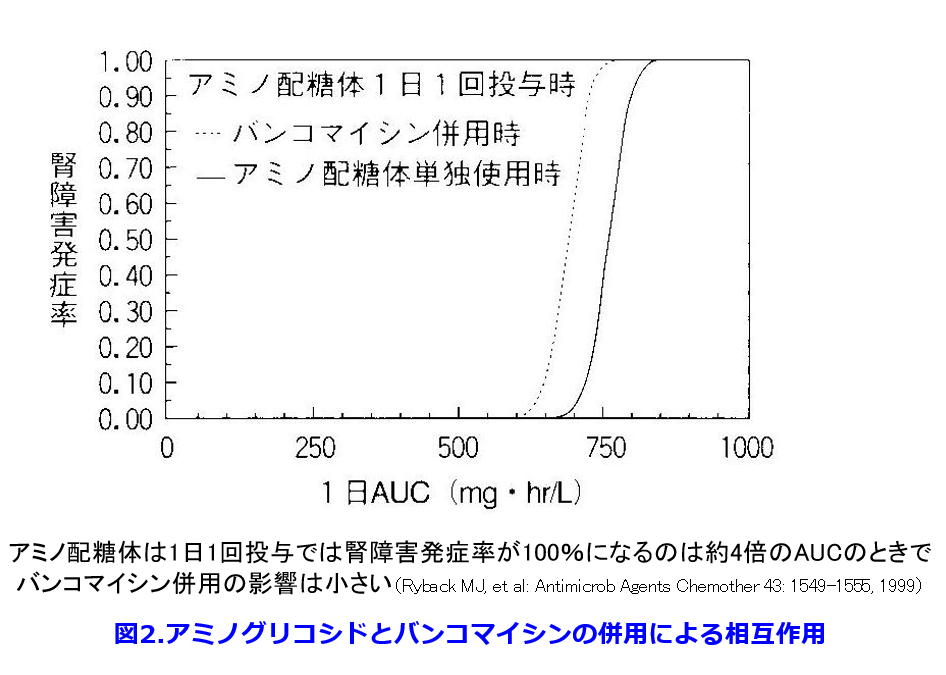 バンコマイシン併用の影響も小さくなり、安全性が高くなる1)。アミノグリコシド系抗菌薬の腎毒性は糸球体濾過されたアミノグリコシド系抗菌薬の約15%が尿細管腔からエンドサイトーシスによって近位尿細管上皮細胞に取り込まれ、さらに細胞内のライソゾームに取り込まれることによってリン脂質症を起こし、ライソゾームが障害されることによって尿細管壊死に至るためとされている(図3)。
バンコマイシン併用の影響も小さくなり、安全性が高くなる1)。アミノグリコシド系抗菌薬の腎毒性は糸球体濾過されたアミノグリコシド系抗菌薬の約15%が尿細管腔からエンドサイトーシスによって近位尿細管上皮細胞に取り込まれ、さらに細胞内のライソゾームに取り込まれることによってリン脂質症を起こし、ライソゾームが障害されることによって尿細管壊死に至るためとされている(図3)。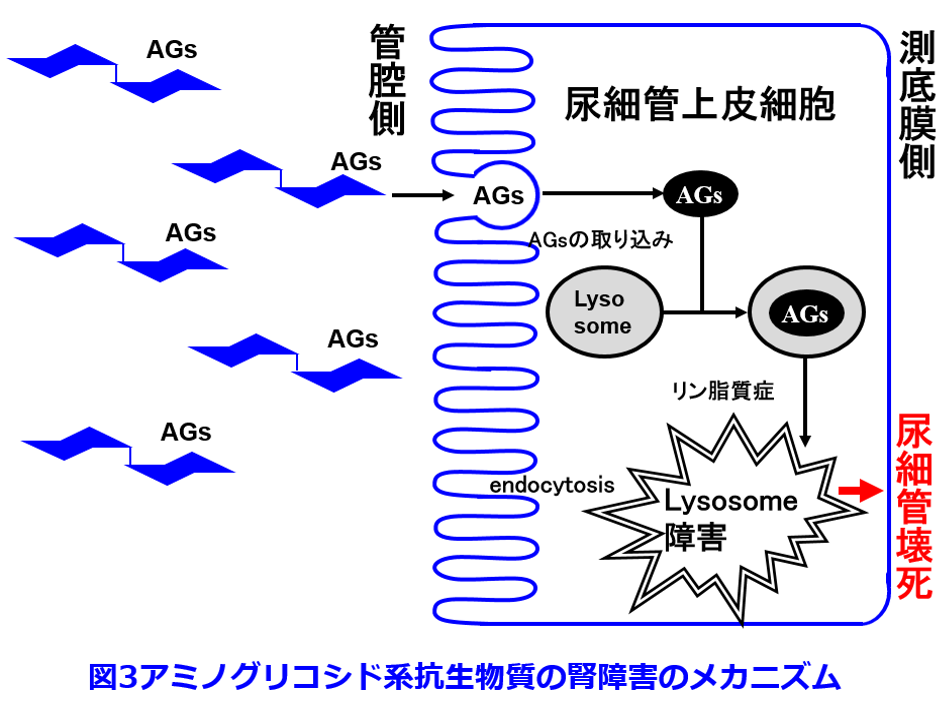
腸球菌、MRSAを原因菌とする感染性心内膜炎にはバンコマイシンに加えて、シナジー効果を期待してゲンタマイシンの1回1mg/kgの低用量を1日3回投与がIDSAガイドラインで推奨されているが2)、ゲンタマイシンの1回量が少なくても腎毒性はあり3)、複数回投与だとトラフ値がゼロになることがないため、近位尿細管から持続的に取り込まれるため腎毒性が強くなるとされている(図4)。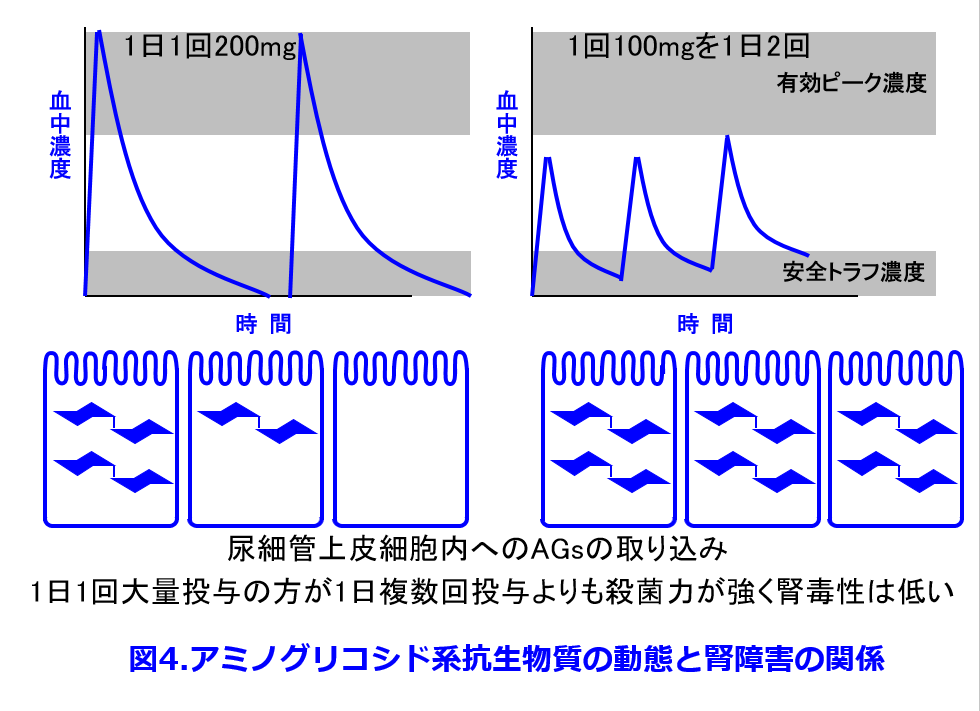 このように腎毒性のあるゲンタマイシンはPK/PD理論から考えると1回少量投与で1日数回投与よりも1日1回大量投与の方が、腎毒性が少なく殺菌力も高い安全で有効性が高くなる投与法と理解し、腎毒性が高くなる投与設計は避けたい。腸球菌の場合はバンコマイシンの代わりにアンピシリンを使用し、バンコマイシンを使わざるを得ないMRSAの場合にはゲンタマイシンは分割投与しなくてもよいという報告もあるので1日1回投与などの投与法を検討していただきたい4)。またCKD患者に2週間以上、ゲンタマイシンのようなアミノグリコシド系抗菌薬投与時には不可逆的な聴覚障害が起こりうるので投与するときにはオージオグラムを取る必要がある。
このように腎毒性のあるゲンタマイシンはPK/PD理論から考えると1回少量投与で1日数回投与よりも1日1回大量投与の方が、腎毒性が少なく殺菌力も高い安全で有効性が高くなる投与法と理解し、腎毒性が高くなる投与設計は避けたい。腸球菌の場合はバンコマイシンの代わりにアンピシリンを使用し、バンコマイシンを使わざるを得ないMRSAの場合にはゲンタマイシンは分割投与しなくてもよいという報告もあるので1日1回投与などの投与法を検討していただきたい4)。またCKD患者に2週間以上、ゲンタマイシンのようなアミノグリコシド系抗菌薬投与時には不可逆的な聴覚障害が起こりうるので投与するときにはオージオグラムを取る必要がある。
2)急性腎障害になりやすい抗菌薬
用量依存的なAKIの発症リスクを持つ抗菌薬はアミノグリコシド系、バンコマイシンのほかにも多剤耐性グラム陰性桿菌感染症に対し有効なコリスチン(オルドレブⓇ)があり、コリスチン投与開始3日前後で腎機能検査を実施することが望ましいとされている。腎障害のリスクファクターとしては高齢者、既存の腎障害・腎機能低下、糖尿病、低アルブミン血症、アミノグリコシド系抗菌薬、ACE阻害薬、NSAIDs、利尿薬、活性型ビタミンDの併用などが挙げられる。バンコマイシン自体の腎毒性はそれほど高くはないが(筆者はバンコマイシン単独で脱水を含まない尿細管障害は10%程度の発症頻度だと思っている)、バンコマイシンは腎毒性薬物の併用によって、より腎毒性が増す報告はアミノグリコシド系抗菌薬にとどまらず、上記の要因が加わってバンコマイシンの腎障害が過大評価している報告が多いと考える。
薬剤によるAKIと断定する前にまずは重症感染症に伴う炎症や高熱・発汗に伴う脱水症を除外していただきたい。簡易な脱水指標であるBUN/Cr値(通常は10程度)が重症感染症症例では20以上、30~40になることもまれではなく、輸液投与により血清Cr値が低下することが多いので、投与設計が振出しに戻ることをよく経験する。RAS阻害薬、NSAIDs、利尿薬、活性型ビタミンⅮなどの腎虚血誘引薬物が併用されている症例ではなおさらである。そのため溢水のない症例では輸液するなど体液管理を行ったうえで、腎機能に応じた抗菌薬の用量調節を行う必要がある。
また抗菌薬は一般的にアレルゲン性が高く、薬剤性の急性尿細管間質性腎炎の発症率では最多であり(図5)、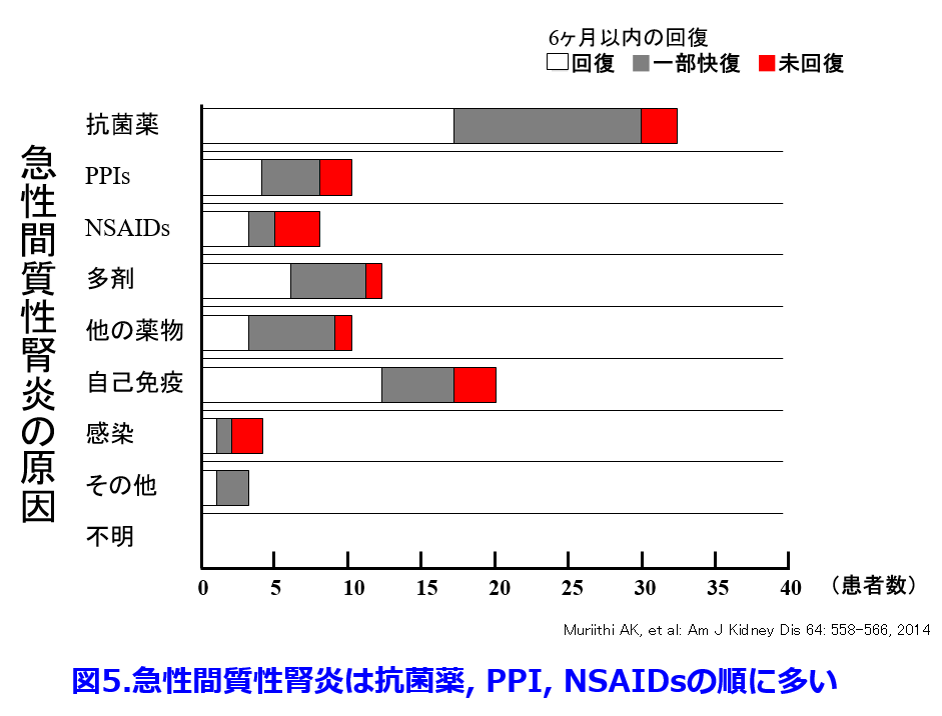 特にアレルギー性の間質性腎炎はペニシリン系、キノロン系が多いことが明らかになっている(図6)5)。
特にアレルギー性の間質性腎炎はペニシリン系、キノロン系が多いことが明らかになっている(図6)5)。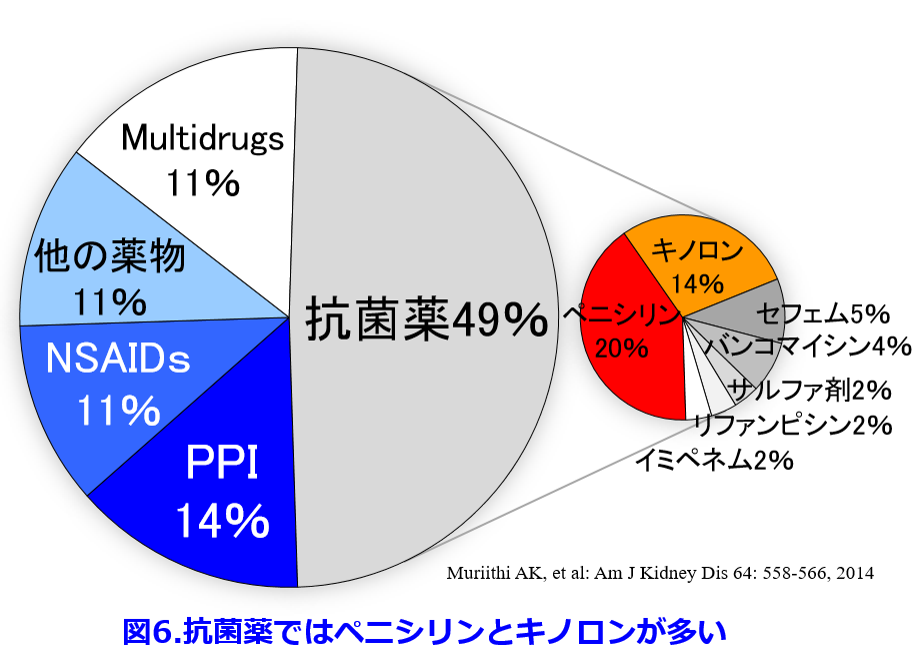
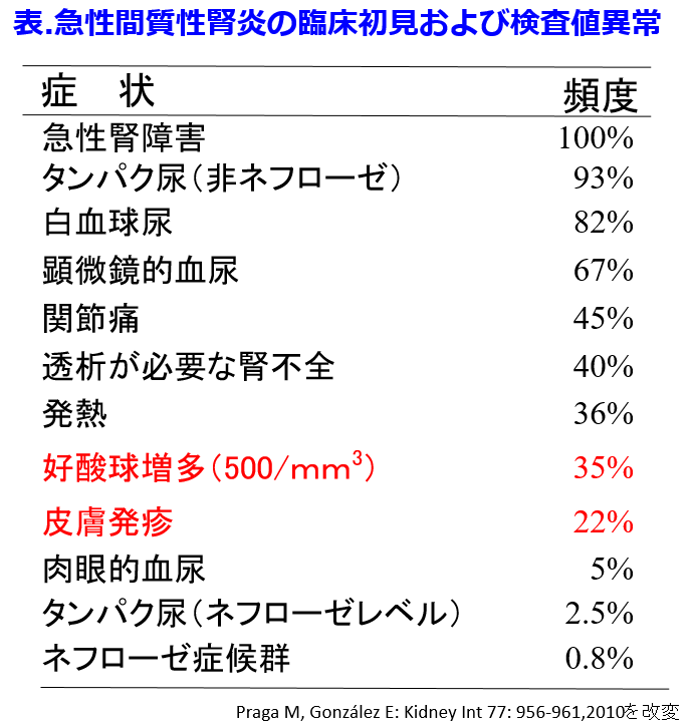 アレルギー性副作用として併発しやすい皮疹や好酸球増多などが現れることがあるが、頻度としては高くなく(表)6)、この腎障害は薬と患者個人の相性によるものであるため、予測や予防することはむつかしい。さらにバンコマイシンとタゾバクタム・ピペラシリン(ゾシンⓇ)の併用群のAKI発症率は22.2%でバンコマイシン単独時の発症率12.9%に比し、有意に高いことがシステマティックレビューで報告されている7)。
アレルギー性副作用として併発しやすい皮疹や好酸球増多などが現れることがあるが、頻度としては高くなく(表)6)、この腎障害は薬と患者個人の相性によるものであるため、予測や予防することはむつかしい。さらにバンコマイシンとタゾバクタム・ピペラシリン(ゾシンⓇ)の併用群のAKI発症率は22.2%でバンコマイシン単独時の発症率12.9%に比し、有意に高いことがシステマティックレビューで報告されている7)。
3)腎機能低下患者特有の抗菌薬の有害反応
無尿の透析患者であれば、腎機能が廃絶しているためAKIのことを考慮する必要はない。ただし、腎機能低下患者特有の抗菌薬による有害反応が報告されているので気を付けよう。特に低アルブミン血症を伴う症例では蛋白結合率90%と高いセフトリアキソン(ロセフィンⓇ)の遊離型分率が上昇しやすくなる。尿中排泄率50%だが腎不全のため、胆管クリアランスは不変なものの、腎クリアランスが著明に低下するため胆管中のセフトリアキソンが高濃度で胆汁排泄されるため胆汁中のCaイオンと結合してセフトリアキソンのCa塩を主成分とする胆嚢総胆管偽結石を生じることがある。2018年の日本透析医学会では4施設から同様の症例報告があった。透析患者の場合、胆道閉塞・胆管炎の発症を念頭に置き、胆道ドレナージを検討する必要がある8)。
ST合剤(バクタⓇ)に配合されているトリメトプリムによる高カリウム血症には他の降圧薬併用時に比しRAS阻害薬と併用時に高カリウム関連入院が6.7倍になるという報告9)、スピロノラクトンとST合剤の併用は高カリウム血症による入院リスクを12.4倍上昇するという報告10)がある。トリメトプリムにはCrの尿細管分泌を抑制して偽性腎障害を起こすること知られているが、カリウムの尿細管分泌も阻害し突然死リスクが上昇するため要注意である。
引用文献
1)Ryback MJ, et al: Antimicrob Agents Chemother 43: 1549-1555, 1999
2)Liu C, et al: Clin Infect Dis 52:e15-55, 2011
3)Cosgrove SE, et al: Clin Infect Dis 48: 713-21, 2009
4)感染性心内膜炎の予防と治療に関するガイドライン2017年改訂版
5)Muriithi AK, et al: Am J Kidney Dis 64: 558-566, 2014
6)Praga M, Gonzalez E: Kidney Int 77: 956-961,2010
7)Luther MK, et al: Crit Care Med 46: 12-20, 2018
8)棚橋 仁, 他: 日本消化器内視鏡学会雑誌55: 3594-3596, 2013
9)Antoniou T, et al: Arch Intern Med 170: 1045-1049, 2010
10)Antoniou T, et al: BMJ 2011 Sep 12;343:d5228. doi: 10.1136/bmj.d5228.
◆連載◆殺菌性の抗菌薬はなぜか腎排泄 第3回
殺菌性の抗菌薬はなぜか腎排泄
2,000種類以上ある薬物のすべてについて腎排泄性か肝代謝性かを片っ端から記憶することは容易ではない。というか多すぎて超記憶力の良い特殊な方にしか勧められない。くすりオタクだけど記憶力が悪い(というかほとんどない)筆者はどうやって克服したかというと、少ない例外の薬物を覚える方が、楽なので、少ない方の腎排泄性薬物だけ覚えた。そのおかげで肝代謝型薬物は覚えなくてもだいたいわかるようになった。だって、図を見ればわかるように薬物の7割以上が肝代謝、5%程度のレアな胆汁排泄を除けば残りの2割だけが腎排泄だからだ。でもこの図はトップ200の薬物だけなので、いずれは2000くらいある成分でどれくらいの割合になるのかを検証してみたいと思う。
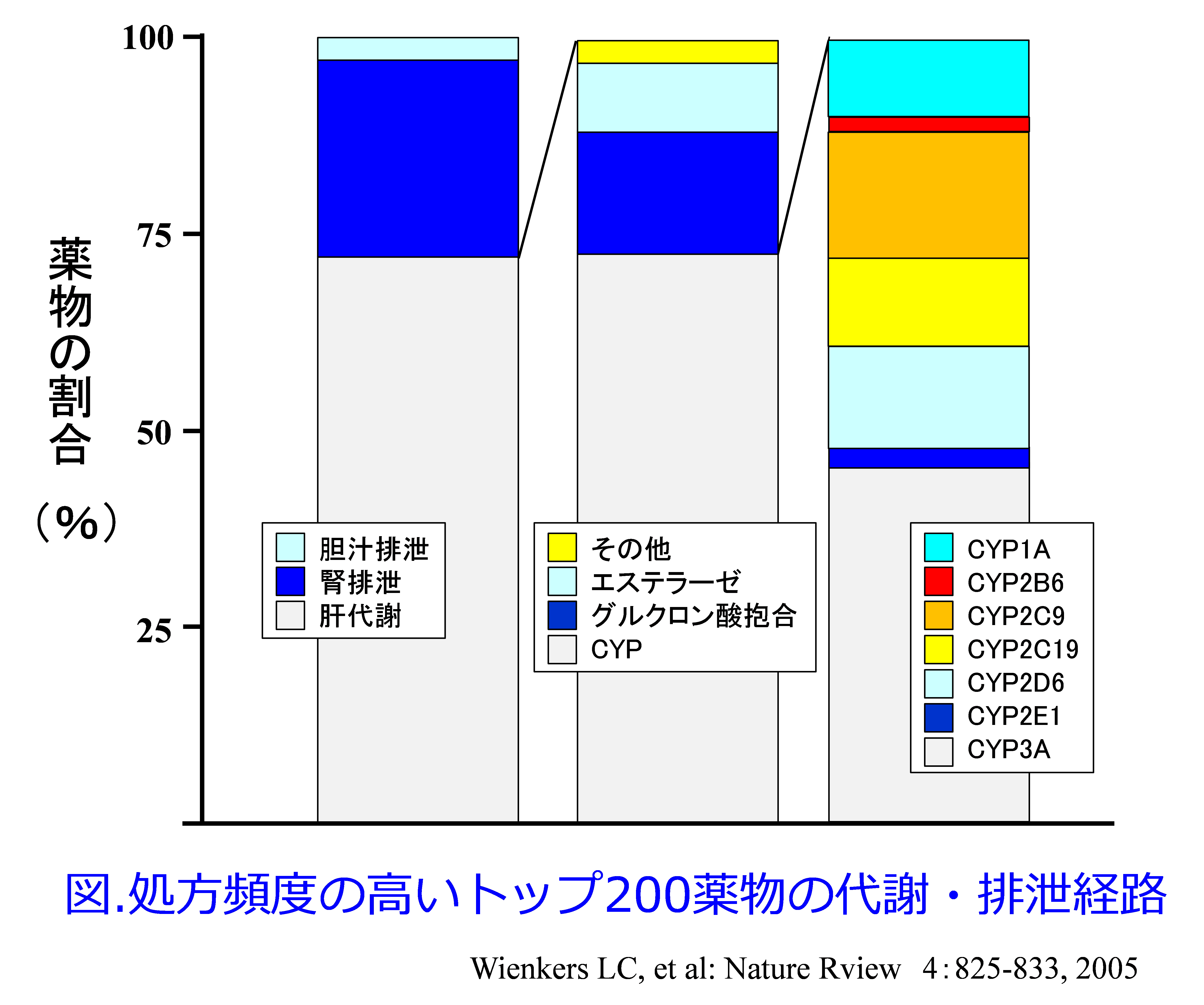
たとえば向精神薬は基本的に血液脳関門というタイトジャンクション(密着結合)を通過できる脂溶性の薬物なので、腎臓を通って糸球体でろ過されても近位尿細管で再吸収されため、尿中に排泄されない。ただしアマンタジンやプラミペキソールなどの有機カチオン輸送系を介して尿細管分泌されて尿中に排泄される脂溶性薬物や炭酸リチウムのように分子量が非常に小さい水溶性薬物などが例外的にある。
平田の薬剤師塾のHPの右下のカテゴリの中の「育薬に活用できるデータベース」の「1.腎不全」にある「8.腎機能低下に関わらず通常投与可能な薬物(表1)」は文字通り腎排泄性ではないため、腎機能低下に伴い減量する必要がない肝代謝性薬物ばかりをまとめている。「育薬に活用できるデータベース」には記憶力の悪い筆者が忘れないように50近くの一覧表にまとめたものであるが、1つ1つが大きな表なので、ここでお見せできないのが残念である。この表の中で青色の薬効群で腎排泄性のものはない。それ以外の白色の部分はそれぞれ例外が少なからずあるので、ちょっと覚えにくいのはご容赦願いたい。抗菌薬は本来ならばもっとたくさんの分類になるはずだが、脂溶性の薬物が少ない傾向にある。
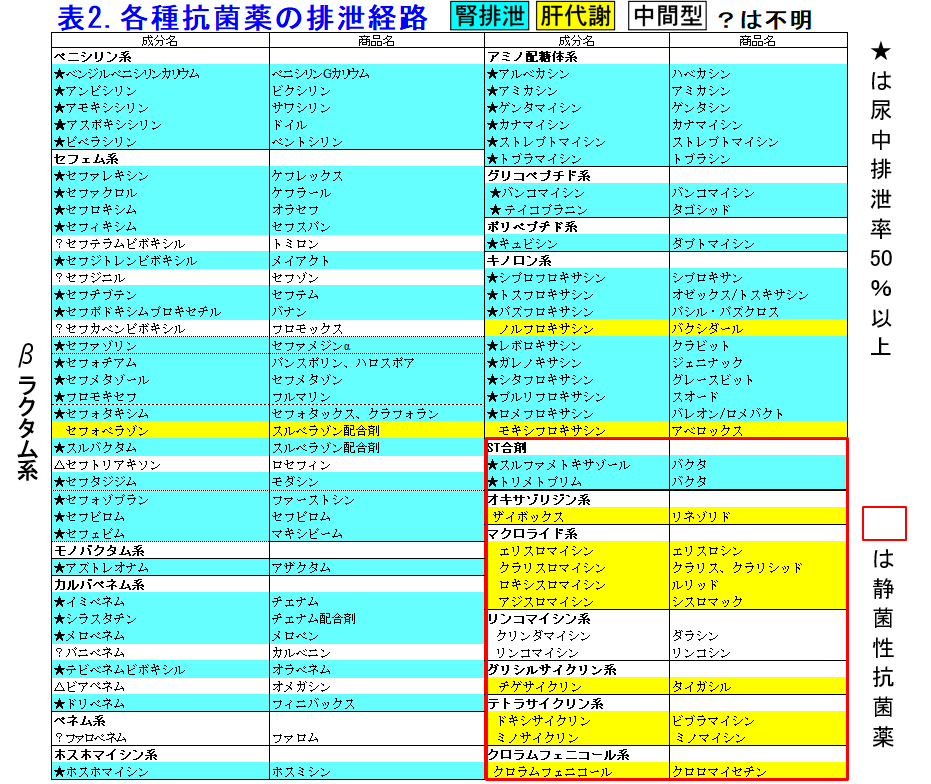
じほうの腎機能別薬剤投与量ポケットブック第3版(日本腎臓病薬物療法学会 腎機能別薬剤投与方法一覧作成委員会編)には2,193の薬物が収載されていまるが、この中で抗菌薬は108薬物あり、この中で肝代謝型抗菌薬は非常に少ない。主だったものを表2に示すが、殺菌性の抗菌薬は80薬物、静菌性抗菌薬は28薬物で圧倒的に殺菌性のものが多く、腎排泄か肝代謝か不明なもの(経口抗菌薬などでバイオアベイラビリティが不明なもの)を除くと、殺菌性抗菌薬の93%が腎排泄で腎排泄でないものはモキシフロキサシン、ノルフロキサシンくらいで、もともと脂溶性で組織移行性が高く分布容積が1~5L/kgと高いキノロン、蛋白結合率が90%と高いため腎排泄されにくいセフォペラゾンなどごくわずかだ。静菌性抗菌薬で腎排泄型はST合剤くらいのもので、わずか7%に過ぎない。「殺菌性の抗菌薬はなぜかほぼ腎排泄」なのだが、この理由を説明できる人がいればhirata@kumamoto-u.ac.jpまでご連絡いただきたい。
殺菌性抗菌薬はほぼ腎排泄性なので、高齢者には特に初日は過小投与にならないように
加齢に伴い栄養状態が不良になり、免疫能も低下して感染症に罹患しやすくなる。肺炎による死亡者の97%が高齢者であり、加齢に伴い肺炎の死亡率が高くなる。これは嚥下能力低下による誤嚥性肺炎が増えることも寄与している。そのため殺菌性の抗菌薬は免疫能の低下した高齢患者にはなくてはならないが、殺菌性抗菌薬の90%以上が腎排泄性である。用量依存性の副作用がほとんどないβラクタム系やホスホマイシン、殺菌力の強いアミノグリコシド系、MRSAの切り札のグリコペプチド系やダプトマイシン、耐性緑膿菌の切り札であるコリスチン(腎毒性が強いことは覚えておこう)はすべて水溶性で腎排泄性の殺菌性抗菌薬である。
高齢者に慢性疾患治療薬を投与する際には腎排泄性の薬物ではなくても低用量から効果・副作用のモモニタリングをしながら漸増すべきである。ただし感染症は急性疾患なので抗菌薬を腎機能の低下した高齢者に投与する際には初日は常用量投与して、迅速に有効治療濃度に上げないと速やかな効果が得られない。急性疾患に対しては迅速な有効性を重視することが肝要であり、この考え方は抗菌薬の耐性化防止にも役立つ。抗菌薬の初回投与設計に関しては悔いのないよう「安全性」よりも「有効性第一」に考えよう。これは安全性の高いβラクタム系でもTDM対象薬のバンコマイシンでも同じある。
日米で腎臓病患者への服薬指導のポイントが違う?-後編-
リン吸着薬は食事を始めるときに飲もう。これはとっても重要(super important)だよ。
最後の確認テストでは食直前は正解だけど食直後は間違いになっていた(ただし空腹時にのむとむかつくホスレノールⓇではなかった)。
リン吸着薬は日本では薬によって服用時間が違います。食直前服用もあれば食直後もあるけど、海外では「食事とともに(with each meal)」が正解です。アンサング・シンデレラの第3話でレナジェルが食前服用なのに1回量包装の中に入っているのを問題にしてたけど、服薬アドヒアランス不良の人やドラマのように1回量包装なら僕はドクターに頼んで食後にしてもらうことも十分ありだと思っています。
EPOの投与初期に体が痛くなったり、注射部位が痛むことがある。最も重要なことは、がんがあるときには投与しない方がいいかも。
なんで最も重要なのに「いいかも」っていうの?血栓症が起こりやすいから?このYoutubeは4年前に収録されたものなので、そんなに古くはないですね。がん患者にプラセボを投与した患者に比べて血栓症による死亡率が高いことが示されたとの報告が2008年に報告さており( Smith RE Jr, et al. J Clin Oncol. 2008;26(7):1040-50.)、日本輸血・細胞治療学会から「がん化学療法に伴う貧血の治療における赤血球造血刺激因子製剤の必要性についての学会見解」が出されています。この中でも「そして最も重要なことは、それぞれの治療選択肢(ESA か緊急避難的な輸血か、あるいはどちらも選択しないかなど)について、リスク(可能な限りコストも)とベネフィットを説明し、 患者の好みにより(同意を経て)、ESA は使用されるべきであると考える。」と一応書かれています。でもがん化学療法に伴う貧血に対して「輸血とESAとどちらにする?」と聞かれるとほとんどの医療者・患者ともにESAを選択するんじゃないでしょうか。体が痛くなるというのはあまり聞いたことない。ただし発売し始めたころはエスポーⓇとエポジンⓇはどちらかが注射の痛みが強かったらしくて,MRさんが宣伝材料にしていた時代があったのを思い出しました。
経口鉄剤は吸収がよい空腹時にのむべし
以前は日本でもこういう説明もあったかも?でも今は「経口鉄剤は胃腸障害や便通異常などの消化器系の副作用が出やすいために、治療を中断することが多いので」とか「特に空腹時服用で胃障害が多いといわれている」ので、食後に飲むことを勧めることが多いと思いますし、僕も薬剤師時代には「胃障害を起こさないために食後すぐ飲んでください」と迷わず説明していました。透析患者さんって胃が本当に弱くって半分くらいの方がPPIを飲んでましたから。アンサング・シンデレラの第3話でも「フェログラデュメットⓇ」を飲むと吐き気がする小学校の先生の話が出ていましたね。日本の鉄剤の添付文書も「通常成人1日105~210mg(1~2錠)を1~2回に分けて,空腹時に,または副作用が強い場合には食事直後に,経口投与」となっています。10年以上前にはリファンピシンの添付文書にも「食前服用」になっていましたが、他の抗結核薬が食後なのにこんな飲ませ方をしていたらアドヒアランス不良になるからでしょう、今は1日1回毎日服用に改められています。アンサング・シンデレラの第3話では添付文書では食直前になっているレナジェルⓇが食後の1包化されていたのが問題になっていましたが、これもアドヒアランス不良の原因になるので、僕は食直後で全然構わないと思っています。欧米の添付文書ではwith each meal、つまり食事とともに服用ですからね。
腎臓病の人は咳や風邪薬にNSAIDsが含有されていないことをチェックして
これは個人的にはいいと思います。NSAIDsの様々な不利益、胃障害、消化管出血、腎障害、アスピリン喘息、高血圧、脳梗塞、心不全、心臓死などの心血管疾患、を考えると(風邪だけじゃないけどCarter S, et al: JAMA Network Open. 2018;1(3):e180756. doi:10.1001をよく読んでほしい)やっぱりアセトアミノフェンにすべきだと思います。でもロキソニンⓇの適応症には「急性上気道炎(急性気管支炎を伴う急性上気道炎を含む)の解熱・鎮痛」と明記されています。NSAIDsのOTC薬はかつて米国では膝関節症で年間16,000人、リウマチで2,000人もの死亡者を出したため、日本と違って米国の病院でNSAIDsが処方されることはなく、痛み止めとしてはもっぱらアセトアミノフェンが汎用されていました。
アンサング・シンデレラについて随分、批判めいたことを書いてしまいましたが、ドラマとしての内容はいいし、薬剤師が日の目を浴びるのはとっても嬉しいことだと思って応援しています。それから僕の考えが間違っていると気づいた方はhirata@kumamoto-u.ac.jpまでご連絡ください。
◆連載◆平田流・抗菌スペクトルの理解の仕方 第2回
抗菌薬の添付文書の適応菌種・適応症を見ると気が狂いそうになるのは筆者だけだろうか?適応菌種・適応症って不変のものじゃなく承認時期によって書き方が変わるし、菌種名が変わることもあるし、耐性化することもある。クロラムフェニコールは一世を風靡した抗菌薬で、適応症のなんと幅広いこと。だが、現在はほとんどの病院に在庫すらしていない(海外から帰国した腸チフス患者に使うかも?)。今回は抗菌薬によってさまざまな差が見られる抗菌スペクトルantibacterial spectrumについて、極めて記憶力の悪い筆者がどうやって自分なりにざっくりと分類して対処したのかについてまとめてみたい。
図1にあくまで広域スペクトルの抗菌薬であればということで最大限カバーできる範囲を示した。 したがってすべての抗菌薬がこのような広いスペクトルを持つのではなく「広域のものであれば」という仮定でのものであることをご了承いただきたい。また繰り返すが、筆者は感染症学や微生物学の専門家ではないため、理論的に間違いがあるかもしれないが、理解しやすくするための手段だとしてご容赦いただきたい。
したがってすべての抗菌薬がこのような広いスペクトルを持つのではなく「広域のものであれば」という仮定でのものであることをご了承いただきたい。また繰り返すが、筆者は感染症学や微生物学の専門家ではないため、理論的に間違いがあるかもしれないが、理解しやすくするための手段だとしてご容赦いただきたい。
1.広域βラクタム薬であってもレジオネラやクラミジアなどの非定型菌に効くはずがない
セフェム、ペニシリン、カルバペネムなどのβラクタム系抗菌薬は第1世代セフェムのセファゾリンのようにグラム陽性菌に強いものもあれば第3世代セフェムのセフタジジムやモノバクタム系のようにグラム陰性菌にしか効果のないものもある。カルバペネム系や第4世代のセフェピムのようにグラム陽性菌から陰性菌まで非常に広い抗菌スペクトルを持った抗菌薬であったとしても、レジオネラやクラミジアには全く効かない。リケッチア属の発疹チフスリケッチアやマイコプラズマ、ウイルスのように小さくてエネルギー産生系を持たないか、細胞外では不安定なため単独では増殖しない細胞内寄生菌(もちろんウイルスは細菌ではない)には広域セフェムもカルバペネムも全く効果がないのだ。これらの細胞内寄生菌はマクロファージによって食菌された後、その殺菌機能をかいくぐって宿主細胞内で寄生して増殖できる。ということは寄生したマクロファージや細胞内に入りこんで殺菌できる脂溶性の抗菌薬しか効かない。水溶性の高いβラクタム系抗菌薬やアミノグリコシド系抗菌薬は細胞外液のみに分布し脂質二重層を通過できない、つまり細胞内には入れないため細胞内寄生菌には全く効果がないのだ。バンコマイシンなどのグリコペプチド系抗菌薬の分子量は1400~1900Daと大きいので細胞内には入らない(だから内服しても吸収されない)ので細胞内寄生菌には無効だと考えよう。細胞内寄生菌には細胞壁、つまりペプチドグリカンを含まない。これらの非定型肺炎の中で水棲菌で空調設備に用いる循環水や温泉で繁殖しやすいレジオネラはエアロゾルを介して高齢者に感染すると致死性肺炎をきたすことがあるため、重症感染症のエンピリック療法にはグラム陽性菌+グラム陰性菌だけでなく、細胞内寄生菌をカバーするために脂溶性が高く細胞内に分布できるマクロライド系を併用する。脂溶性の高いテトラサイクリン系、キノロン系、クロラムフェニコールも同様に細胞内寄生菌に奏功するはずだ。この中でキノロン系は殺菌力が強く抗菌スペクトルも広いが、キノロン以外の脂溶性抗菌薬は静菌的で臨床的用途はほぼ非定型菌に限られることは抗菌薬シリーズ第2回にすでに話したね。
2. グラム陰性菌にはバンコマイシンは無効でマクロライドも弱い、だけどコリスチンは陰性菌に強い、ペニシリンの中でピペラシリンのみ陰性菌に強いのはどうやって理解する?
グリコペプチド系抗菌薬はβラクタム系と同じく細胞壁合成阻害作用によって殺菌し、分厚い細胞壁をもつグラム陽性菌の大部分に効果を示すが、グラム陰性菌には効果がない。日本では「グリコペプチド系=MRSA治療薬」と思っている方が多いと思うが、バンコマイシンは1956年に開発された古い抗生物質なのに耐性化しにくいので欧米では重篤でグラム陽性菌感染症の切り札としても古くから多用されている。日本でも多剤耐性のグラム陽性菌感染症には使うことがあるだろう。筆者は「公知申請」って言葉を知らないで添付文書通りにしか疑義照会できない薬剤師をどうも好きになれない。
マクロライドはモラクセラ(ブランハメラ),インフルエンザ菌やバクテロイデスなどの菌体表面が疎水性のごく一部のグラム陰性菌を除いては、グラム陰性菌に対して抗菌力を示さない。この理由は外膜に存在するリポ多糖(lipopolysaccharide;LPS)のO抗原が親水性であるために,疎水度の高いマクロライド系が通過することができないためと考えられている。でももっとわかりやすい記憶の仕方はグラム陰性菌の持つポーリン(孔)は分子量600Da以下の小さい親水性物質が通過しやすいことから考えると分子量の大きいグリコペプチド系(1400~1900Da)はポーリンporin(アクアポリンaquaporinと語源は同じでチャネルと理解しよう)を通過するわけないので効かない。巨大な環状構造を持つマクロライド(図2)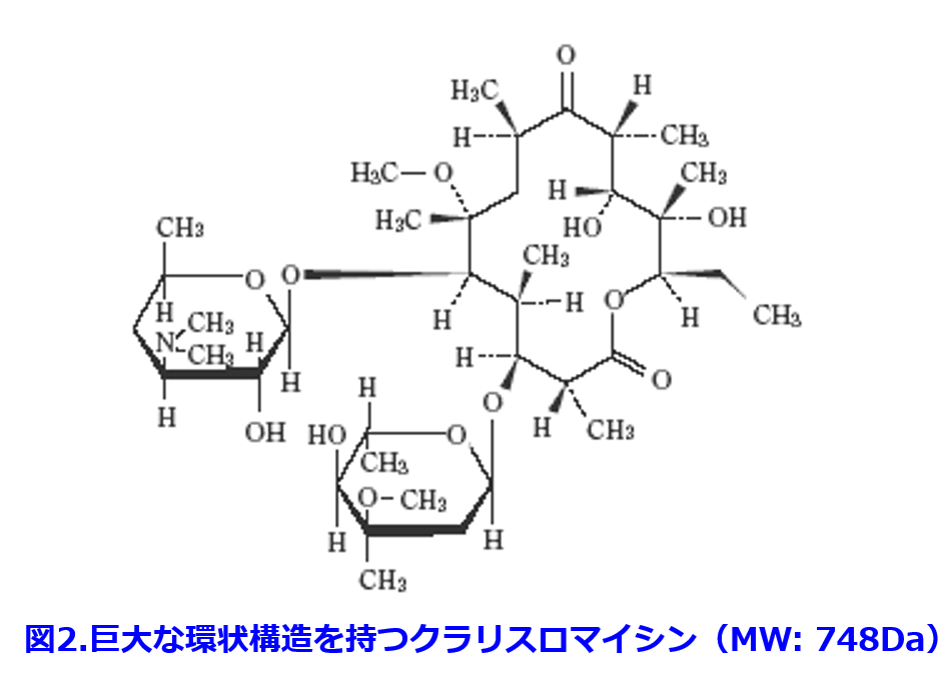 もポーリンを通りにくいから効きにくいと理解しよう(理論的にあっているかは定かではないが)(図3)。逆にポーリンを通りやすい抗菌薬はグラム陰性菌に効く。当然、ポーリンの孔径が狭くなったり、ポーリンの数が減少した細菌は耐性を示すことになる。
もポーリンを通りにくいから効きにくいと理解しよう(理論的にあっているかは定かではないが)(図3)。逆にポーリンを通りやすい抗菌薬はグラム陰性菌に効く。当然、ポーリンの孔径が狭くなったり、ポーリンの数が減少した細菌は耐性を示すことになる。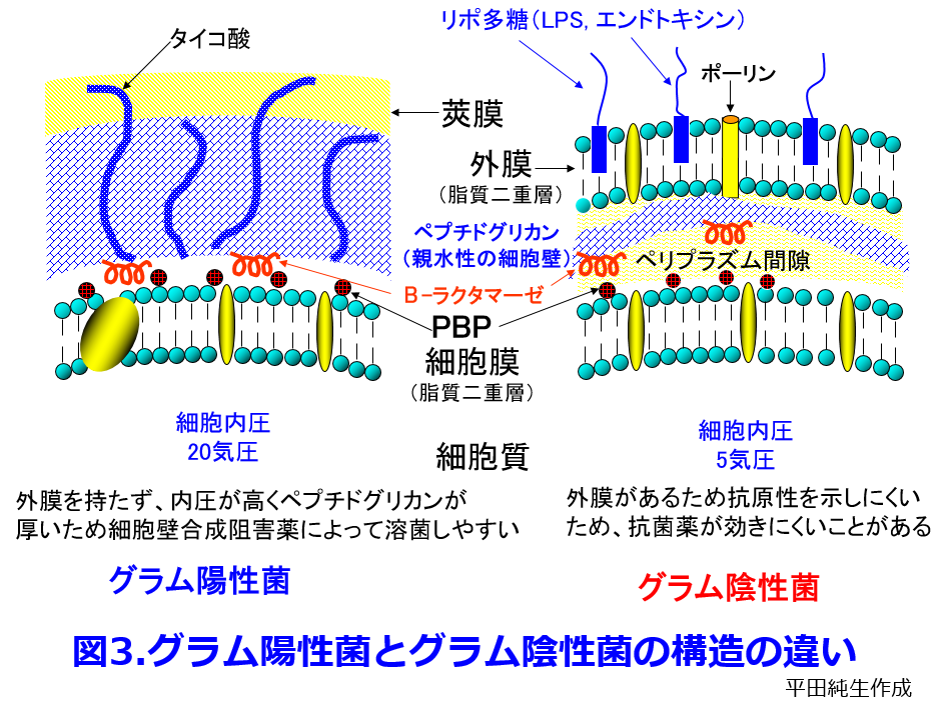
ポリペプチド系のコリスチンは別名ポリミキシンE、つまり腸内殺菌に使うポリミキシンBの仲間だ。図4に示すようにコリスチンは陽性荷電が強く、グラム陰性菌の細胞壁外膜を構成するリポ多糖(LPS: Lipopolysaccharide)に結合して膜に存在する2価Ca2+やMg2+と置換することによって、細胞膜透過性を変化させ細胞膜を破壊する。LPSはグラム陰性菌にしかない(図3)のでコリスチンはグラム陰性菌に強いと理解しよう。陽性荷電が強いためにメタンスルホン酸N a塩にしているコリスチンは1950年代に日本で発見され、赤痢などに使用されていた。しかし腎障害・神経障害が強いため、日本では製造中止になったものの、多剤耐性緑膿菌やアシネトバクターに効果的な抗菌薬がなかったため、海外から個人輸入することになり、感染症関係の学会が合同して厚労省に嘆願して2015年に再発売になったいわくつきの抗菌薬だ。LPSの変異によってコリスチンが耐性になることもこれで理解できる。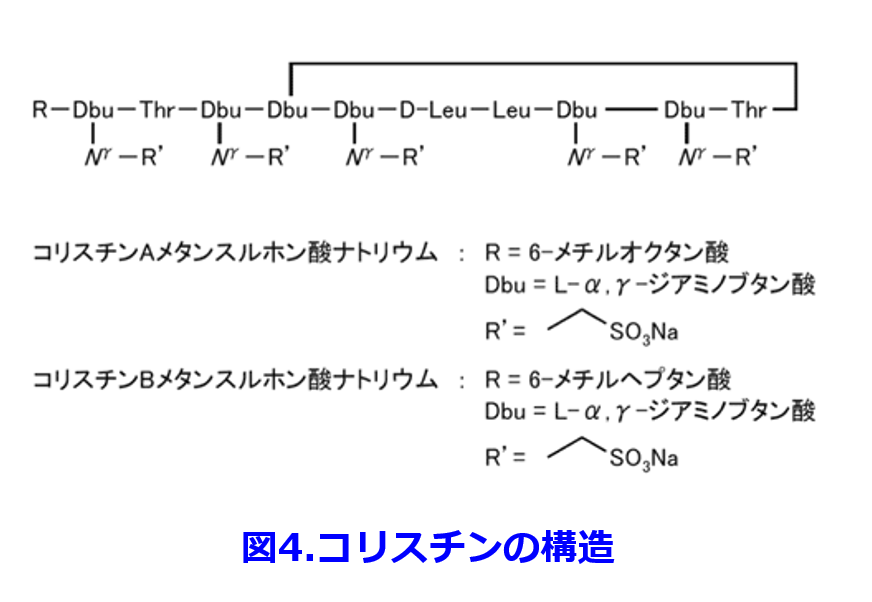 ペニシリンGの親水性を増したABPC、そしてABPCの吸収率が50%と不良なので水酸基を付けて吸収率を92%に上げただけのAMPC(ABPCと抗菌スペクトルは同じ: 図5)、ピペラシリンPIPCが緑膿菌をはじめとしたグラム陰性菌に強い革命的なペニシリンになったのはポーリンを通りやすくなったからと理解するとペニシリン系の抗菌スペクトラムもほぼ完全制覇できる。
ペニシリンGの親水性を増したABPC、そしてABPCの吸収率が50%と不良なので水酸基を付けて吸収率を92%に上げただけのAMPC(ABPCと抗菌スペクトルは同じ: 図5)、ピペラシリンPIPCが緑膿菌をはじめとしたグラム陰性菌に強い革命的なペニシリンになったのはポーリンを通りやすくなったからと理解するとペニシリン系の抗菌スペクトラムもほぼ完全制覇できる。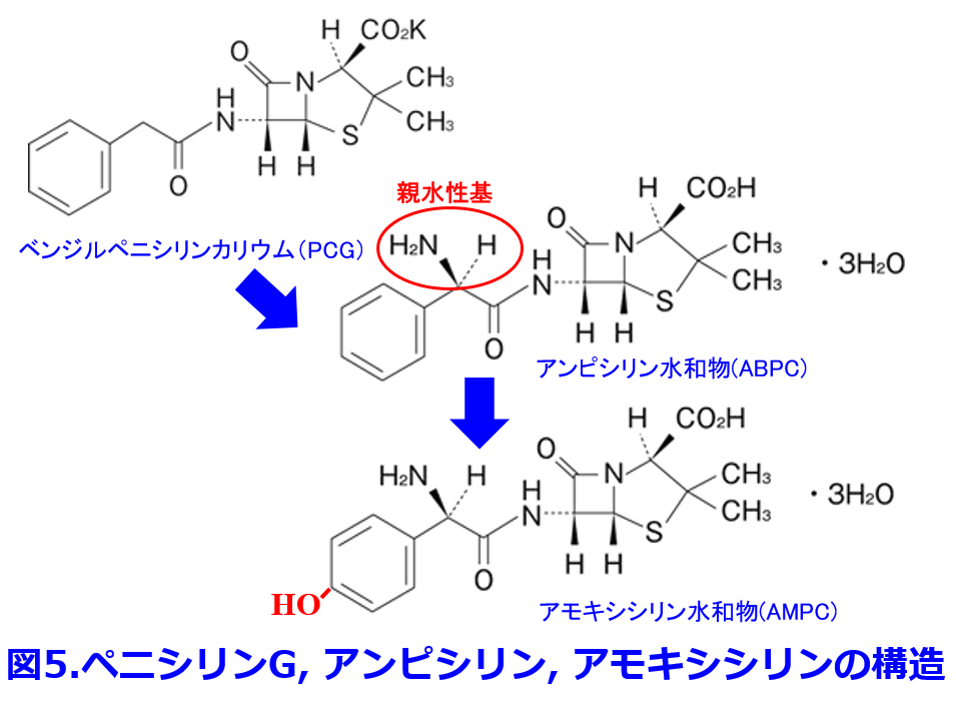 図3の右に示すグラム陰性菌の外膜にはリポ多糖、つまりエンドトキシン(内毒素)が存在するめ、ある種の抗菌薬の投与によりグラム陰性菌が死滅・破壊されると、生体に内毒素が放出されることにより、単球・マクロファージの細胞膜レセプターであるCD14およびTLR (Toll-like receptor) -4によって認識され、TNF-α,IL-1,IL-6,やIL-8などの炎症性サイトカインが産生され、エンドトキシンショックや多臓器不全を引き起こすことがあり、病原性が高い。それに対し図3の左に示すグラム陽性菌は内圧が高く、それに対応して厚いペプチドグリカン層を持つため、増殖スピードは速いものの、細胞壁合成阻害薬のペニシリン系やグリコペプチド系抗菌薬によって溶菌しやすく、高齢者が罹患しやすい常在菌による日和見菌が多い。ただしMRSAのように毒素を産生する手ごわい耐性菌もある。
図3の右に示すグラム陰性菌の外膜にはリポ多糖、つまりエンドトキシン(内毒素)が存在するめ、ある種の抗菌薬の投与によりグラム陰性菌が死滅・破壊されると、生体に内毒素が放出されることにより、単球・マクロファージの細胞膜レセプターであるCD14およびTLR (Toll-like receptor) -4によって認識され、TNF-α,IL-1,IL-6,やIL-8などの炎症性サイトカインが産生され、エンドトキシンショックや多臓器不全を引き起こすことがあり、病原性が高い。それに対し図3の左に示すグラム陽性菌は内圧が高く、それに対応して厚いペプチドグリカン層を持つため、増殖スピードは速いものの、細胞壁合成阻害薬のペニシリン系やグリコペプチド系抗菌薬によって溶菌しやすく、高齢者が罹患しやすい常在菌による日和見菌が多い。ただしMRSAのように毒素を産生する手ごわい耐性菌もある。
これらは抗菌薬の物性から理解できると思われるが、この薬剤師の得意とする物性や動態を知っておけば病態によって使うべき抗菌薬が分かるという例を紹介したい。
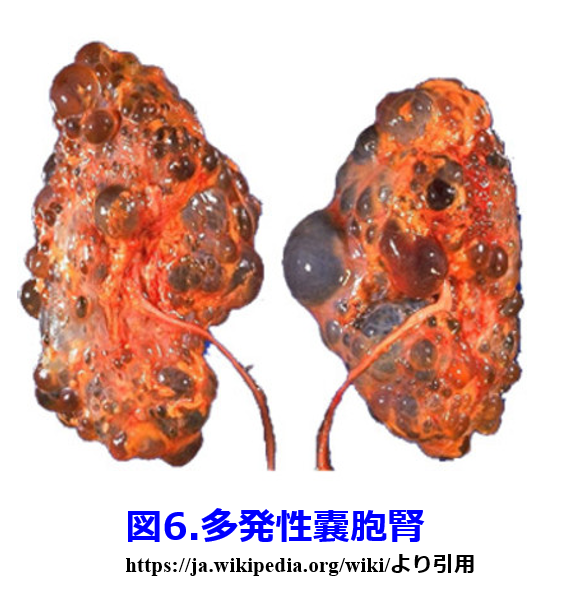 腎臓のサイズが巨大になって透析導入になる遺伝的な疾患だ(図6)。尿路からの逆行性感染が多く、起炎菌は大部分が腸管由来で、グラム陰性桿菌が多い。閉鎖腔の感染であるため難治化し再燃を繰り返すといわれている。ここで筆者が薬剤師時代に経験した20年近く前の症例を紹介したい。
腎臓のサイズが巨大になって透析導入になる遺伝的な疾患だ(図6)。尿路からの逆行性感染が多く、起炎菌は大部分が腸管由来で、グラム陰性桿菌が多い。閉鎖腔の感染であるため難治化し再燃を繰り返すといわれている。ここで筆者が薬剤師時代に経験した20年近く前の症例を紹介したい。
症例
60歳代、男性
原疾患:多発性嚢胞腎、透析歴4年
既往歴
某年2月右嚢胞腎感染PAPM/BP (カルベニンⓇ)effective, CEZ(セファメジンⓇ), CAZ (モダシンⓇ)not effective
3月右嚢胞腎感染PAPM/BP effective
5月右嚢胞腎感染PAPM/BP effective
6月右嚢胞腎感染PAPM/BP effective
現病歴
某年8/1~8/14:右嚢胞腎感染PAPM/BP effective, CTM(パンスポリンⓇ)not effective
8/20~9/2:右嚢胞腎感染PAPM/BP effective
9/26~10/7:右嚢胞腎感染PAPM/BP effective
ということでセファゾリン、セフタジジム、セフォチアムなどのセフェムが無効でカルバペネム系のパニペネム・ベタミプロンが毎回奏功した症例だが、なぜかほぼ2週間おきに再発を繰り返している。この9月末に服薬指導の担当になったのが筆者だ。患者さんのCRPは20mg/L以上、体温は39℃前後でかなり消耗しており、「なんで同じ病気をくりかえすんやろ?」と悩んでいた。
ただしこの当時、蔵書が豊富なことで有名な白鷺病院でも嚢胞腎感染について詳述された記載の書物は皆無だった。こんな時に筆者が頼るのがPubMed検索である。とりあえず、「polycystic kidney, infection, antibioticsなど」で検索するとこの当時は20報足らず(現在では172報)しかヒットしなかったが、キノロン薬のシプロフロキサシン(シプロキサンⓇ)は血清濃度の4倍以上1)、ST合剤(バクタⓇ)は血清濃度の8倍以上2)の高濃度で腎嚢胞内に移行することが分かった。これらの結果および物性・動態から腎嚢胞内に移行できる殺菌性でかつ脂溶性の抗菌薬はキノロンをおいて他にないと考え、レボフロキサシン200mg分1×14日分を主治医に進言し、了承された。実はシプロフロキサシンを在庫していなかったのと尿路からの逆行性感染を考慮すると腎排泄のものがいいかもしれないと考えたが、透析患者としては多めなので、筆者は毎朝、副作用・効果のモニタリングのため患者を訪問した。すると10/8よりPAPM/BPからキノロンに変更し、2週間服用するまでもなく、6日目の10月14日に全快・退院し、以降の再発はなかった。
おそらく嚢胞外に漏れ出た細菌が腎盂腎炎のような激烈な感染症症状を引き起こし、それをカルバペネムによって殺菌できて、自覚症状が改善して退院できたものの、カルバペネムは嚢胞内に入ることはできないため再発を繰り返した(のではないかと思うがこの考えがあっているかは定かではない)。嚢胞内に移行可能な脂溶性で殺菌性抗菌薬のキノロンによって完治できたと考察した。ただしこの症例について講演会で話すと「レボフロキサシンは腎排泄だから水溶性で嚢胞に移行するはずがない。この報告は間違っている!」とある著名な腎臓内科医に決めつけられ、痛く傷ついた思い出があるが、この腎臓内科医の考えは間違いで、腎排泄性キノロンであっても物性は脂溶性で嚢胞移行性は高い。βラクタムのVdは0.2~0.3L/kgでPAPM/BPは嚢胞内に移行しにくいがキノロンのVdは1.0~6L/kgと完全な脂溶性で組織移行性は高いのだ。現在では「エビデンスに基づく多発性嚢胞腎(PKD)診療ガイドライン2014では脂溶性で嚢胞透過性良好なニューキノロン系抗菌薬は嚢胞感染症に推奨される」となった3)。
引用文献
1.Antimicrob Agents Chemother 32: 844-847, 1988. PMID: 3415205
2.Kidney Int 32: 884-888, 1987. PMID: 3123761
3. エビデンスに基づく多発性嚢胞腎(PKD)診療ガイドライン2014
日米で腎臓病患者への服薬指導のポイントが違う?-前編-
Pharmacist Discusses Medications for Kidney Disease(UC Sandiego Health)をyoutubeで視聴して
アマゾンプライムで見ることにできるGrey’s Anatomyという米国テレビドラマは医学用語の勉強になるのでコロナ禍のリモートワークの時にはよく見ていました。やけに院内恋愛が多いので気になりましたが…。最近、若い人はテレビよりもYoutubeをよく見るような時代になってきたらしいですね。ブームに乗るわけではないのですが、医学薬学情報をYoutubeで見ると医学英会話の勉強にもなりますし、国際学会での講演が聞き取りやすくなるので、昔からよく見ていました。腎臓の解剖学なども教科書を読むよりわかりやすく楽しいです。今回、薬剤師の腎臓病患者さんへの服薬指導についてのYoutubeを見ましたが、ちょっと????と思うことがありましたので、それについて解説してみたいと思います。青字がYoutubeでの米国薬剤師の説明内容、黒字が僕の感想です。
降圧薬の中でRAS阻害薬は夜のむといいかも。食欲がなく、飲み物も取れない元気がないときには、元気になるまで一時的に飲むのをやめることを医師が進言するかも
ある種の利尿薬は光線過敏症があるので気を付ける。
ちなみにARBは「アーブ(Rの発音がむつかしい)」と発音していました。UFOのことは「ユーフォー」とはNativeは言わないらしいですが…。
「食欲がなく、飲み物も取れないようなときに元気がないとき医師が一時中止する」これはRAS阻害薬による腎機能悪化を防ぐSick day対策としてはいい指導と思いますが、「高齢者で夏季には特に」そして「飲水励行」というのを付けくわえたいです。
利尿薬に光線過敏症は確かにあるけど、すごく重要とは思っていませんでした。白人だから多いのではないかしら?
ニフェジピンは夜にのんだ方がいい
RAS阻害薬でも夜にのんだ方がいいといっていましたが、ニフェジピンは24時間効果のある時効錠のことだと思うけど、「Non-dipper(睡眠時に血圧が高いままの人)なら高血圧による臓器障害が起こりやすいので」という説明が欲しかったです。Dipperの人にまでわざわざ「夜にのんで」ということはないでしょう。 というか、睡眠時に血圧を測定する人はほとんどいないんじゃないかしら。米国で非常に多い心筋梗塞が早朝(午前6時から8時)と夜間(午後8時から10時ごろ)に起こりやすいからかもしれません。
というか、睡眠時に血圧を測定する人はほとんどいないんじゃないかしら。米国で非常に多い心筋梗塞が早朝(午前6時から8時)と夜間(午後8時から10時ごろ)に起こりやすいからかもしれません。
アムロジピンでシンバスタチン濃度が上昇する
確かに、その可能性はあるけれど、もっともっと血中濃度が上がるはずのイトラコナゾール(併用で活性体のシンバスタチン酸の血中濃度が19倍になることが知られている[Neuvonen PJ, et al: Clin Pharmacol Ther 63: 332-341, 1998])やボリコナゾール、クラリスロマイシン(添付文書では禁忌になっていないけど禁忌レベルで、横紋融解筋症による腎機能悪化で透析導入になった症例報告もあるし[Lee AJ, Maddix DS: Ann Pharmacother 35: 26-31, 2001])、抗HIV薬(以上、CYP3A4阻害薬)、フィブラート系薬物(横紋融解筋症が起こりやすい)、シクロスポリン(これはOATP1B1阻害薬+CYP3A4阻害薬)の方が重要だし、グレープフルーツや九州・四国の特産品の文旦類の柑橘類の方が重要なんじゃないかしら(薬剤情報提供用紙を渡すだけではなく口頭説明も必要なレベル)。米国は心筋梗塞による死亡率が非常に高いからシンバスタチンの最高用量は80mg/日なっているので、気をつけなくっちゃいけないとは思うけど…。
アムロジピンの添付文書ではシンバスタチン80mgに併用するとシンバスタチンのAUCが77%上昇したと書かれているけど、上記の薬物の相互作用は数倍~20倍になるので1.77倍はあまり大したことはないと思っています。薬剤情報提供用紙に書いておけばそれでよしというレベルだと思います。
CKD患者の低血糖時にはオレンジジュースはやめてリンゴジュースかブドウ糖の錠剤に使用。だってオレンジはカリウムが高いから。
オレンジジュースのカリウム濃度は 180mg/100gで42kcal、りんごジュースのカリウム濃度は77 mg/100gで44kcal。なるほど!でも含量が比較的少ないとはいえ、リンゴジュースを高カリウムの人に勧められるかしら?
◆連載◆臨床上、問題になる菌は青丸か赤長が多い 第1回
最初に断っておくが、筆者は微生物学を正式に習っておらず、非常に苦手な分野だったが、筆者が病院薬剤師だったころ、透析患者が感染症に罹患しやすいので、「学ばなければ!」とは思ったものの、細菌名ってとても覚えにくいし、どのように分類すべきかもわからなかった。今も得意とは言えないけれど、現場で体験した感染症を起こす細菌はメチシリン耐性黄色ブドウ球菌MRSAや表皮ブドウ球菌MRSE、肺炎球菌、溶連菌など、グラム陽性菌って「ほとんど丸い球菌じゃん!」ということに気づいた。偶然かもしれないが大腸菌、インフルエンザ菌や難儀な感染症の緑膿菌などはグラム陰性菌って「ほとんど細長い桿菌じゃん!」と気づいた。これでようやく覚えられることができるような気がしたのだった。この連載の最初の部分では頭の悪い筆者がややこしい細菌の名前や分類にどうやって対処したかについて解説したい。まずは非常に基本的なグラム染色について知ってもらおう。微生物学や細菌学などの専門家にとっては間違った理論になるかもしれないので閲覧注意です。あくまで、感染症が苦手な方で正確な理論を知る前に実践に強くなりたい方のみに読んでいただければ幸いです。
1.細菌の構造とグラム染色
グラム染色は染色によって紫色に染まるものをグラム陽性、紫色に染まらず赤く見えるものをグラム陰性という(図1)。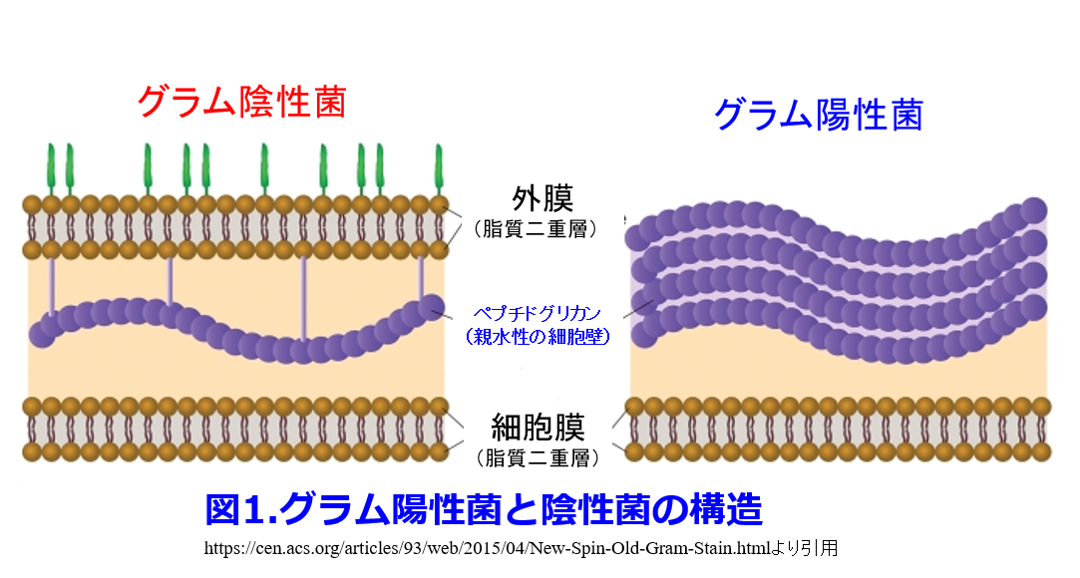 この染色性の違いは細胞壁の構造の違いによる。
この染色性の違いは細胞壁の構造の違いによる。
グラム染色の手順と原理 (図2)
1.検体(喀痰の場合、唾液ではなく膿性の黄色~黄緑色の粘稠の物がよい)をスライドグラスに定着する。
2.クリスタルバイオレットを作用させるとグラム陽性菌も陰性菌も青色に染まる。
3. 次にヨウ素液で媒染して濃紺色を定着させる。
4.アルコールをかけると濃紺に染色されたグラム陰性菌の脂質二重層でできた外膜が溶けて無色になるが、ペプチドグリカン層の厚いグラム陽性菌はアルコールによっても染色液は流出しないので濃紺色のまま。
5. 最後に赤色色素を作用させると, 無色となっていた細胞壁の薄いグラム陰性菌は赤色に染色される。
6.十分な水洗,・乾燥の後、顕微鏡で観察し、濃紺色をグラム陽性 (+), 赤色をグラム陰性 (-) と判定する。そして検体の採取部位(喀痰、尿、穿刺液など)、形状(双球菌、連鎖状の球菌、ブドウの房状の球菌など)から起因菌を推定する。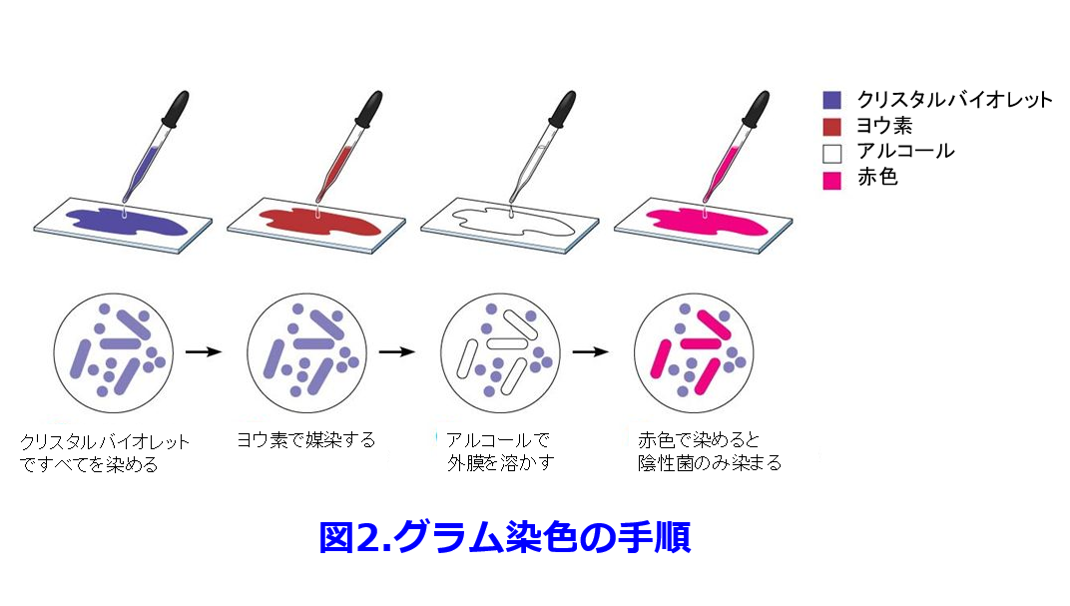
2.臨床で問題となる菌、つまり怖いのはたいてい青丸と赤長
ここで重症細菌感染症になりやすい6種の代表的な病原菌を見てみよう。高齢者の院内感染として問題となるMRSAやブドウ球菌Staphylococcus aureus:図3)はブドウの房状の陽性球菌で皮膚に常在する表皮ブドウ球菌Staphylococcus epidermidisも見た目は同じ。MRSAは健常者の鼻にも常在菌として存在することがある。
一般的に溶連菌と呼ばれ壊死性筋膜炎の原因菌となり、感染後に急性糸球体腎炎を起こすことで有名でペニシリンが有効なA群β溶状連鎖球菌(化膿レンサ球菌)Streptococcus pyogenesは陽性で連鎖状の球菌(図4)、市中肺炎の原因菌として最多の肺炎球菌Streptococcus pneumoniaeは陽性の双球菌(図5)。3つとも球菌なので、菌名には必ずcoccus(球菌)がついている。
普通に台所の水回りに生息し、日和見感染して多剤耐性になるとコリスチンしか効かない多剤耐性緑膿菌が現れて大問題になることがある陰性の桿菌は緑膿菌Pseudomonas aeruginosa(図6)、細菌性髄膜炎や小児肺炎の原因菌となりインフルエンザウイルスとは全く関係ないインフルエンザ菌Haemophilus influenzae(図7)も陰性の桿菌、通常は無害な腸内細菌として生息しているが細菌性尿路感染の最大の原因菌となり病原性を持つと赤痢を起こすこともある大腸菌Escherichia coli(図8)も陰性の桿菌である。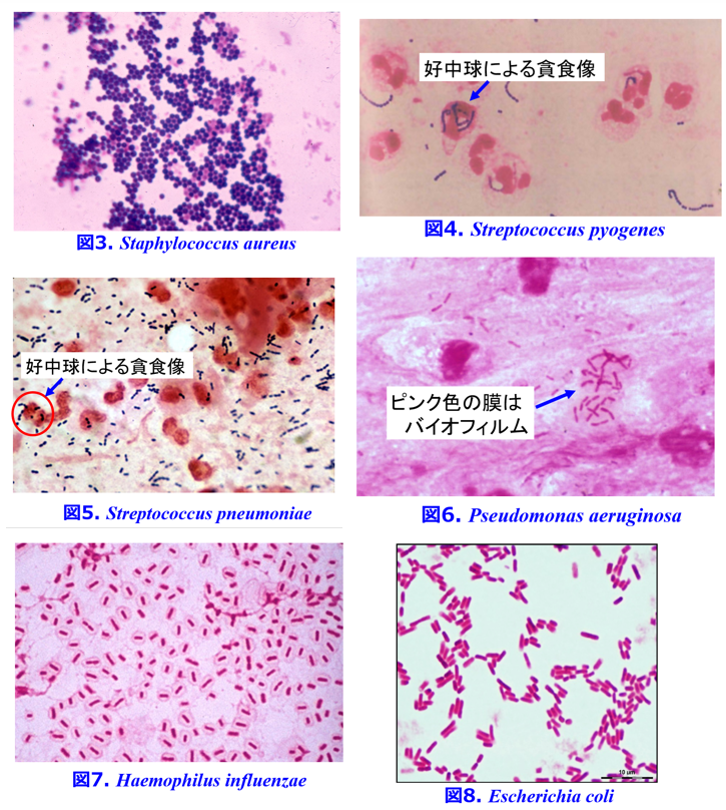
前者3つがグラム陽性菌で、後者3つがグラム陰性菌である。好中球による貪食像が見えるのは保菌者ではなく感染症を起こしていると考えよう。またバイオフィルムで包まれた緑膿菌感染症ではバイオフィルム外の緑膿菌をたたくと症状は改善するが、上記の嚢胞感染と同様に再発を繰り返すことが多いので難儀だ。この場合は14員環マクロライドのエリスロマイシン、クラリスロマイシンの少量投与でバイオフィルムを破壊し、裸になった菌を別の抗菌薬でたたくことによって治療できる(らしい)。1990年代以前、日本では5年生存率40%以下だったびまん性汎細気管支炎が、14員環マクロライドの少量投与でほぼ消滅するくらい画期的な療法になったのは有名な話だ。バイオフィルムの透過性が高いリファンピシンの併用が難治性感染では有効なこともある。もっとたくさんの細菌を見ていただきたいが、これだけ見ただけでも感染症の原因菌は濃紺色で丸いグラム陽性球菌と赤くて細長いグラム陰性桿菌が多いことが分かる。そう、細菌感染症となる起因菌としてマークすべきは青丸(グラム陽性球菌)と赤長(グラム陰性桿菌)なのだということを頭の中に入れておこう(すべてじゃないけどね)。
さて話が長くなったので、「抗菌スペクトルの理解の仕方」は次回のお楽しみにしよう。

