◆連載◆平田流・抗菌スペクトルの理解の仕方 第2回
抗菌薬の添付文書の適応菌種・適応症を見ると気が狂いそうになるのは筆者だけだろうか?適応菌種・適応症って不変のものじゃなく承認時期によって書き方が変わるし、菌種名が変わることもあるし、耐性化することもある。クロラムフェニコールは一世を風靡した抗菌薬で、適応症のなんと幅広いこと。だが、現在はほとんどの病院に在庫すらしていない(海外から帰国した腸チフス患者に使うかも?)。今回は抗菌薬によってさまざまな差が見られる抗菌スペクトルantibacterial spectrumについて、極めて記憶力の悪い筆者がどうやって自分なりにざっくりと分類して対処したのかについてまとめてみたい。
図1にあくまで広域スペクトルの抗菌薬であればということで最大限カバーできる範囲を示した。 したがってすべての抗菌薬がこのような広いスペクトルを持つのではなく「広域のものであれば」という仮定でのものであることをご了承いただきたい。また繰り返すが、筆者は感染症学や微生物学の専門家ではないため、理論的に間違いがあるかもしれないが、理解しやすくするための手段だとしてご容赦いただきたい。
したがってすべての抗菌薬がこのような広いスペクトルを持つのではなく「広域のものであれば」という仮定でのものであることをご了承いただきたい。また繰り返すが、筆者は感染症学や微生物学の専門家ではないため、理論的に間違いがあるかもしれないが、理解しやすくするための手段だとしてご容赦いただきたい。
1.広域βラクタム薬であってもレジオネラやクラミジアなどの非定型菌に効くはずがない
セフェム、ペニシリン、カルバペネムなどのβラクタム系抗菌薬は第1世代セフェムのセファゾリンのようにグラム陽性菌に強いものもあれば第3世代セフェムのセフタジジムやモノバクタム系のようにグラム陰性菌にしか効果のないものもある。カルバペネム系や第4世代のセフェピムのようにグラム陽性菌から陰性菌まで非常に広い抗菌スペクトルを持った抗菌薬であったとしても、レジオネラやクラミジアには全く効かない。リケッチア属の発疹チフスリケッチアやマイコプラズマ、ウイルスのように小さくてエネルギー産生系を持たないか、細胞外では不安定なため単独では増殖しない細胞内寄生菌(もちろんウイルスは細菌ではない)には広域セフェムもカルバペネムも全く効果がないのだ。これらの細胞内寄生菌はマクロファージによって食菌された後、その殺菌機能をかいくぐって宿主細胞内で寄生して増殖できる。ということは寄生したマクロファージや細胞内に入りこんで殺菌できる脂溶性の抗菌薬しか効かない。水溶性の高いβラクタム系抗菌薬やアミノグリコシド系抗菌薬は細胞外液のみに分布し脂質二重層を通過できない、つまり細胞内には入れないため細胞内寄生菌には全く効果がないのだ。バンコマイシンなどのグリコペプチド系抗菌薬の分子量は1400~1900Daと大きいので細胞内には入らない(だから内服しても吸収されない)ので細胞内寄生菌には無効だと考えよう。細胞内寄生菌には細胞壁、つまりペプチドグリカンを含まない。これらの非定型肺炎の中で水棲菌で空調設備に用いる循環水や温泉で繁殖しやすいレジオネラはエアロゾルを介して高齢者に感染すると致死性肺炎をきたすことがあるため、重症感染症のエンピリック療法にはグラム陽性菌+グラム陰性菌だけでなく、細胞内寄生菌をカバーするために脂溶性が高く細胞内に分布できるマクロライド系を併用する。脂溶性の高いテトラサイクリン系、キノロン系、クロラムフェニコールも同様に細胞内寄生菌に奏功するはずだ。この中でキノロン系は殺菌力が強く抗菌スペクトルも広いが、キノロン以外の脂溶性抗菌薬は静菌的で臨床的用途はほぼ非定型菌に限られることは抗菌薬シリーズ第2回にすでに話したね。
2. グラム陰性菌にはバンコマイシンは無効でマクロライドも弱い、だけどコリスチンは陰性菌に強い、ペニシリンの中でピペラシリンのみ陰性菌に強いのはどうやって理解する?
グリコペプチド系抗菌薬はβラクタム系と同じく細胞壁合成阻害作用によって殺菌し、分厚い細胞壁をもつグラム陽性菌の大部分に効果を示すが、グラム陰性菌には効果がない。日本では「グリコペプチド系=MRSA治療薬」と思っている方が多いと思うが、バンコマイシンは1956年に開発された古い抗生物質なのに耐性化しにくいので欧米では重篤でグラム陽性菌感染症の切り札としても古くから多用されている。日本でも多剤耐性のグラム陽性菌感染症には使うことがあるだろう。筆者は「公知申請」って言葉を知らないで添付文書通りにしか疑義照会できない薬剤師をどうも好きになれない。
マクロライドはモラクセラ(ブランハメラ),インフルエンザ菌やバクテロイデスなどの菌体表面が疎水性のごく一部のグラム陰性菌を除いては、グラム陰性菌に対して抗菌力を示さない。この理由は外膜に存在するリポ多糖(lipopolysaccharide;LPS)のO抗原が親水性であるために,疎水度の高いマクロライド系が通過することができないためと考えられている。でももっとわかりやすい記憶の仕方はグラム陰性菌の持つポーリン(孔)は分子量600Da以下の小さい親水性物質が通過しやすいことから考えると分子量の大きいグリコペプチド系(1400~1900Da)はポーリンporin(アクアポリンaquaporinと語源は同じでチャネルと理解しよう)を通過するわけないので効かない。巨大な環状構造を持つマクロライド(図2)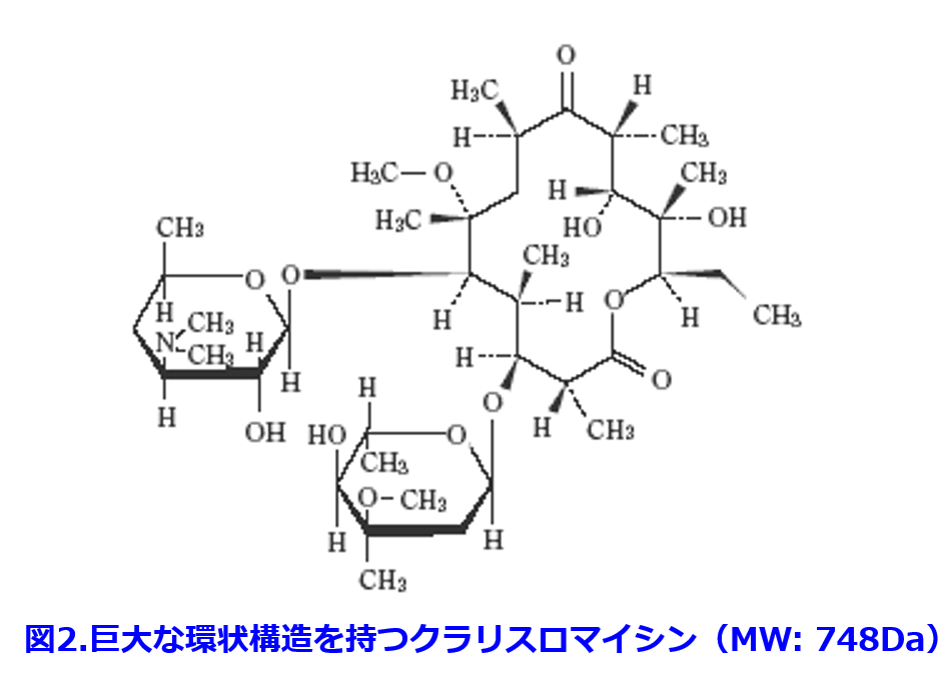 もポーリンを通りにくいから効きにくいと理解しよう(理論的にあっているかは定かではないが)(図3)。逆にポーリンを通りやすい抗菌薬はグラム陰性菌に効く。当然、ポーリンの孔径が狭くなったり、ポーリンの数が減少した細菌は耐性を示すことになる。
もポーリンを通りにくいから効きにくいと理解しよう(理論的にあっているかは定かではないが)(図3)。逆にポーリンを通りやすい抗菌薬はグラム陰性菌に効く。当然、ポーリンの孔径が狭くなったり、ポーリンの数が減少した細菌は耐性を示すことになる。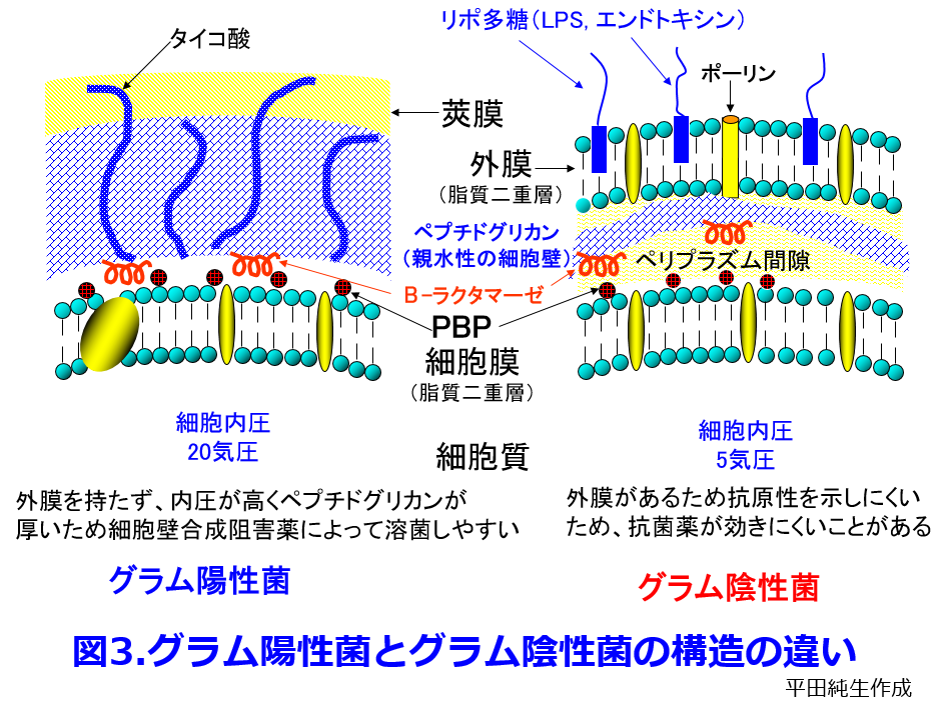
ポリペプチド系のコリスチンは別名ポリミキシンE、つまり腸内殺菌に使うポリミキシンBの仲間だ。図4に示すようにコリスチンは陽性荷電が強く、グラム陰性菌の細胞壁外膜を構成するリポ多糖(LPS: Lipopolysaccharide)に結合して膜に存在する2価Ca2+やMg2+と置換することによって、細胞膜透過性を変化させ細胞膜を破壊する。LPSはグラム陰性菌にしかない(図3)のでコリスチンはグラム陰性菌に強いと理解しよう。陽性荷電が強いためにメタンスルホン酸N a塩にしているコリスチンは1950年代に日本で発見され、赤痢などに使用されていた。しかし腎障害・神経障害が強いため、日本では製造中止になったものの、多剤耐性緑膿菌やアシネトバクターに効果的な抗菌薬がなかったため、海外から個人輸入することになり、感染症関係の学会が合同して厚労省に嘆願して2015年に再発売になったいわくつきの抗菌薬だ。LPSの変異によってコリスチンが耐性になることもこれで理解できる。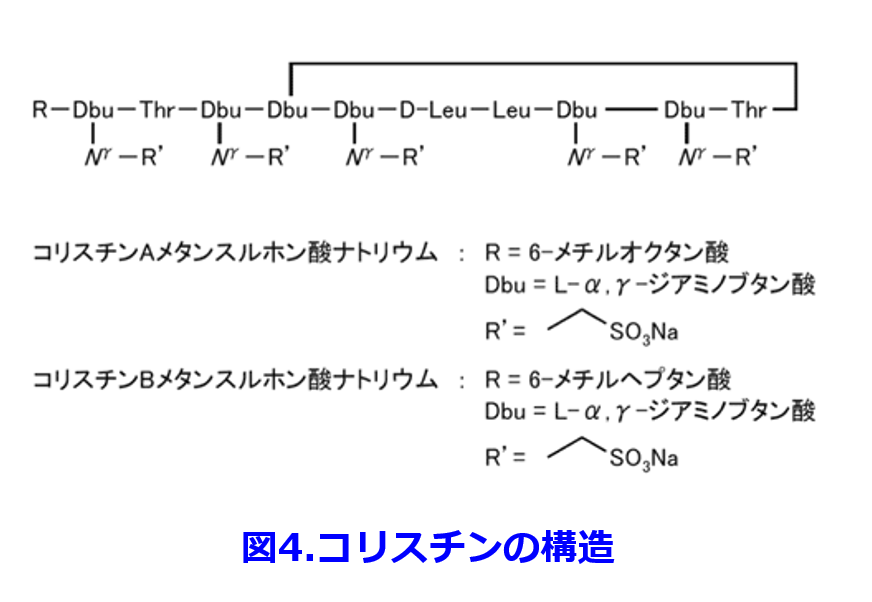 ペニシリンGの親水性を増したABPC、そしてABPCの吸収率が50%と不良なので水酸基を付けて吸収率を92%に上げただけのAMPC(ABPCと抗菌スペクトルは同じ: 図5)、ピペラシリンPIPCが緑膿菌をはじめとしたグラム陰性菌に強い革命的なペニシリンになったのはポーリンを通りやすくなったからと理解するとペニシリン系の抗菌スペクトラムもほぼ完全制覇できる。
ペニシリンGの親水性を増したABPC、そしてABPCの吸収率が50%と不良なので水酸基を付けて吸収率を92%に上げただけのAMPC(ABPCと抗菌スペクトルは同じ: 図5)、ピペラシリンPIPCが緑膿菌をはじめとしたグラム陰性菌に強い革命的なペニシリンになったのはポーリンを通りやすくなったからと理解するとペニシリン系の抗菌スペクトラムもほぼ完全制覇できる。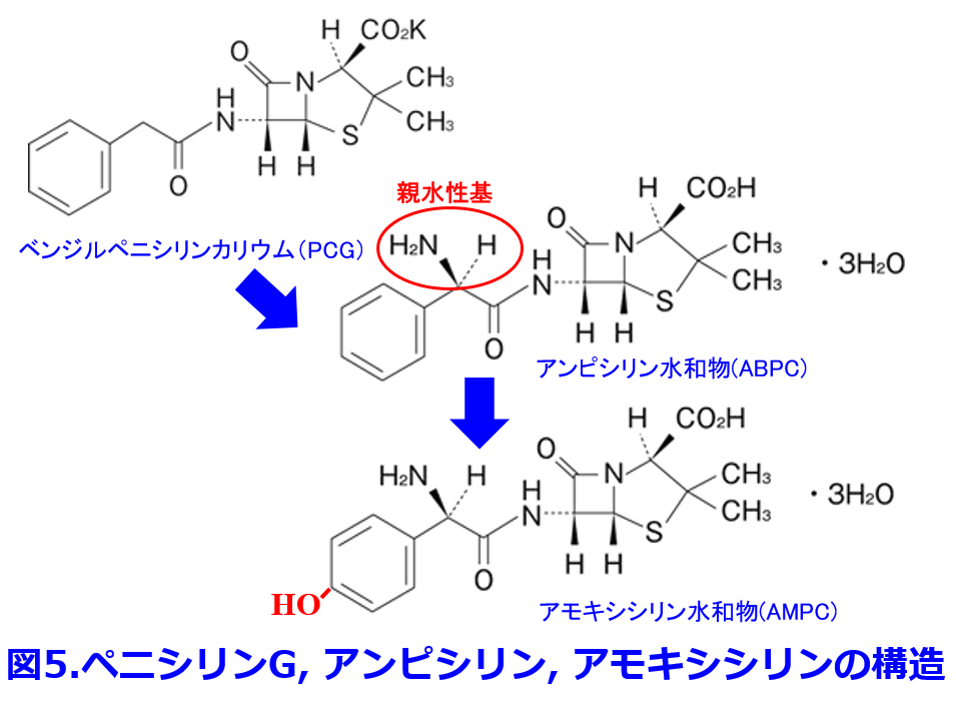 図3の右に示すグラム陰性菌の外膜にはリポ多糖、つまりエンドトキシン(内毒素)が存在するめ、ある種の抗菌薬の投与によりグラム陰性菌が死滅・破壊されると、生体に内毒素が放出されることにより、単球・マクロファージの細胞膜レセプターであるCD14およびTLR (Toll-like receptor) -4によって認識され、TNF-α,IL-1,IL-6,やIL-8などの炎症性サイトカインが産生され、エンドトキシンショックや多臓器不全を引き起こすことがあり、病原性が高い。それに対し図3の左に示すグラム陽性菌は内圧が高く、それに対応して厚いペプチドグリカン層を持つため、増殖スピードは速いものの、細胞壁合成阻害薬のペニシリン系やグリコペプチド系抗菌薬によって溶菌しやすく、高齢者が罹患しやすい常在菌による日和見菌が多い。ただしMRSAのように毒素を産生する手ごわい耐性菌もある。
図3の右に示すグラム陰性菌の外膜にはリポ多糖、つまりエンドトキシン(内毒素)が存在するめ、ある種の抗菌薬の投与によりグラム陰性菌が死滅・破壊されると、生体に内毒素が放出されることにより、単球・マクロファージの細胞膜レセプターであるCD14およびTLR (Toll-like receptor) -4によって認識され、TNF-α,IL-1,IL-6,やIL-8などの炎症性サイトカインが産生され、エンドトキシンショックや多臓器不全を引き起こすことがあり、病原性が高い。それに対し図3の左に示すグラム陽性菌は内圧が高く、それに対応して厚いペプチドグリカン層を持つため、増殖スピードは速いものの、細胞壁合成阻害薬のペニシリン系やグリコペプチド系抗菌薬によって溶菌しやすく、高齢者が罹患しやすい常在菌による日和見菌が多い。ただしMRSAのように毒素を産生する手ごわい耐性菌もある。
これらは抗菌薬の物性から理解できると思われるが、この薬剤師の得意とする物性や動態を知っておけば病態によって使うべき抗菌薬が分かるという例を紹介したい。
 腎臓のサイズが巨大になって透析導入になる遺伝的な疾患だ(図6)。尿路からの逆行性感染が多く、起炎菌は大部分が腸管由来で、グラム陰性桿菌が多い。閉鎖腔の感染であるため難治化し再燃を繰り返すといわれている。ここで筆者が薬剤師時代に経験した20年近く前の症例を紹介したい。
腎臓のサイズが巨大になって透析導入になる遺伝的な疾患だ(図6)。尿路からの逆行性感染が多く、起炎菌は大部分が腸管由来で、グラム陰性桿菌が多い。閉鎖腔の感染であるため難治化し再燃を繰り返すといわれている。ここで筆者が薬剤師時代に経験した20年近く前の症例を紹介したい。
症例
60歳代、男性
原疾患:多発性嚢胞腎、透析歴4年
既往歴
某年2月右嚢胞腎感染PAPM/BP (カルベニンⓇ)effective, CEZ(セファメジンⓇ), CAZ (モダシンⓇ)not effective
3月右嚢胞腎感染PAPM/BP effective
5月右嚢胞腎感染PAPM/BP effective
6月右嚢胞腎感染PAPM/BP effective
現病歴
某年8/1~8/14:右嚢胞腎感染PAPM/BP effective, CTM(パンスポリンⓇ)not effective
8/20~9/2:右嚢胞腎感染PAPM/BP effective
9/26~10/7:右嚢胞腎感染PAPM/BP effective
ということでセファゾリン、セフタジジム、セフォチアムなどのセフェムが無効でカルバペネム系のパニペネム・ベタミプロンが毎回奏功した症例だが、なぜかほぼ2週間おきに再発を繰り返している。この9月末に服薬指導の担当になったのが筆者だ。患者さんのCRPは20mg/L以上、体温は39℃前後でかなり消耗しており、「なんで同じ病気をくりかえすんやろ?」と悩んでいた。
ただしこの当時、蔵書が豊富なことで有名な白鷺病院でも嚢胞腎感染について詳述された記載の書物は皆無だった。こんな時に筆者が頼るのがPubMed検索である。とりあえず、「polycystic kidney, infection, antibioticsなど」で検索するとこの当時は20報足らず(現在では172報)しかヒットしなかったが、キノロン薬のシプロフロキサシン(シプロキサンⓇ)は血清濃度の4倍以上1)、ST合剤(バクタⓇ)は血清濃度の8倍以上2)の高濃度で腎嚢胞内に移行することが分かった。これらの結果および物性・動態から腎嚢胞内に移行できる殺菌性でかつ脂溶性の抗菌薬はキノロンをおいて他にないと考え、レボフロキサシン200mg分1×14日分を主治医に進言し、了承された。実はシプロフロキサシンを在庫していなかったのと尿路からの逆行性感染を考慮すると腎排泄のものがいいかもしれないと考えたが、透析患者としては多めなので、筆者は毎朝、副作用・効果のモニタリングのため患者を訪問した。すると10/8よりPAPM/BPからキノロンに変更し、2週間服用するまでもなく、6日目の10月14日に全快・退院し、以降の再発はなかった。
おそらく嚢胞外に漏れ出た細菌が腎盂腎炎のような激烈な感染症症状を引き起こし、それをカルバペネムによって殺菌できて、自覚症状が改善して退院できたものの、カルバペネムは嚢胞内に入ることはできないため再発を繰り返した(のではないかと思うがこの考えがあっているかは定かではない)。嚢胞内に移行可能な脂溶性で殺菌性抗菌薬のキノロンによって完治できたと考察した。ただしこの症例について講演会で話すと「レボフロキサシンは腎排泄だから水溶性で嚢胞に移行するはずがない。この報告は間違っている!」とある著名な腎臓内科医に決めつけられ、痛く傷ついた思い出があるが、この腎臓内科医の考えは間違いで、腎排泄性キノロンであっても物性は脂溶性で嚢胞移行性は高い。βラクタムのVdは0.2~0.3L/kgでPAPM/BPは嚢胞内に移行しにくいがキノロンのVdは1.0~6L/kgと完全な脂溶性で組織移行性は高いのだ。現在では「エビデンスに基づく多発性嚢胞腎(PKD)診療ガイドライン2014では脂溶性で嚢胞透過性良好なニューキノロン系抗菌薬は嚢胞感染症に推奨される」となった3)。
引用文献
1.Antimicrob Agents Chemother 32: 844-847, 1988. PMID: 3415205
2.Kidney Int 32: 884-888, 1987. PMID: 3123761
3. エビデンスに基づく多発性嚢胞腎(PKD)診療ガイドライン2014

