2020年5月
志の春さん真打昇進!
志の春さん真打昇進 おめでとうございます!
 昨年2020年11月に熊本で開催された第13回日本腎臓病薬物療法学会を独演会で「トリ」を務めていただき、閉会式も平田とのトークで盛り上げてくれました立川志の春さん、覚えてますよね。帰国子女でフォード、ブッシュ父子、クリントン、ヒラリーも卒業したイエール大学卒の秀才です。2002年に26歳でたまたま入った落語会で立川志の輔さんの落語を聞いて「これだ!」と思い、遅めの入門。2011年に9年かけて二つ目に昇進。まだ真打ではなかったのであまり有名ではありませんが、新作も古典も非常に面白い実力者で落語会だけでなく英語落語や執筆活動も熱心にやっていらっしゃる。学会でも皆さん、大爆笑していただきました。
昨年2020年11月に熊本で開催された第13回日本腎臓病薬物療法学会を独演会で「トリ」を務めていただき、閉会式も平田とのトークで盛り上げてくれました立川志の春さん、覚えてますよね。帰国子女でフォード、ブッシュ父子、クリントン、ヒラリーも卒業したイエール大学卒の秀才です。2002年に26歳でたまたま入った落語会で立川志の輔さんの落語を聞いて「これだ!」と思い、遅めの入門。2011年に9年かけて二つ目に昇進。まだ真打ではなかったのであまり有名ではありませんが、新作も古典も非常に面白い実力者で落語会だけでなく英語落語や執筆活動も熱心にやっていらっしゃる。学会でも皆さん、大爆笑していただきました。
立川流、特に師匠の志の輔さんは非常に厳しいのです。年功序列ではなく実力がなくては二つ目にだってなれないのです。 でもその辺の「真打」と称している落語家さん、テレビでよく目にする有名な落語家さんよりも古典も新作も志の春さんの方が圧倒的に面白いと僕は思っていますが、2020年4月1日付で「真打」に昇進されたそうです。誠におめでとうございます。真打昇進披露興行は東京でも千葉でも絶対に見に行きたいと思っていましたが、新型コロナの影響で延期のようです。あ~残念。
でもその辺の「真打」と称している落語家さん、テレビでよく目にする有名な落語家さんよりも古典も新作も志の春さんの方が圧倒的に面白いと僕は思っていますが、2020年4月1日付で「真打」に昇進されたそうです。誠におめでとうございます。真打昇進披露興行は東京でも千葉でも絶対に見に行きたいと思っていましたが、新型コロナの影響で延期のようです。あ~残念。
師匠の志の輔さんは一般的には「ガッテン」のおじさんのイメージが強いようですが、日本一チケットが一番取りにくい、つまり一番人気の落語家で、毎年秋に熊本に来て新作と60分以上の非常に味のある古典落語を聞かせていただいています。人情噺で泣かせ、いろんなところに笑いを入れて楽しませてくれて、いつも大爆笑です。志の春さんの落語も昨年、熊本だけでなく福岡でも見せていただきましたが、師匠と同じく新作・落語ともに味わい深くとっても面白い。学会が終わってからも、ご丁寧にあいさつに来られ、手ぬぐい(落語家さんの商売道具ですね:写真上は志の輔師匠、下は志の春師匠)をいただきました。 ラジオやポッドキャストでいつも聞いているように人柄も飾らず、ほんとにいい人でした。志の春さんの落語の面白さを伝えにくかったのですが、最近、Youtubeで「立川志の春Shinoharu Rakugo」を開設したようです。コロナで外出規制はしばらく続きそうですが、志の輔さん、志の春さんの落語を楽しみながら人の少ない夜中にランニング、ウォーキングをしたいと思っています。志の春さんの英語落語は英会話の勉強にもなりますよ。
ラジオやポッドキャストでいつも聞いているように人柄も飾らず、ほんとにいい人でした。志の春さんの落語の面白さを伝えにくかったのですが、最近、Youtubeで「立川志の春Shinoharu Rakugo」を開設したようです。コロナで外出規制はしばらく続きそうですが、志の輔さん、志の春さんの落語を楽しみながら人の少ない夜中にランニング、ウォーキングをしたいと思っています。志の春さんの英語落語は英会話の勉強にもなりますよ。
★薬物動態学 テキストダウンロード
『薬物動態学が苦手なあなたへ』のテキスト(PDF)ダウンロードができます。
薬物動態学 目次
◆連載◆薬物動態学 7限目
7限目:動態が分かれば副作用や相互作用も予測できるぞ!
透析によって除去されるかどうかだって予測可能だ。
最終回なのでプロプラノロールとアテノロールの違いを紹介!
今回の要約:
①脂溶性薬物は脳に移行しやすいため中枢性副作用が起こることがある。
②水溶性薬物は脳に移行しにくいため中枢性副作用の発現頻度は低い。
③脂溶性薬物は透析で除去されにくい。
④一般的に水溶性薬物は透析で除去されやすい。
本日が最終講義だね。ずっと「プロプラノロールとアテノロールの違い」というテーマで7日間引っ張ってきた。このタイトルだけではあまり興味がないことかもしれないが、薬物動態や物性からここまでのことが予測できるんだということを発見した時には20年前の僕にとってはほんとに衝撃的なことだったんだ。同じように初版の拙著「腎不全と薬の使い方Q&A」の序章には「アルベカシンとクラリスロマイシンの違いからADMEを知ろう」を書いた。水溶性抗菌薬(腎排泄)と脂溶性抗菌薬(肝代謝)の投与設計の違いだけでなく、クラリスロマイシンはグラム陰性菌にはそれほどの効果を示さないのに、なんで細胞内寄生菌に効果があるの?アルベカシンはMRSA治療薬なのになんで緑膿菌にも効くの?などいろんなことが分かることに気づいたんだ。今、僕は数多くあるNSAIDsやベンゾジアゼピンの尿中排泄率、蛋白結合率、分布容積、クリアランスなどの動態データがだいたい予測できるようになった。記憶力が人並外れて悪く、先生の言うことが瞬時に理解できないため小学校の成績が40人いて30番くらいだった(と思う。だって3段階評価の「良い」を小学校4年の社会科で初めてとれたくらいだったから)僕でも、理屈で考えれば記憶しなくても理解できるようになった発見だったから。もったいぶっていないで、「プロプラノロールとアテノロールの違い」の正解を発表しよう。表を見てみよう。
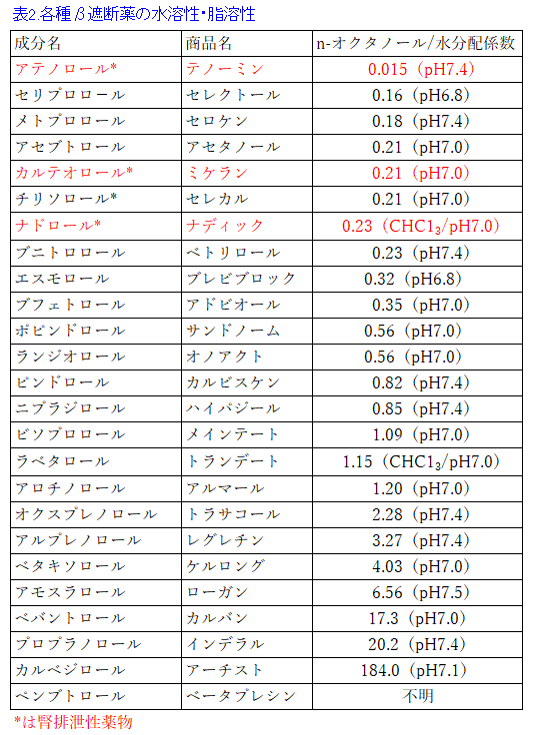
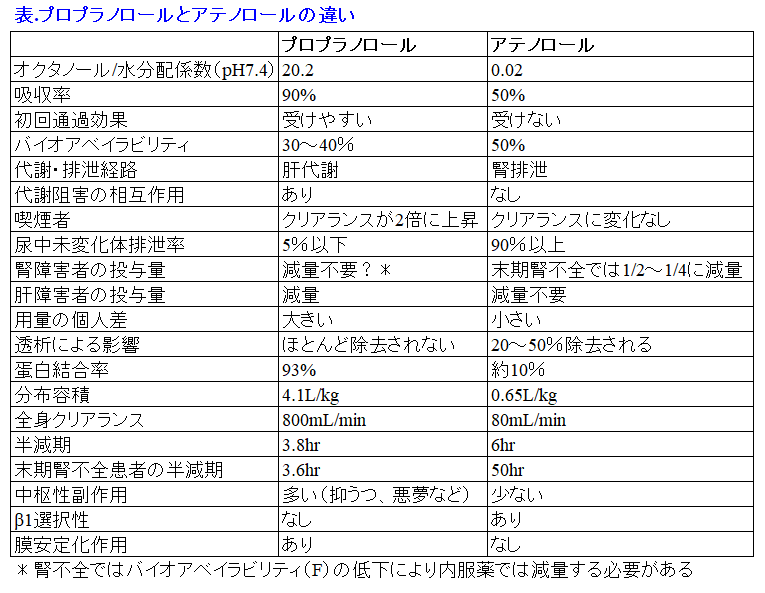 プロプラノロールは脂溶性が高いために、血液脳関門*1を通過しやすいことはよく知られている。3限目の表2に記載されているカルベジロール(アーチスト®)も脂溶性β遮断薬であり、プロプラノロール同様、脳に移行しやすい薬物である。これらの脂溶性β遮断薬では脳内濃度:血漿濃度が15:1と、脳内濃度が非常に高いため1)、悪夢や幻覚、抑うつ、錯乱などの副作用が現れることがある2)。アテノロールは水溶性が高いために血液脳関門を通過しにくく、脳内濃度:血漿濃度が0.1:1と、脳内移行性が低いため、このような副作用の発現頻度は少ないと考えられる1)。
プロプラノロールは脂溶性が高いために、血液脳関門*1を通過しやすいことはよく知られている。3限目の表2に記載されているカルベジロール(アーチスト®)も脂溶性β遮断薬であり、プロプラノロール同様、脳に移行しやすい薬物である。これらの脂溶性β遮断薬では脳内濃度:血漿濃度が15:1と、脳内濃度が非常に高いため1)、悪夢や幻覚、抑うつ、錯乱などの副作用が現れることがある2)。アテノロールは水溶性が高いために血液脳関門を通過しにくく、脳内濃度:血漿濃度が0.1:1と、脳内移行性が低いため、このような副作用の発現頻度は少ないと考えられる1)。
プロプラノロールはCYP1A2の基質なので、喫煙によって酵素誘導を受け、クリアランスが2倍になる、あるいはシメチジンによって代謝酵素阻害を受け血中濃度が上昇することも知られている。またFが5%しかない脂溶性のスタチン薬のシンバスタチンの血中濃度のAUCはグレープフルーツの併用で横紋筋融解症を発症したという報告3)、イトラコナゾールによって活性体のシンバスタチン酸濃度は19倍になることが報告されている4)。シンバスタチンは100%CYP3A4によってのみ代謝されること、イトラコナゾールはほぼ100%、CYP3A4を阻害することを知っておけばFが5%であるシンバスタチンが100%になればほぼ20倍になるであろうことは容易に予測できる。
プロプラノロールの分子量は296daltonと小さいが、透析ではほとんど除去されない薬物である。従来、教科書的に書かれてきた「分子量500dalton以上になると透析で除去されない」というのは間違いで、実は分子量は数千dalton以上にならない限り、透析で抜けにくいと断定することはできない(図)5)。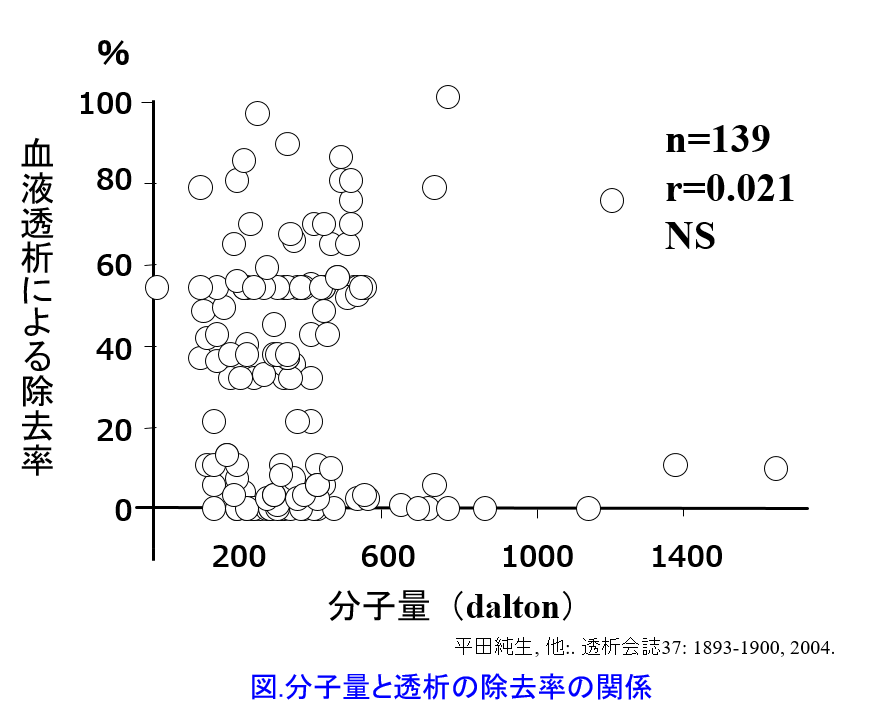 蛋白結合率が高い、分布容積が大きい、脂溶性が高いというパラメータの方が透析性が低いことを予測する上で、分子量よりも重要な要因になる。プロプラノロールは蛋白結合率が93%と高く、分布容積が4.1L/kgと大きく、オクタノール水分配係数も20.2と高い脂溶性薬物であるため、これらの3つの要因をすべて満たしているから、透析ではほとんど除去されない。蛋白結合率や分布容積を考える以前に、プロプラノロールの全身クリアランス800mL/minに透析によるクリアランスのわずか数十mL/minが加わったところで、プロプラノロールのクリアランスには大した影響がないと考えられる。一方、アテノロールは蛋白結合率が低く水溶性薬物であるため、分布容積も0.65L/kgとほぼ生体の水分量と等しく、分子量も小さいため、透析でよく除去される。そのため、透析後に服用することが望ましい薬剤といえる。
蛋白結合率が高い、分布容積が大きい、脂溶性が高いというパラメータの方が透析性が低いことを予測する上で、分子量よりも重要な要因になる。プロプラノロールは蛋白結合率が93%と高く、分布容積が4.1L/kgと大きく、オクタノール水分配係数も20.2と高い脂溶性薬物であるため、これらの3つの要因をすべて満たしているから、透析ではほとんど除去されない。蛋白結合率や分布容積を考える以前に、プロプラノロールの全身クリアランス800mL/minに透析によるクリアランスのわずか数十mL/minが加わったところで、プロプラノロールのクリアランスには大した影響がないと考えられる。一方、アテノロールは蛋白結合率が低く水溶性薬物であるため、分布容積も0.65L/kgとほぼ生体の水分量と等しく、分子量も小さいため、透析でよく除去される。そのため、透析後に服用することが望ましい薬剤といえる。
*1血液脳関門:脳の血管内皮細胞では細胞同士が密着結合tight junctionという密着性の高い結合様式で連結して物理的関門を形成している。したがって物質は経細胞的に血中から組織に移行する必要があるため脂溶性薬物のみが透過できる。血液胎盤関門、血液精巣関門も同様に密着結合しており、水溶性物質の透過性を制限している。
引用文献
1)Cruickshank J. M., et al.: Beta-adrenoreceptor-brocking agents and the blood-brain barrier. Clin Sci 59: 453s-455s, 1980.
2)Fleminger R.: Hallucinations and illusions with propranolol. Brit Med J 6: 1182, 1978.
3) Dreier JP, Endres M: Statin-associated Rhabdomyolysis Triggered by Grapefruit Consumption. Neurology 62: 670, 2004
4) Neuvonen PJ, et al: Simvastatin but Not Pravastatin Is Very Susceptible to Interaction With the CYP3A4 Inhibitor Itraconazole. Clin Pharmacol Ther 63: 332-341, 1998
5)平田純生, 和泉 智, 古久保 拓, 編: 改訂2版 透析患者への投薬ガイドブック. じほう, 東京, P1-666, 2009
≪ 理解度テスト ≫
1.シンバスタチンの添付文書には抗真菌薬の「イトラコナゾール」は併用禁忌になっている。では同じ抗真菌薬で併用禁忌になっていないボリコナゾールに変更していただくという疑義紹介はありだろうか?
2.「グレープフルーツを食べちゃダメ、グレープフルーツジュースを飲んじゃダメ」と医薬品情報提供用紙に書いてあるが、口頭でも説明しなくちゃいけない薬にはどんなものがある?
≪ 解 答 ≫
1.シンバスタチンはCYP3A4の基質特異性が極めて高く100%、CYP3A4で代謝される。イトラコナゾールは100%近く、CYP3A4を阻害する。ボリコナゾールは限りなく100%に近いCYP3A4阻害作用を有する。つまりイトラコナゾールよりも阻害作用は強力!5%のFが100%、つまり理論的には相互作用によって20倍の血中濃度になると予測される。添付文書上では禁忌になっていなくても「禁忌レベル」と考えよう。HIV治療薬のサキナビルも併用禁忌になっているが、併用禁忌になっていないクラリスロマイシンはサキナビルよりもCYP3A4阻害作用作用は強い。これも「禁忌レベル」と考えよう。
2.シンバスタチン(Fが5%)、アトルバスタチン(Fが15%)、フェロジピン(Fが15%)などFの小さいCYP3A4基質薬物。他のスタチンはCYP3A4基質にはならないし、フェロジピン以外のCa拮抗薬のFは高いので(Fが4~7%のニソルジピンは製造中止になった)、相互作用のインパクトは小さい。土佐分担、平戸分担、ボンタン、晩白柚(バンペイユ:写真左) などの柑橘類もCYP3A4阻害作用はグレープフルーツと同等という報告もあるので、これも注意しておこう。ちなみにグレープフルーツの中でも果肉が白に近い薄い黄色をした品種「マーシュ」の相互作用が強く、ルビーの阻害作用は半分程度しかない。オレンジやミカンは大丈夫。
などの柑橘類もCYP3A4阻害作用はグレープフルーツと同等という報告もあるので、これも注意しておこう。ちなみにグレープフルーツの中でも果肉が白に近い薄い黄色をした品種「マーシュ」の相互作用が強く、ルビーの阻害作用は半分程度しかない。オレンジやミカンは大丈夫。
最後にひとこと(余計なお世話かもしれませんが・・・)
ひたすらひとつの事に集中している人にはかなわない。それを医療の中に見つけ出せれば幸せだと思う。だって医療ってそれはそれはありがたい仕事だから。
処方箋を書く医師は薬物動態や相互作用について専門的に習っていないのだから、薬剤師は患者さんの有効かつ安全な薬物療法を提供するために働くことのできる医療人、そして医師に薬物適正使用に関して適切なアドバイスできる医療人、専門性を極めるとさらに一層重宝される可能性を秘めた医療人になれると思います。でも根本にかえって考えてみると、このようなスキル以外にもっと本当に大切なものがあるんじゃないかと思うようになってきました。僕も年を取って、少しは円熟してきたのかもしれませんが・・・・。薬剤師は医療人です。医療人に共通して必要なものは「やさしさと愛」じゃないかと。僕は薬剤師の魅力について、いつも熊本大学の学生たちにこう訴えてきました。「ボランティアのような仕事をして、患者さんの不安を取り除き、正しい薬の知識をもらえることで感謝され、他の医療スタッフからも感謝され信頼されて、しかも給料をいただける。それはそれはありがたい仕事じゃないですか。」と。でも信頼されるようになるにはそれなりの力も必要です。患者さんを助けたいという気持ち、患者さんのためにという気持ち、その熱意と優しさが、薬剤師としての力をつけたいというモチベーションアップに繋がるのではないかと思うようになった今日この頃です。
◆連載◆薬物動態学 6限目
6限目:クリアランス、半減期を理解できれば投与量・投与間隔の設定ができる!
今回の要約:
①水溶性薬物は腎不全患者で減量が必要である。
②腎機能は加齢とともに低下する。
③脂溶性薬物は肝不全患者では減量・投与間隔の延長が必要であろうが、減量指標となる検査値はないので、血中濃度を測定しないと投与設計できない?
腎の糸球体濾過量GFR*1は70〜130mL/minが正常値で、アテノロールの全身クリアランス(肝での代謝は無視できるためほぼ腎クリアランス=全身クリアランスと考えて良い)が80mL/minということは、アテノロールでは腎臓の糸球体を血液が1回通過しただけで、8割近くが排泄されることを意味する。水溶性が高いアテノロールは尿細管で再吸収されることもない。全身クリアランスと腎クリアランスがほぼ等しいため、腎障害者ではアテノロールのクリアランスは低下し、t1/2が延長するため、投与量を減量するか、投与間隔を延長することが必要になる。n-オクタノール/水分配係数ではセリプロロールやメトプロロールよりも大きいものの、尿細管分泌されやすいため尿中排泄率の高いカルテオロール(ミケラン®)やナドロール(ナディック®)もアテノロールと同様に、腎不全患者では同様に減量の必要がある。
一方、肝臓の血流量は1,100〜1,800mL/min(この70〜75%は門脈血で、25〜30%が肝動脈血)で、プロプラノロールの全身クリアランス*2は800mL/minである。プロプラノロールの腎からの排泄はほとんど無視できるため、プロプラノロールの全身クリアランス=肝クリアランスと考えてよい。だから、血液が肝臓を通るごとに血中のプロプラノロール濃度は低下する。重度の肝障害や肝硬変では半減期(t1/2)*3が延長するため与間隔の延長が必要になる。肝血流律速型薬物*4であるプロプラノロールのCmaxやAUCは著明に上昇するため、投与量の減量が必要になる。腎不全患者ではプロプラノロールの投与量を減量する必要はないと思われるが、腎不全患者では初回通過効果による肝代謝が低下するため、バイオアベイラビリティ(F)が上昇するという報告1)もある。近年の報告では小腸の吸収速度が低下するという説も提示されている2)が、腎不全でなぜこのような変化が起こるのかについては明らかにされていない。透析患者にプロプラノロールの内服薬を投与する時には多少の減量は必要かもしれないが、初回通過効果を受けない注射薬では減量の必要はない。
とこのように述べたが、ではどうやって減量するかについては腎排泄型薬物はGFRまたはクレアチニンクリアランス(CCr)に応じた投与設計が可能である。実測するGFRやCCrを実測するのは蓄尿が必要で手間暇もかかるため、通常は血清クレアチニン値*5を測定し、その値によって推算GFR(eGFR)または推算CCrを腎機能として投与設計をしている。しかし肝代謝型薬物にはこのような肝の代謝機能を表す適切な検査値がない。ASTやALTは肝細胞障害を表す検査値であるし、γ-GTP、血清ビリルビンなども代謝機能とは相関しない。腎機能は慢性糸球体腎炎や糖尿病性腎症、高血圧などによって徐々に低下するとともに、このような原疾患のない人でも加齢とともに低下する。つまり高齢者は慢性腎臓病(CKD)であると、疑ってみるべきだ。これに対し、お酒に強い人は高齢者になっても、若いころから全く飲めない人よりもエタノールを代謝する能力が強い。肝機能も加齢によって低下するが、代謝機能は今まで述べてきたように遺伝的な個人差の方が大きい。だったら全員遺伝子を調べてから薬物を投与すれば投与設計はよりやりやすくなるだろうと思いますよね。だけどワルファリンの主な代謝酵素はCYP2C9で、薬効の指標となるビタミン K エポキシド還元酵素複合体 1(VKORC1: vitamin K epoxide reductase complex 1)の遺伝子が分かれば薬物動態PKも薬物動力学PDもわかっているので完璧になったかというと、そうではない。いまだに凝固しやすさの指標であるPT-INRを測定せざるを得ない3)。だから肝代謝型の薬物の投与設計は難しい!テーラーメイド医療は確かにより有効かつ安全な投与設計に貢献するだろうが、筆者はTDMが不要になる時代はまだまだやってこないように思う。
プロプラノロールの全身クリアランス(ほぼ肝クリアランス)は800mL/min、アテノロールの全身クリアランス(ほぼ腎クリアランス)は80mL/minで、両者の間には10倍の開きがあるため、プロプラノロールの消失は10倍速いと思われがちだが、t1/2はプロプラノロールで3.8時間、アテノロールで6時間で2倍足らずである。これはプロプラノロールの分布容積が約4L/kgと大きいため、血中濃度は低く、肝ではその低濃度の血液を毎分1000mL以上取り込んで、そのうち800mL分の血液中のプロプラノロールを完全に代謝して血中から消失させていることを意味している。
またアテノロールの場合、分布容積が比較的小さいため、血中濃度は高く、腎の糸球体ではやや高濃度の血漿を毎分、100〜120mL糸球体で濾過して、そのうち80mL分の血液中のアテノロールを完全に排泄して消失させていることになる。このことは血中消失半減期とクリアランスの関係から理解できる。つまりt1/2=ln2/Kel=0.693×Vd/CLで表されるため、薬物の分布容積(Vd)が大きくなれば半減期は延長し、クリアランス(CL)が大きくなれば半減期は短縮する。GFRの正常値はほぼ100mL/minであるため、一度腎を通過しただけで完全に消失する薬物のクリアランスは100mL/minとなり、尿細管からの薬物の分泌がない限り、腎のみで消失する薬物のクリアランスが100mL/minを越えることはあり得ないが、尿細管分泌される薬物は結構ある。
例えばβラクタム系抗菌薬はほぼ腎排泄と考えれば、CL=(ln2×10L)/1hr=115mL/min>GFRとなるので、半減期1hr未満のものは糸球体濾過だけでなく尿細管分泌されていると考えられる。βラクタム系抗菌薬であればVdはそんなに違わない。セフトリアキソンの蛋白結合率が90%と高いため、アルブミンにトラップされ間質液に移行しにくいので、血中濃度が比較的高くなるため0.2L/kg以下になるのが例外的なものだろうが大きな差ではない。しかしセフトリアキソンは半減期が7~9hrと非常に長いため、外来で投与できる唯一のβラクタムといってもよいだろう。Vdが少し小さいだけなのに半減期がうんと長くなるのはなぜなんだろう?これはセフトリアキソンの水溶性が高いためもともと腎排泄だけど、たまたま蛋白結合率が90%と高いため、糸球体濾過されるクリアランスが非常に小さいためと考えられる。
でも尿細管分泌されるβラクタムの半減期はとても短い。古い薬だけど感染性心内膜炎や梅毒に今でも有効なベンジルペニシリン(ペニシリンG)の半減期は30分。時間依存性だから1日6回点滴することもある。クリアランスは1,024mL/minと肝血流依存性薬物と疑いたくなるが、おそらく尿細管分泌のクリアランスが高いのだろう。そしてペニシリン系、カルバペネム系の多くの半減期が1hr前後と短いので、糸球体濾過されるだけではなく尿細管から分泌されることによって腎クリアランスが100mL/minを超えているためと考えられる。
最後にβ遮断薬の怖いところは気管支収縮による喘息症状の悪化だけでなく、低血糖を起こしやすいことも挙げられる。β遮断薬を併用していて、投与量を間違えると非常に怖い薬にはシベンゾリンというⅠa群の抗不整脈薬がある。シベンゾリンによる低血糖はSU薬のように膵臓β細胞を刺激してインスリン分泌を促し、その作用は血中濃度依存性であるため400ng/mL以下では低血糖は起こらないが、シベンゾリンの有効治療域(200〜800ng/mL)と非常に近いので怖い。しかもβ遮断薬と同じくCYP2D6の基質でもある。さらにシベンゾリンの難儀なところは、腎排泄性であるにもかかわらず、分布容積が6.8L/kgと大きい(組織移行性が高い)ため、いかなる血液浄化法でも全く除去できないこと。筆者は血液透析では2L/kg以上の分布容積の薬物は除去不可能という論文を書いている。シベンゾリンによる低血糖やQT延長が高齢者で起こりやすいので高齢者で心停止症例が2名起こったため、メーカーから「適正使用のお願い」が出た。その中には①腎障害の程度により投与量を減じること、②高齢者では、少量(たとえば1日150mg )から開始すること、③本剤の投与中は臨床検査を定期的に行い必要に応じて適宜血中濃度を測定すること と書かれていたのはなぜだろう?もちろん、前述のように未変化体尿中排泄率55~62%の腎排泄性薬物であることやVdが大きいため血液浄化によって救命できないこと、高齢者は腎機能が低下すること、以外にもこの薬が「非線形の薬物動態」をとることも一因として考えられるのではないかと思う。ここで、非線形薬物動態を示す薬物を紹介する(表)。 フェニトインが非常に有名だが(図1)、現在は散剤としては10%散しかないが、20年くらい前には原末が販売さされており、誤調剤によって死亡例が出たため、原末が製造中止になった経緯がある。テオフィリンにシメチジンが併用されても皆さんが疑義紹介しないと思うが、併用することによって死亡した症例が報告されている4)。これは論文中には考察されていないが、医師がテオフィリンの嘔気をテオフィリンの中毒症状ではなく胃障害の悪化と思ってシメチジンの増量を行ったためにテオフィリンが非線形の血中濃度の上昇を示して死に至ったと筆者は解釈している。薬剤師ならこれらの非線形薬物動態を示す薬物はすべて記憶してほしい。ここでは話がややこしくなるのでミカエリス-メンテン式の話はやめておこう。Km と Dmax を決定するには異なる2つの投与量における定常状態での血中濃度が必要だが、実臨床ではこのようにして投与設計をすることはまずないからだ。
フェニトインが非常に有名だが(図1)、現在は散剤としては10%散しかないが、20年くらい前には原末が販売さされており、誤調剤によって死亡例が出たため、原末が製造中止になった経緯がある。テオフィリンにシメチジンが併用されても皆さんが疑義紹介しないと思うが、併用することによって死亡した症例が報告されている4)。これは論文中には考察されていないが、医師がテオフィリンの嘔気をテオフィリンの中毒症状ではなく胃障害の悪化と思ってシメチジンの増量を行ったためにテオフィリンが非線形の血中濃度の上昇を示して死に至ったと筆者は解釈している。薬剤師ならこれらの非線形薬物動態を示す薬物はすべて記憶してほしい。ここでは話がややこしくなるのでミカエリス-メンテン式の話はやめておこう。Km と Dmax を決定するには異なる2つの投与量における定常状態での血中濃度が必要だが、実臨床ではこのようにして投与設計をすることはまずないからだ。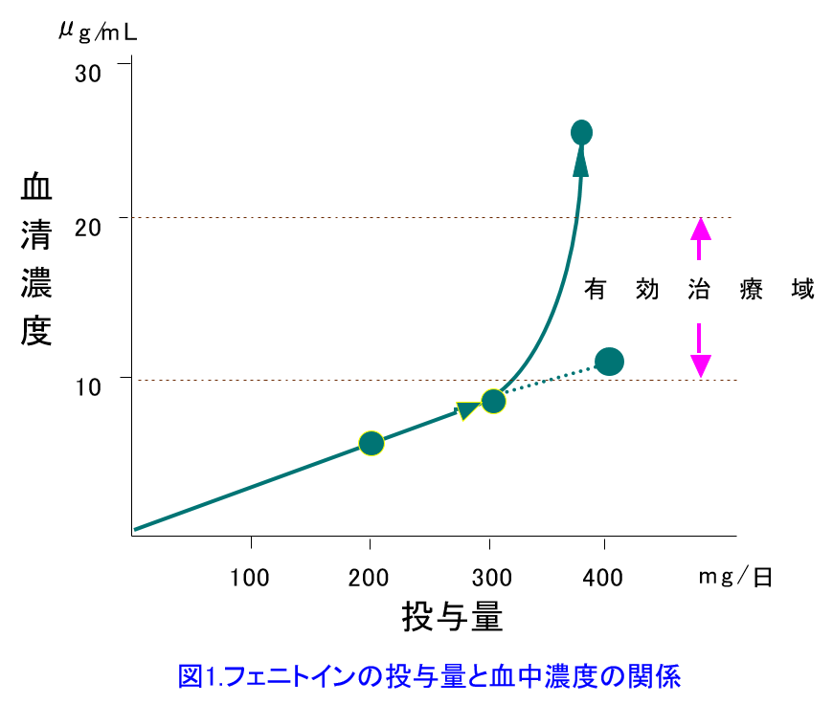
*1)糸球体濾過量(GFR: glomerular filtration rate):糸球体から単位時間に、どれだけの濾液が濾過されるかを表すもの。糸球体で完全に濾過されて、尿細管では再吸収もされない生体内物質のクレアチニンを用いた推算GFR(eGFR)、あるいはクレアチニンクリアランスが腎機能の検査として一般的にGFRの代用として用いられる。
*2)クリアランス(CL):薬物の除去能力を示すパラメータ。単位時間あたりの体内から薬物が減少していく速度の薬物血中濃度に対する割合。一般にクリアランスは肝クリアランス(肝での薬物の代謝)と腎クリアランス(腎からの薬物の排泄)を加算したものと考えてよい。薬物のクリアランスが腎からの排泄によるものが主である場合(ファモチジンやアシクロビル、イミペネムなど)には、腎不全患者では蓄積しやすいため思わぬ副作用が現れることがある。
*3)半減期(t1/2):正確には血中消失半減期と言い、通常は消失相における半減期t1/2βを表す。ある薬物の濃度が1/2に減少するまでに要する時間。つまり体内から薬物が排泄される速度の目安となり、半減期が長いと薬効が延長し、中毒性副作用が生じた時には副作用も長く続くことを意味する。本来なら尿中へ排泄される薬物は、腎不全では体内に蓄積し、薬物の半減期が延長する。そのため腎機能低下患者を扱う施設(高齢者は腎機能が低下するためほぼすべての施設)では有用な薬物動態パラメータとなる。経口投与した薬物は指数関数的に体内から排泄されるためt1/2の4倍の時間をかければ投与された薬物の約94%は排泄されてしまう(図2)。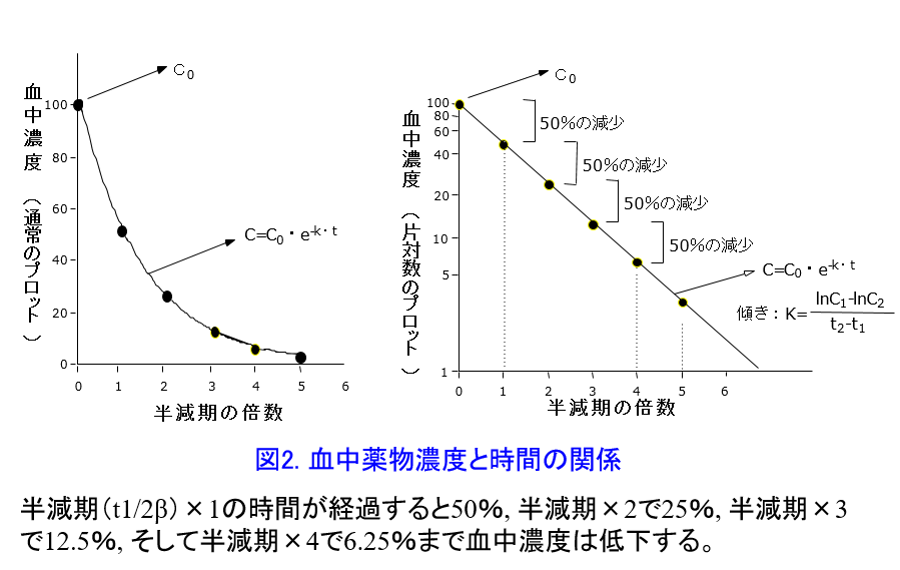 また、t1/2βは反復投与時の定常状態濃度に到達する時間を知ることもできる(図3)。 一方、t1/2αは分布相における半減期であり、t1/2βに比べ安定したデータが得られるとは限らないし実臨床で使われることはまずない
また、t1/2βは反復投与時の定常状態濃度に到達する時間を知ることもできる(図3)。 一方、t1/2αは分布相における半減期であり、t1/2βに比べ安定したデータが得られるとは限らないし実臨床で使われることはまずない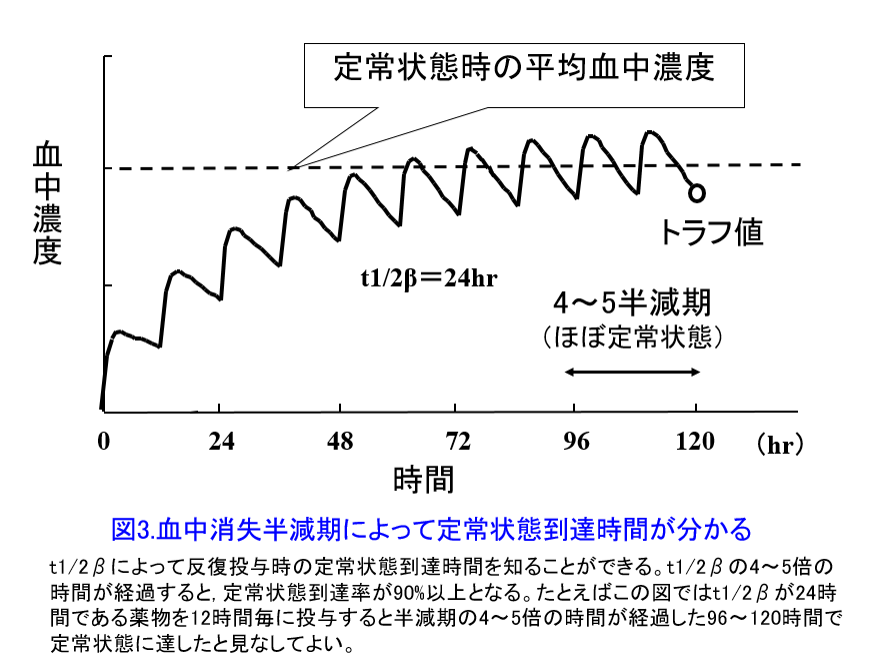
*4)肝血流律速型薬物:薬物の血漿クリアランスが肝血流量に近い薬物のことで、肝障害時には肝実質細胞量が減少し、門脈圧亢進によって肝外シャント(これにより食道静脈瘤などが発現する)が形成され、消化管から肝に至る門脈血が肝臓を経ずに体循環に入る。肝血流律速型薬物では経口投与後の肝初回通過効果が著明に低下するため、経口投与後のCmaxが著明上昇し、健常者の数倍に上昇することも珍しくない。肝血流律速薬物の特徴は肝初回通過効果を受けやすいので、バイオアベイラビリティが低く、肝障害ではCmaxとAUCは著明に増加するが半減期はあまり変化しない。肝血流律速薬物には脂溶性β遮断薬の他にCa拮抗薬、ニトログリセリン、プラゾシン、ジルチアゼム、モルヒネ、ペンタゾシン、アスピリン、アセトアミノフェン、スピロノラクトン、三環系抗うつ薬、リドカインなどがある。
*5)血清クレアチニン値:クレアチニンは全く蛋白結合せず、糸球体で100%濾過され、尿細管で再吸収されないまま尿中に排泄されるため、優れた腎機能マーカーになるがわずかに尿細管分泌される。濾過されたクレアチニン量=尿中に排泄されたクレアチニン量になるため 血漿Cr濃度×GFR =尿中Cr濃度×尿量/日で表される。CCrは時間あたりに濾過される原尿の産生速度(限外濾過された濾液量)に尿細管分泌される20~30%を加えた値になるため、腎機能正常者のCCrはCCr = GFR+20~30mL/min=120~130mL/minになる。血清クレアチニンは生体内の筋肉のクレアチンの最終代謝産物であるため、筋肉量の少ない高齢者ではeGFRは過大評価されやすいことも覚えておこう。
引用文献
1)Bonde J., et al.: Atenolol inhibits the elimination of disopyramide., Eur J Clin Pharmacol 28: 41-43, 1985
2)Bianchetti G, et al: Pharmacokinetics and effects of propranorol in terminal uraemic patients and in patients undergoing regular dialysis treatment. Clin Pharmacokinet 1: 373-384, 1976.
3)Pirmohamed M, et al.; EU-PACT Group. A randomized trial of genotype-guided dosing of warfarin. N Engl J Med 369: 2294-2303, 2013
4)Anderson JR, Poklis A, Slavin RG: A fatal case of theophylline intoxication. Arch Intern Med, 143: 559-560, 1983
「今日はここまで、それではまた次回お楽しみに!」
◆連載◆薬物動態学 5限目
5限目:代謝による消失と
排泄による消失(代謝および排泄経路)を知ろう!
今回の要約:
①脂溶性薬物は肝で代謝されることにより血中から消失する。
②水溶性薬物は腎から排泄されることにより血中から消失する。
脂溶性の高いプロプラノロールはそのままでは腎から排泄できない。糸球体で濾過されても脂溶性が高いために尿細管で受動拡散によって再吸収されてしまうため排泄されないからだ(図1)。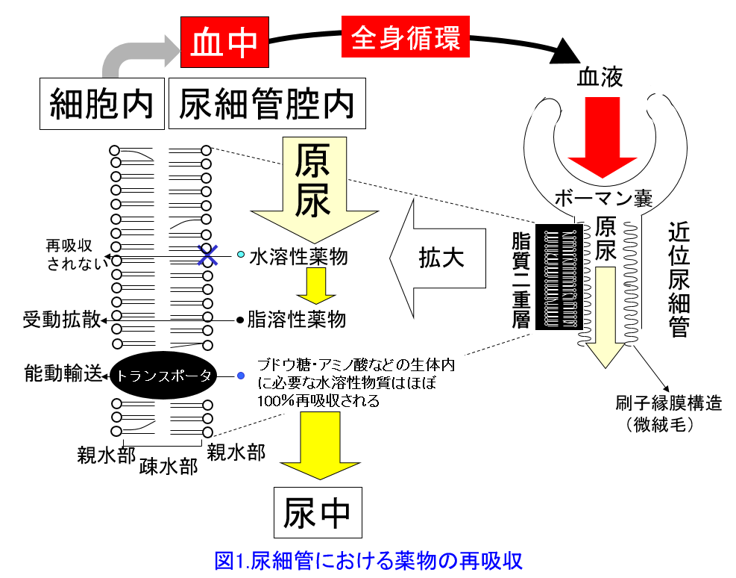 そのため肝による代謝(≒極性化反応)によって親水性を増した代謝物・抱合体となってはじめて腎から排泄される(図2)。肝で別の物質に変わること(=代謝)がこの薬における「消失」である。よく薬物を肝排泄型・腎排泄型という分け方をする専門化がいるが、これは正しくない。正確には肝代謝型薬物・腎排泄型薬物と分類すべきである。肝代謝によって親化合物が代謝物となって活性を失った時点で、実際には代謝物として体内に残っていても「消失した」と考えるのである。代謝物に活性があれば、腎機能低下患者では活性代謝物*1を排泄できにくいため蓄積して血中濃度が上昇しやすい。腎機能が低下した患者で、通常では起こりにくい副作用が現れたら、活性代謝物の蓄積を疑ってもよいかもしれない。
そのため肝による代謝(≒極性化反応)によって親水性を増した代謝物・抱合体となってはじめて腎から排泄される(図2)。肝で別の物質に変わること(=代謝)がこの薬における「消失」である。よく薬物を肝排泄型・腎排泄型という分け方をする専門化がいるが、これは正しくない。正確には肝代謝型薬物・腎排泄型薬物と分類すべきである。肝代謝によって親化合物が代謝物となって活性を失った時点で、実際には代謝物として体内に残っていても「消失した」と考えるのである。代謝物に活性があれば、腎機能低下患者では活性代謝物*1を排泄できにくいため蓄積して血中濃度が上昇しやすい。腎機能が低下した患者で、通常では起こりにくい副作用が現れたら、活性代謝物の蓄積を疑ってもよいかもしれない。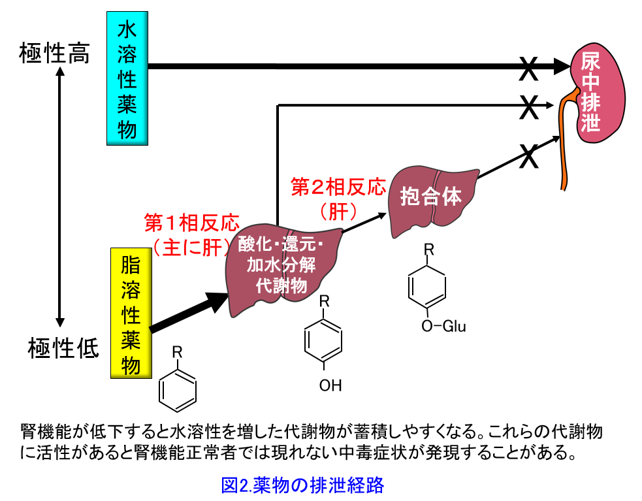
図2には90%がCYPによる第1相反応によって水酸基が付き、第2相反応でグルクロン酸抱合を受けるという典型的なパターンを示したが、抱合体はほぼイオン化しているくらい極性が高い、つまり水に溶けやすくなっているため、腎で糸球体濾過されると尿細管で再吸収されない。何度も言うようだが代謝物は親化合物よりも親水性が高いと理解しよう。つまり生体にとって薬物は異物であるので、できるだけ速やかに排泄しようとするため、脂溶性の高い薬物を肝でより水溶性の高い代謝物に変化させている、つまり肝と腎はお互いが協力して薬物を体内から消失させているのだと考えれば理解しやすいであろう。
プロプラノロールは肝で代謝を受けやすく、ほとんどが肝代謝によって消失する。したがって尿中未変化体排泄率は低く、血漿濃度の変化は主として肝での代謝能力によって左右される。かたやアテノロールは肝で代謝を受けなくても水溶性が高いために腎から容易に排泄される。アテノロールは腎から尿中に排泄されること(=排泄)がこの薬における「消失」である。
酵素誘導と代謝阻害
Point!: 脂溶性薬物では代謝阻害、酵素誘導などの代謝に関係した相互作用が起こることがある。水溶性薬物は代謝を受けにくいため、代謝に関係した相互作用は起こりにくい。
プロプラノロールは肝でCYP1A2およびCYP2D6により代謝される。このうち1A2はテオフィリンを代謝する酵素として有名である。タバコを吸うと血中テオフィリン濃度が低下するのはタバコによってCYP1A2が誘導*2されるためだが、プロプラノロールもタバコによりクリアランスが上昇し、血中濃度が低下する1)。このようにプロプラノロールは肝で代謝されるため、酵素誘導や代謝阻害を受けることがあるが、アテノロールはほとんど肝での代謝を無視できるため、このような相互作用はほとんど考えられない。
CYP2D6の酵素欠損者、つまりpoor metabolizerではプロプラノロールの常用量投与でも血漿濃度が上がりすぎ、徐脈などのβ遮断効果が過剰に発現することがある。添付文書にはアテノロールの併用により、ジソピラミドの血中濃度が上昇するという記載2)があるが、これはおそらく、アテノロールにより心拍出量が低下し、それに伴い肝および腎血流が低下したため、ジソピラミドのクリアランスが低下したもの、つまり薬物動力学的相互作用によるもので、代謝阻害によるものではないと思われる。その影響も無視できるほど軽度である。
*1)活性代謝物:活性のない代謝物がいくら蓄積しても中毒性の副作用が起こるわけではない。ただし例外的にモルヒネやミダゾラムのように活性のある抱合体が蓄積し、それが胆汁排泄され、腸管内で脱抱合を受けて再び吸収される(腸肝循環する)ために親化合物濃度が上昇するものもある。ただし単に活性のない代謝物が蓄積しても副作用は起こらない。添付文書に書かれている「尿中排泄率」は活性体だけでなく活性をもたない代謝物の尿中排泄率を含んだ「尿中回収率」であることがあるが、これは腎機能低下患者の投与設計には全く役に立たない。腎機能低下の投与設計に必要なのは活性をもった親化合物あるいは活性代謝物の尿中排泄率であり、これらが高いと腎不全患者では蓄積して中毒作用が現れやすい。活性他誌や物を持つ主な薬物を表に示すがこれらはほんの1例に過ぎない。 *2)酵素誘導:物質Aが薬物Bの代謝酵素産生を誘導し代謝酵素量が増えること。酵素誘導が生じると薬物Bの代謝速度が増大し、薬物の血中濃度が下がる。つまり薬物の効きが悪くなる。たとえばAにあたるリファンピシンは多くの薬物に対して酵素誘導を生じさせ、さらにP糖タンパク質などの排泄トランスポータをも誘導するため、併用するとニフェジピンなどのCa拮抗薬、トリアゾラムなどのベンゾジアゼピン系薬物、ボリコナゾール、タダラフィル、サキナビル、アメナメビル、ワルファリン、テオフィリン、ジゴキシンなど非常に多くの薬物の血中濃度を下げることが知られている。抗うつ作用を持つサプリメントのセントジョンズワート(西洋オトギリソウ)も主にCYP3A4酵素誘導作用を持つが、これによりシクロスポリンの血中
*2)酵素誘導:物質Aが薬物Bの代謝酵素産生を誘導し代謝酵素量が増えること。酵素誘導が生じると薬物Bの代謝速度が増大し、薬物の血中濃度が下がる。つまり薬物の効きが悪くなる。たとえばAにあたるリファンピシンは多くの薬物に対して酵素誘導を生じさせ、さらにP糖タンパク質などの排泄トランスポータをも誘導するため、併用するとニフェジピンなどのCa拮抗薬、トリアゾラムなどのベンゾジアゼピン系薬物、ボリコナゾール、タダラフィル、サキナビル、アメナメビル、ワルファリン、テオフィリン、ジゴキシンなど非常に多くの薬物の血中濃度を下げることが知られている。抗うつ作用を持つサプリメントのセントジョンズワート(西洋オトギリソウ)も主にCYP3A4酵素誘導作用を持つが、これによりシクロスポリンの血中
濃度が低下し、心移植臓器の拒絶反応を起こした症例が報告されている3)。コンビニでも入手可能なので、誰もが入手できるので気を付けたい。CYP2D6は酵素誘導を受けない分子種である。
引用文献
1)Walle T, et al.: Selective induction of propranolol metabolism by smoking: Additional effects of renal clearance of metabolites. J Pharmacol Experimental Ther 241: 926-933, 1987.
2)Bonde J, et al.: Atenolol inhibits the elimination of disopyramide. Eur J Clin Pharmacol 28: 41-43, 1985
3)Rushitzka F, et al: Acute Heart Transplant Rejection Due to Saint John’s Wort. Lancet 355:548-549, 2000
「今日はここまで、それではまた次回お楽しみに!」
◆連載◆薬物動態学 4限目
4限目:分布に関わる分布容積・蛋白結合率を理解しよう。
血中濃度がどれくらい上がるかが理解できるぞ!
今回の要約:
①脂溶性薬物は組織に移行しやすいため概して分布容積が大きい。
②ただし蛋白と結合しやすい薬物は血中にとどまるため、脂溶性薬物でも分布容積が小さくなることもある。
③水溶性薬物は細胞外液に存在しやすく組織に移行しにくいため分布容積が小さい。
④分布容積が分かると初回投与時の血中濃度が予測でき、2回目以降の血中濃度の上がり幅が分かる。そして
⑤クリアランスに比べてVdの個人差は小さいため、投与設計に利用しやすい。
薬物の分布のことを考えてみよう。脂溶性の高い薬物は組織に移行しやすい(このことを分布容積Vd*1が大きいと言う)ため、同じ量を投与すると水溶性薬物よりも血中濃度は低くなる。組織に分布した薬物は組織内の蛋白質や拡散などと結合する。組織への移行性が高い、移行した組織が大きい、あるいは移行した組織内濃度が非常に高いと分布容積が大きくなる。脂溶性が高いため移行した脂肪組織のシアル酸などとの親和性が強いので脂肪組織内濃度は血中濃度の数十倍以上の高濃度になる薬物もあり、これらの分布容積はかなり大きくなる。
逆にβラクタム系やアミノグリコシド系抗菌薬は水溶性なので、脂質二重層を通過できない。ってことは細胞内に入ることができないので細胞外液のみに分布する。細胞外液量は体重の20%なので、0.2L/kgだ。50kgに人であれば10Lの分布容積なので、50kgの人のアルベカシン濃度のピーク濃度を20μg/mLにしようと思ったら、200mgの初回投与量にすればいい。20μg/mL=Xmg/10Lから簡単に計算できるよね。インタビューフォームでは健常男子をボランティアにしているのでこれで問題ない。でも臨床現場で静注抗菌薬を使うのは重症感染症患者で炎症を起こしているので、毛細血管壁のアルブミンの透過性が亢進しているため、血管内に水をとどめる作用(膠質浸透圧)が低下し軽い浮腫状態になっていると考え、分布容積は0.3L/kg近くまで上昇していることがあるので気を付けよう。
例外もある。脂溶性薬物の特徴として蛋白結合率が高い。抗凝固薬のワルファリンは肝代謝型薬物だがアルブミンとの親和性が高い。蛋白結合率が99%以上あるため、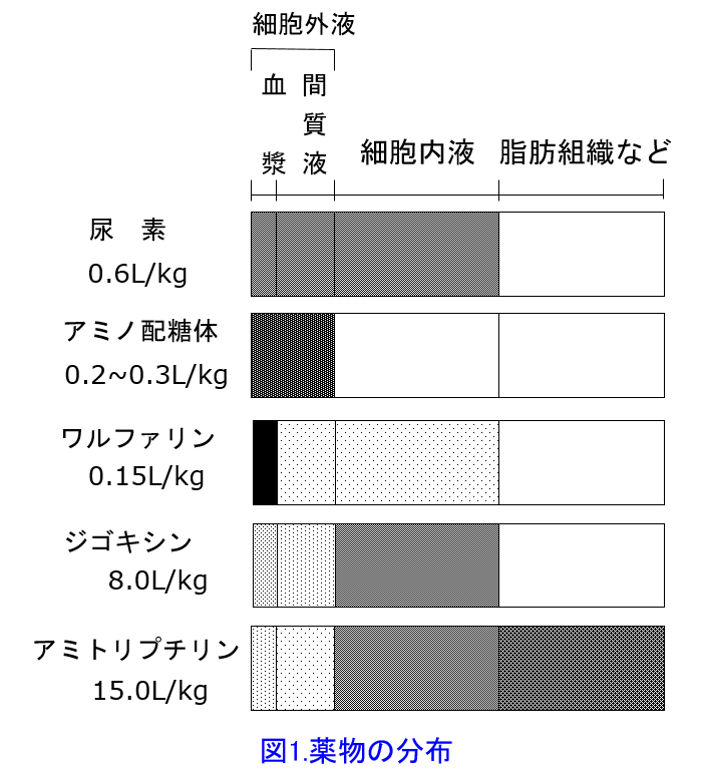 血中のアルブミンにトラップされて、組織に移行できないのだ。だからVdは細胞外液量よりも小さい0.15L/kgしかない。
血中のアルブミンにトラップされて、組織に移行できないのだ。だからVdは細胞外液量よりも小さい0.15L/kgしかない。
本題に戻そう。分布容積の話だったよね。脂溶性の高いプロプラノロールは組織移行性が高いため、分布容積は4L/kgと大きくなり、血漿濃度はその分、低くなる。一方、アテノロールは水溶性薬物であるため、プロプラノロールほど、組織移行性は高くなく、分布容積はほぼ体内水分量と同じ0.6~0.7L/kgになるので図1の尿素に近い。
ここで、分布容積を理解するための演習をやってみよう!
解答:分布容積=体内薬物量/血中濃度であるから、点滴時間が短いので、初回投与量=目標とする血中濃度×分布容積で近似できる。
投与量Dmg=0.45L/kg×50kg×10μg/mL
=22.5L×10μg/mL
=225mg
これはテオフィリン量である。実際に用いるアミノフィリンのテオフィリン含有量は80%(20%が溶解性を高めるためにエチレンジアミンが入っている)であるため、アミノフィリンに換算した実際の投与量は225/0.8=281mgとなる。アミノフィリンの静注製剤は250mgなので、1アンプル投与より少し多めに投与すればよいが、2アンプル投与すればテオフィリンは非線形の薬物動態(6限目で詳述)を示すので危険と考えると1.5アンプル投与すれば安全で確実な気管支拡張作用が期待できる。
解答:体重50kgの腎不全患者のVdは約250Lになるため、血清ジゴキシン濃度が1.0ng/mLであれば体内のジゴキシン量は250μgと考えられる(図2)。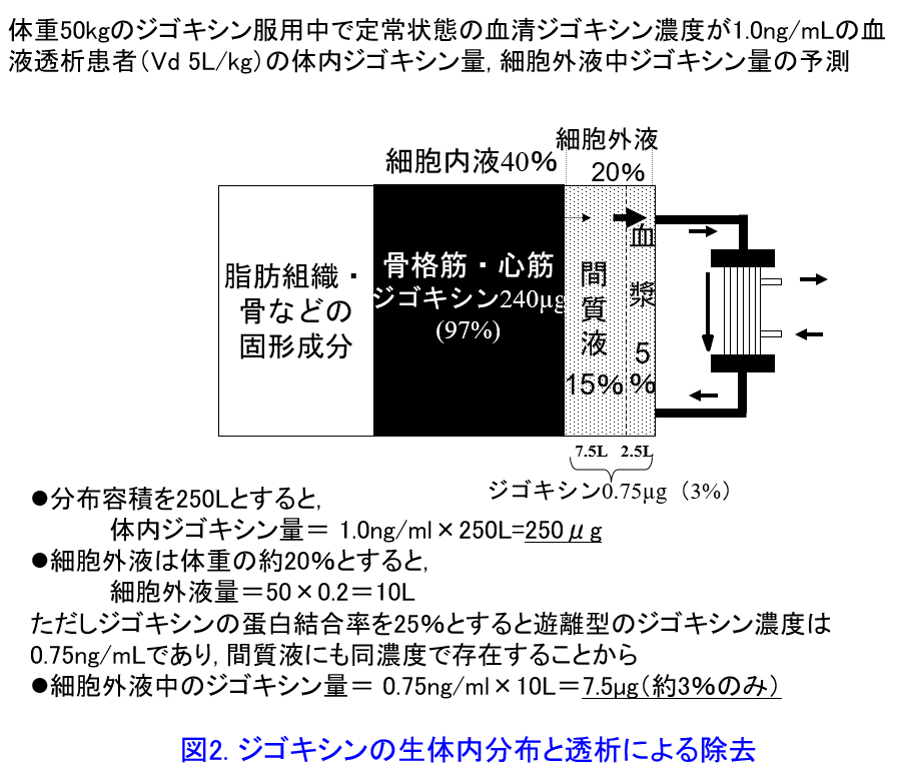 そのうち血液透析によって浄化される血漿量はわずかに2.5L、さらに間質液(細胞間液)を加えても10L程度しかないため細胞外液中のジゴキシンは蛋白結合率を25%とすると0.75ng/mL×10L=7.5μgしかなく、体内ジゴキシン量の約3%しか細胞外液に存在しないことになる。Vdが大きいと組織への薬物の結合力も強く、ジゴキシンは分布するのに数時間を要するため、細胞内液から細胞外液への移動は非常に遅いと考えられるため、実質的には細胞外液のみを浄化する血液透析(HD)をはじめとした各種血液浄化法では十分除去されない1)。ジゴキシンの透析クリアランスは10~30mL/minであり、HD直後の血清ジゴキシン濃度は明らかに低下するものの、2時間以内にほぼ透析前の濃度に戻ると報告されている2)。しかし吸収・分布に時間を要するため、ジゴキシン経口剤では服用後6時間以上経過しないと血清濃度と組織内濃度が平衡状態に到達しないといわれているため、もっと時間を要する可能性も考えられる。また、HDで除去されるジゴキシンのクリアランスを20mL/minとすると4時間透析で5L足らずで、Vdの2%以下にすぎない(表)。
そのうち血液透析によって浄化される血漿量はわずかに2.5L、さらに間質液(細胞間液)を加えても10L程度しかないため細胞外液中のジゴキシンは蛋白結合率を25%とすると0.75ng/mL×10L=7.5μgしかなく、体内ジゴキシン量の約3%しか細胞外液に存在しないことになる。Vdが大きいと組織への薬物の結合力も強く、ジゴキシンは分布するのに数時間を要するため、細胞内液から細胞外液への移動は非常に遅いと考えられるため、実質的には細胞外液のみを浄化する血液透析(HD)をはじめとした各種血液浄化法では十分除去されない1)。ジゴキシンの透析クリアランスは10~30mL/minであり、HD直後の血清ジゴキシン濃度は明らかに低下するものの、2時間以内にほぼ透析前の濃度に戻ると報告されている2)。しかし吸収・分布に時間を要するため、ジゴキシン経口剤では服用後6時間以上経過しないと血清濃度と組織内濃度が平衡状態に到達しないといわれているため、もっと時間を要する可能性も考えられる。また、HDで除去されるジゴキシンのクリアランスを20mL/minとすると4時間透析で5L足らずで、Vdの2%以下にすぎない(表)。 この場合、透析膜に透水性の高い膜(high flux膜)を使用してもクリアランスはあまり改善しない。一方、血液濾過法(HF)によるジゴキシンクリアランスは45mL/min3)、活性炭を用いた血液吸着法(DHP)で50~100mL/min4)であり、腹膜透析(CAPD)による除去率はHDよりもはるかに低く、2~3mL/minである5)。ジゴキシン中毒の治療法としてCAPDは全く無意味であり、一見、有効そうに見えるDHPでもジゴキシンのVdがあまりにも大きいため、DHPによってたとえ血液中及び細胞間液中の全てのジゴキシンを吸着しえたとしても、それらの生体内ジゴキシンに占める割合は低いため、DHPによるジゴキシン除去率も4.8%以下と低いことが報告されており6)、急性ジゴキシン中毒に活性炭を用いたDHPはほとんど効果ない。あらゆる血液浄化法がジゴキシンの除去には有効ではなく7)、ジゴキシンを血液浄化後に補充する必要はないと思われる。
この場合、透析膜に透水性の高い膜(high flux膜)を使用してもクリアランスはあまり改善しない。一方、血液濾過法(HF)によるジゴキシンクリアランスは45mL/min3)、活性炭を用いた血液吸着法(DHP)で50~100mL/min4)であり、腹膜透析(CAPD)による除去率はHDよりもはるかに低く、2~3mL/minである5)。ジゴキシン中毒の治療法としてCAPDは全く無意味であり、一見、有効そうに見えるDHPでもジゴキシンのVdがあまりにも大きいため、DHPによってたとえ血液中及び細胞間液中の全てのジゴキシンを吸着しえたとしても、それらの生体内ジゴキシンに占める割合は低いため、DHPによるジゴキシン除去率も4.8%以下と低いことが報告されており6)、急性ジゴキシン中毒に活性炭を用いたDHPはほとんど効果ない。あらゆる血液浄化法がジゴキシンの除去には有効ではなく7)、ジゴキシンを血液浄化後に補充する必要はないと思われる。
*1分布容積(Vd:volume of distribution):分布容積=体内薬物量/血中濃度で表される。つまり薬物が見かけ上、血中濃度と等しい濃度で均一に分布するような体液の容積のことで、体内量と血中濃度を結び付けるために考えられた換算定数である。分布容積が大きいほど薬物の血中濃度は低く、組織に移行しやすいと言える。
引用文献
1) 平田純生, 他: 血液透析による薬物除去率に影響する要因. 透析会誌37: 1893-1900, 2004.
2) IIsalo E, Forsstrom J : Elimination of digoxin during maintenance hemodialysis. Annals of Clinical Research 6, 203-206,1974.
3) Rambausek M, Ritz E: Digitalis in chronic renal insufficiency. Blood Purif 3: 4-14, 1985.
4) Carvallo A, et al: Treatment of digitalis intoxication by charcoal hemoperfusion. Trans Am Soc Artif Intern Organs, 22 : 718-722, 1976.
5) Pancorbo S, Comty C: Digoxin pharmacokinetics in continuous peritoneal dialysis. Ann Intern Med 93: 639, 1980.
6) Clerckx-Braun F, et al: Digoxin acute intoxication: evaluation of the efficiency of charcoal hemoperfusion. Clin Toxicol 15: 437-446,1979
7) 平田純生, 他: ジゴキシンの投与法?腎不全、血液浄化法との関連. ICUとCCU 21(7)619-624, 1997 .
≪ 理解度テスト ≫
1. 体重よりも大きな分布容積ってある?
2. 分布容積が一番小さい薬物の分布容積って何L/kgくらい?
3. 分布容積が最小値の薬にはどんな薬がある?
4. 分布容積が一番大きい薬物の分布容積って何L/kgくらい?
5. 蛋白競合による副作用ってある?例えば①蛋白結合率90%のフェニトイン300mg/日を投与している人に蛋白結合率90%のバルプロ酸を1200mg/日併用すると有害反応は起こるのか?
あるいは②ワルファリン3mg/日を投与している人にNSAIDのフェニルブタゾン(製造中止)を併用すると蛋白競合による相互作用は起こるのか?
≪ 解 答 ≫
1. いっぱいある。初回投与後の血中ピーク濃度=初回投与量/分布容積で示される。投与量はもちろんわかるし、ピーク濃度は消失相の2点を測定すればわかる。図3にバンコマイシンのピーク濃度とCmaxの違いを示すが、分布終了するのに2時間はかかるバンコマイシンのCpeakは消失相の2点を測定しそれを延長した破線と点滴終了時との交点がCpeakとなる。分布容積は仮の値なので、投与量が多いのに、血中濃度が低いってことはVdが大きくなる。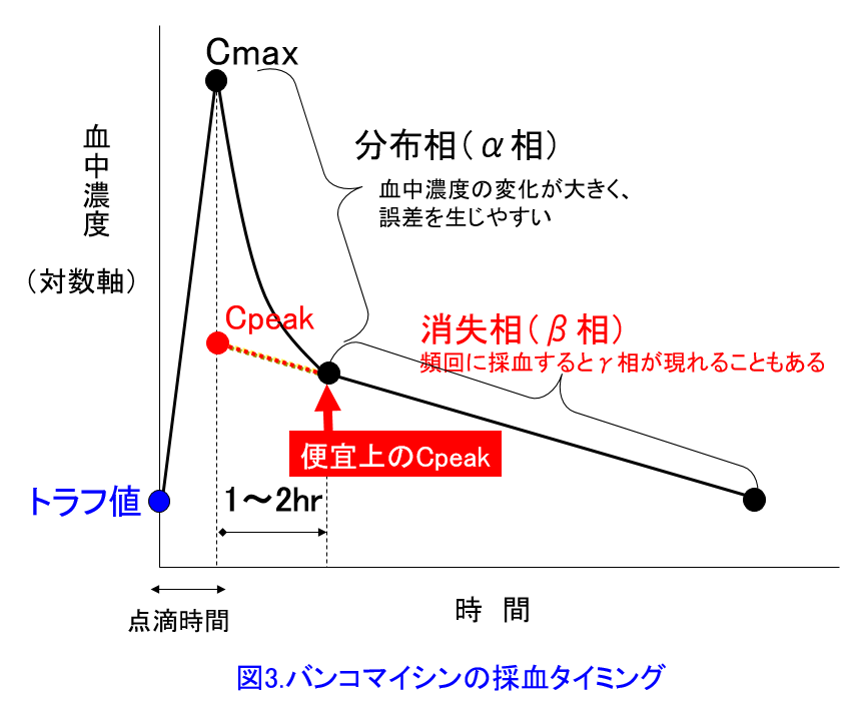
2. 薬の定義を「全身循環して作用を示す薬」と定義すれば、分布容積の最小値は血管内の血液量といいたいところだが、赤血球などの血球は細胞なので、血漿量が最小値になる。血漿量は体重の5%しかないので、0.05L/kgがVdの最小値だ。体重50kgの人なら2.5L になる。
3. 蛋白結合率が100%のため血管外に漏出しない薬。血漿量を測定するために実験で使う色素のエバンスブルーがそれにあたる。このほかにも血管外に漏出しない薬は抗体製剤などもそうだ。抗VEGF抗体ヒト化モノクローナル抗体でアバスチン®の商品名で有名な抗悪性腫瘍薬ベバシズマブなど○○マブという名前が付くものや免疫グロブリン製剤などのVdも0.05L/kgと考えてよい。
4. よくわからない。おそらく無限大かもしれない。筆者が知っている薬で最大のVdの薬物はアミオダロンで70~621L/kg。50kgの人なら3.5トン~31トンになる。脂肪組織のシアル酸と強固に結合するため、脂肪組織内濃度が非常に高い。半減期=ln2×Vd/CLで表されるため、アミオダロンの半減期は26~107日と長い。長期間服用していた人は投与中止して半年後でも血中濃度が測れることになる。
5. 蛋白競合といわれていた相互作用はあるが、経口薬同士の相互作用で実際に有害反応につながることはない。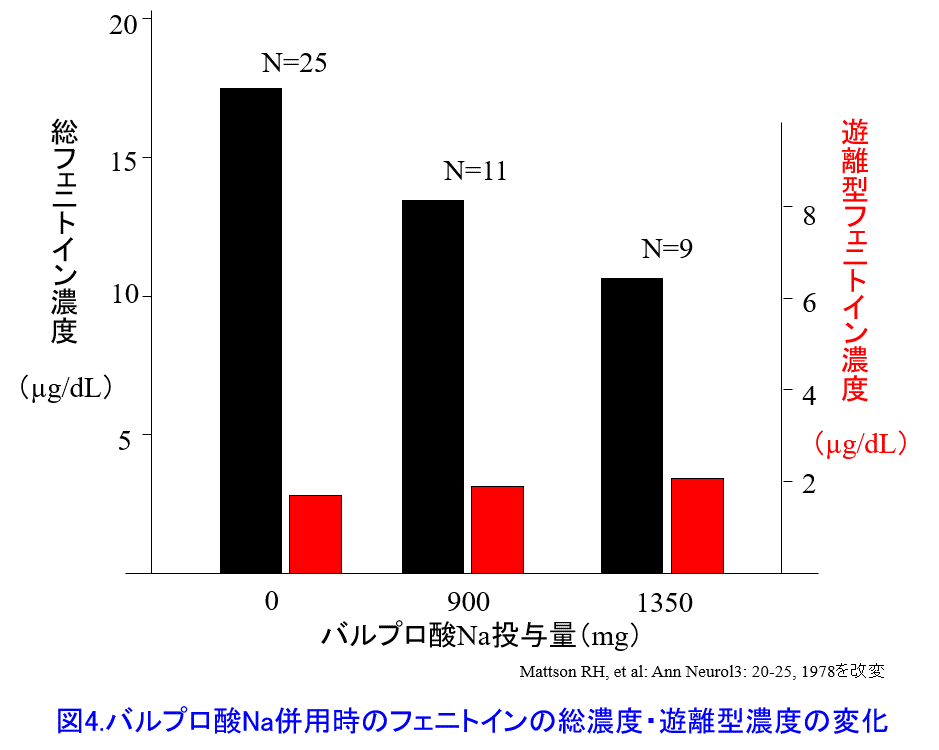 現在では過去に報告された有害反応は代謝阻害など他のメカニズムであることが報告されている(Rolan et al: Br J Clin Pharmacol 37: 125-128, 1994)。①フェニトインにバルプロ酸を投与すると血中フェニトイン総濃度は著明に低下するが、遊離型濃度は不変のため、有害反応は起こらない(図4)。そのメカニズムとして蛋白結合率の高い他剤併用によって蛋白から離れた遊離型薬物は代謝・排泄されて消失しやすくなり、間質液に遊離型薬物が移行できるのでVdが大きくなって血中遊離型薬物濃度は上がらない(図5)。そのため、中毒性の副作用が起こることはないと考える。
現在では過去に報告された有害反応は代謝阻害など他のメカニズムであることが報告されている(Rolan et al: Br J Clin Pharmacol 37: 125-128, 1994)。①フェニトインにバルプロ酸を投与すると血中フェニトイン総濃度は著明に低下するが、遊離型濃度は不変のため、有害反応は起こらない(図4)。そのメカニズムとして蛋白結合率の高い他剤併用によって蛋白から離れた遊離型薬物は代謝・排泄されて消失しやすくなり、間質液に遊離型薬物が移行できるのでVdが大きくなって血中遊離型薬物濃度は上がらない(図5)。そのため、中毒性の副作用が起こることはないと考える。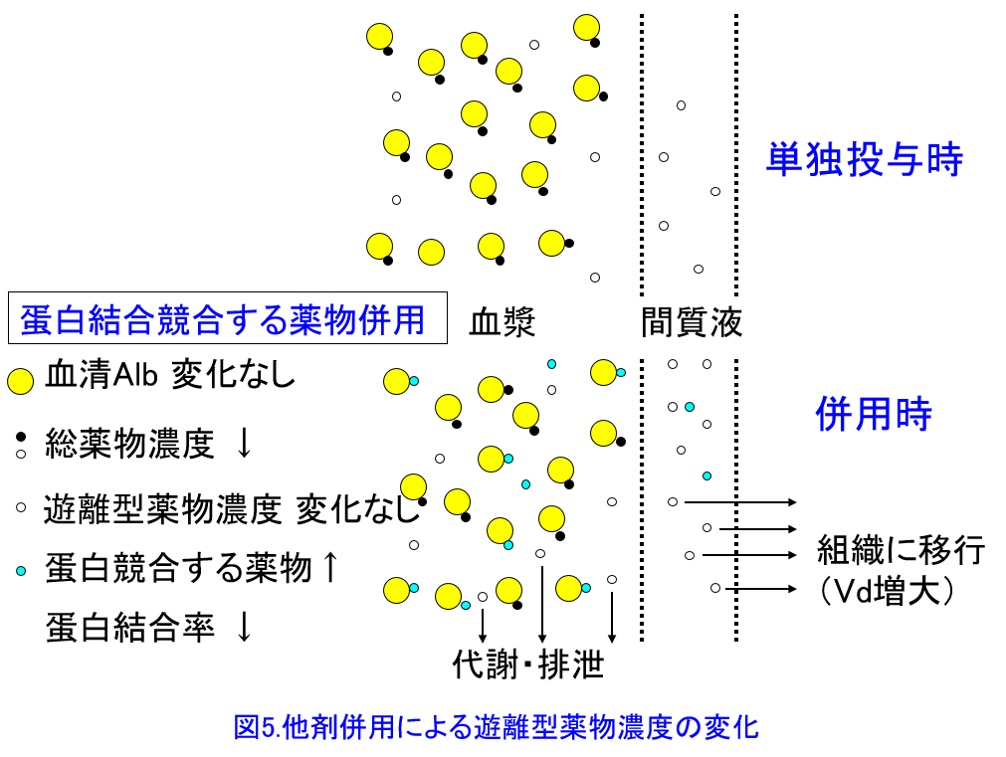 ② ワルファリンとNSAIDsの併用はいずれもCYP2C9の基質であるため、以前は蛋白競合阻害と考えられていたメカニズムは代謝阻害による有害反応ととらえられており、ロルノキシカムはCYP2C9阻害薬でありS-ワルファリン濃度のAUCを1.58倍上昇させる(ラセミ体で1.32倍;Kohl C, Steinkellner M: Drug Metab Dispos 28:161-168, 2000 )ことやセレコキシブでも代謝阻害によってワルファリン服用者が消化管出血を起こした報告がある(Malhi H, et al: Postgrad Med J 80: 107-109, 2004)。イブプロフェン、インドメタシン、メフェナム酸、ピロキシカム、テノキシカムもCYP2C9の基質なので蛋白競合阻害ではなく代謝阻害による相互作用を起こすかもしれない。しかもNSAIDs併用によるによる消化管出血はワルファリンの易出血の有害反応とNSAIDsによる胃障害・抗血小板作用による薬物動力学的な相互作用も重なった有害反応と考えることもできる。
② ワルファリンとNSAIDsの併用はいずれもCYP2C9の基質であるため、以前は蛋白競合阻害と考えられていたメカニズムは代謝阻害による有害反応ととらえられており、ロルノキシカムはCYP2C9阻害薬でありS-ワルファリン濃度のAUCを1.58倍上昇させる(ラセミ体で1.32倍;Kohl C, Steinkellner M: Drug Metab Dispos 28:161-168, 2000 )ことやセレコキシブでも代謝阻害によってワルファリン服用者が消化管出血を起こした報告がある(Malhi H, et al: Postgrad Med J 80: 107-109, 2004)。イブプロフェン、インドメタシン、メフェナム酸、ピロキシカム、テノキシカムもCYP2C9の基質なので蛋白競合阻害ではなく代謝阻害による相互作用を起こすかもしれない。しかもNSAIDs併用によるによる消化管出血はワルファリンの易出血の有害反応とNSAIDsによる胃障害・抗血小板作用による薬物動力学的な相互作用も重なった有害反応と考えることもできる。
「今日はここまで、それではまた次回お楽しみに!」
◆連載◆薬物動態学 3限目
3限目:バイオアベイラビリティを理解しよう
~吸収率と肝初回通過効果~
今回の要約: バイオアベイラビリティが低い原因は2つと理解する!
①脂溶性薬物の消化管吸収は良好だが、初回通過効果を受けやすいからFが小さいと考える。
②水溶性薬物は初回通過効果を受けにくいが、吸収率が不良だからFが小さいと考える。
プロプラノロールは脂溶性が高いために、消化管粘膜を通過しやすい*1。特に高脂肪食とともに服用すると界面活性作用を持つ胆汁酸の分泌が促進することにより吸収が格段によくなる。しかし消化管粘膜から吸収されたプロプラノロールは門脈を経て肝臓で初回通過効果*2を受け、半分以上が代謝され消失するため、経口投与された量の30~40%しか血中には移行しない。このことをプロプラノロールのバイオアベイラビリティ*3(F)は30~40%であると表わす。
F=(消化管における吸収率)×(消化管および肝臓における初回通過効果回避率)で表されるが、これは分かりにくいので、F=非静注製剤を投与した時のAUC/静注製剤を投与した時のAUCで理解しよう(静注製剤のFは当然100%だ)。脂溶性薬物であるプロプラノロールのFが小さい原因は肝臓における初回通過効果を受けやすいことに起因する。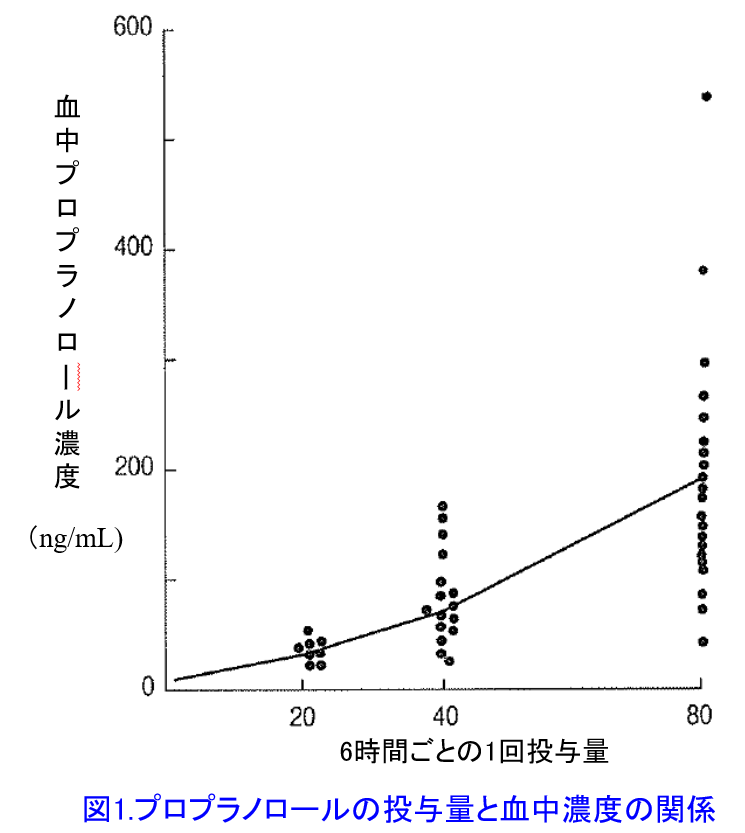
プロプラノロールは肝で代謝を受ける薬物であるため、至適投与量には個人差があり1,2)、10mg服用しただけで血圧が下がりすぎる人もいれば、200mg服用してもほとんど効果がないという人もいる。このことは同一量を投与した患者の血中濃度を調べてみるとプロプラノロールでは7~20倍の個人差が生じたという報告3,4)と一致する(図1)4)。図1は肝代謝薬物であるプロプラノロールは同一用量でも個人間で20倍の血中濃度の差が生じている。初回投与後の血中濃度の個人差はVdに依存し(4限目で詳述)、Vdの個人差は小さいが、2回目以降は徐々に個人個人の代謝能力(クリアランス:6限目で詳述)の個人差が大きくなり、3回目の投与では10倍以上の個人差になっており、この差はさらに大きくなる可能性がある。これは重篤な肝障害によって肝代謝能力が著しく低下するだけでなく、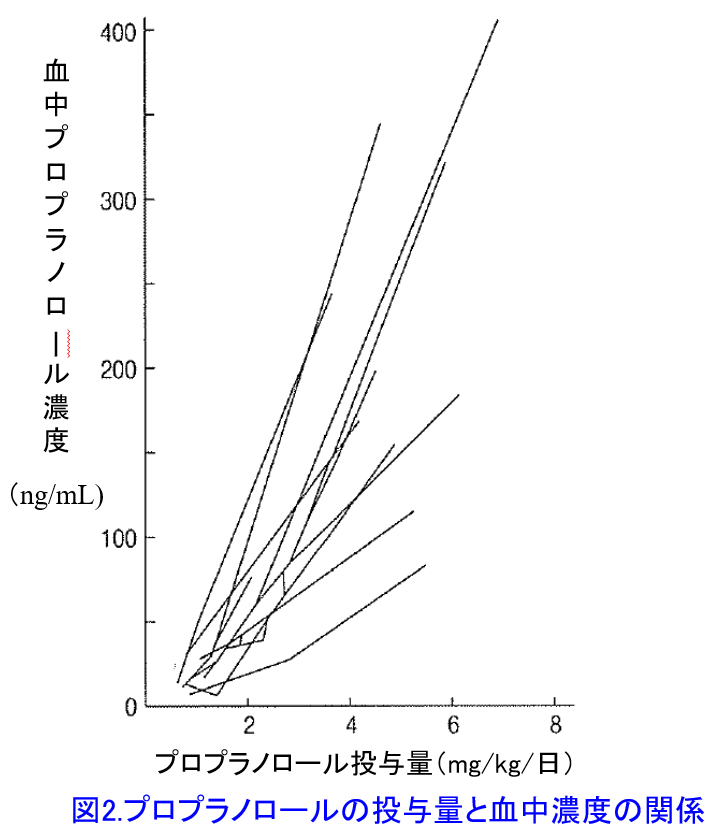 たとえ肝障害がなくとも、もともと遺伝的に肝臓の代謝酵素の活性や発現量が人によって大きく異なることを示している。プロプラノロールの代謝はCYP1A2*4とCYP2D6によって行われるが、2D6には遺伝的に poor metabolizer(代謝されにくい人)からultrarapid metabolizer(代謝が超速い人)*5まで存在し、代謝能力の個人差が大きいことが知られている。ただし同一個人内では投与量と血中濃度の相関性は高い(図2)4)。遺伝子多型のないCYP3A4によって代謝されるニフェジピンだってヒト肝ミクロソームのCYP3A4蛋白発現量の個人差によって同じ量をのんでも血中濃度は10倍の個人差があることが報告されている(図3)5)。このように肝代謝型薬物は肝代謝能力の個人差があるため投与設計がしづらいのだ。腎排泄型薬物の場合、腎機能の個人差があるが腎機能が分かれば投与設計はできる!この方法については近々、ブログにアップしたい。プロプラノロールやニフェジピンは比較的安全域の広い薬物であるためTDMの実施は必ずしも必要ではないが、代謝能力の個人差が大きく安全域の狭い薬物ではTDMによる至適投与設計*6が必要となる。
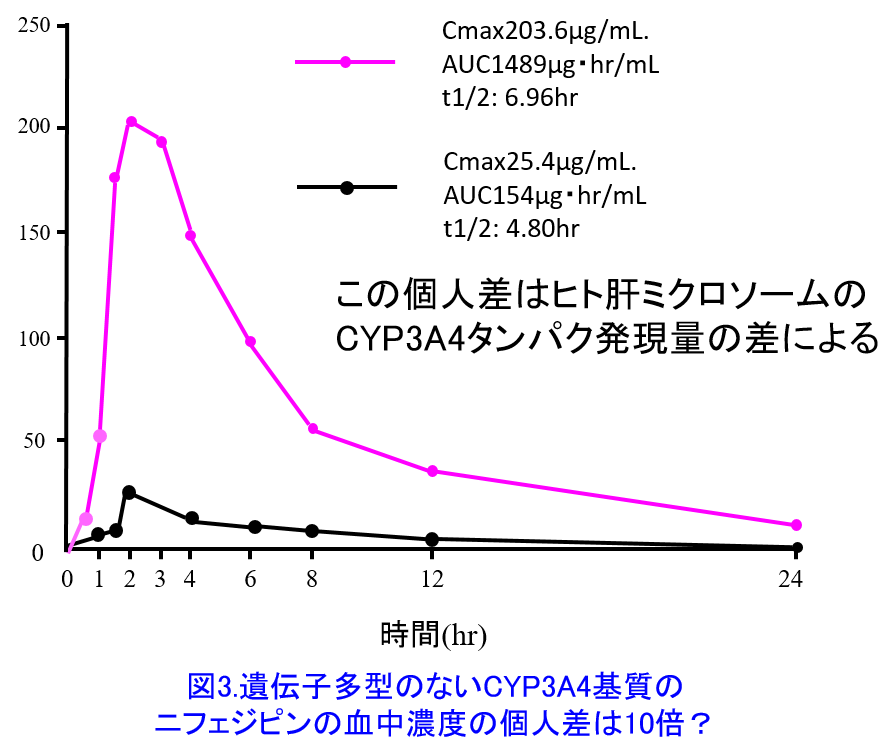
たとえ肝障害がなくとも、もともと遺伝的に肝臓の代謝酵素の活性や発現量が人によって大きく異なることを示している。プロプラノロールの代謝はCYP1A2*4とCYP2D6によって行われるが、2D6には遺伝的に poor metabolizer(代謝されにくい人)からultrarapid metabolizer(代謝が超速い人)*5まで存在し、代謝能力の個人差が大きいことが知られている。ただし同一個人内では投与量と血中濃度の相関性は高い(図2)4)。遺伝子多型のないCYP3A4によって代謝されるニフェジピンだってヒト肝ミクロソームのCYP3A4蛋白発現量の個人差によって同じ量をのんでも血中濃度は10倍の個人差があることが報告されている(図3)5)。このように肝代謝型薬物は肝代謝能力の個人差があるため投与設計がしづらいのだ。腎排泄型薬物の場合、腎機能の個人差があるが腎機能が分かれば投与設計はできる!この方法については近々、ブログにアップしたい。プロプラノロールやニフェジピンは比較的安全域の広い薬物であるためTDMの実施は必ずしも必要ではないが、代謝能力の個人差が大きく安全域の狭い薬物ではTDMによる至適投与設計*6が必要となる。
一方、アテノロールは水溶性薬物であるため消化管吸収率は低く、平均40%程度しか吸収されないが、肝での代謝を無視できるため、肝障害でも減量の必要はないが、腎から排泄されるため腎障害時は腎機能に応じた減量が必要となる4)。
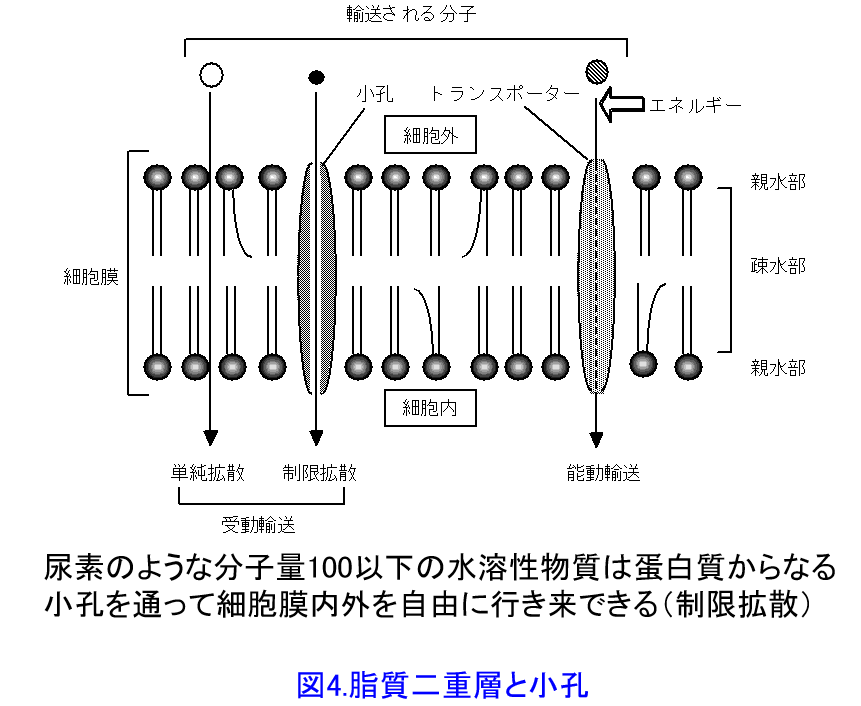
*1)消化管粘膜の通過:生体膜は蛋白質と脂質からなる二重構造(図4)によって形成されているため、脂質への溶けやすさ、つまり脂溶性が受動拡散による吸収されやすさを決定する主要な因子になる。しかしシクロスポリンや脂溶性ビタミンなどのように脂溶性が高すぎると溶解性が低下し、界面活性作用のある胆汁酸が分泌されない空腹時に服用すると吸収率が著明に低下する。ビタミンEの吸収は空腹時に飲むと食後の1/20しか吸収されないのだ。ネオーラル®はシクロスポリンの吸収の不安定さを改善するために生まれたマイクロエマルジョン製剤であり食前に飲んで食後2時間(C2)濃度が効果、つまりAUCと相関しやすいことが明らかになっている。
 *2)初回通過効果(first pass effect):薬物が消化管から吸収され肝を経て全身に移行していく前に、小腸や肝臓で代謝を受ける現象のこと。肝で代謝されやすい経口剤では消化管で吸収後、門脈経由で肝を通過し、代謝されてから血中に移行するため生物学的利用率Fが低下する。CYP3A4の基質となる薬物は一般的に小腸における初回通過効果を受けやすいため、シンバスタチン・アトルバスタチンやフェロジピンなどバイオアベイラビリティの低い薬はCYP3A4の基質が多いことに気づく。これらの薬はグレープフルーツやイトラコナゾールと絶対に一緒に飲んじゃダメってことは知ってるよね?Fが小さいからだよ。薬剤情報提供用紙を渡すだけでなく薬剤師は口頭でも絶対にグレープフルーツを食べたり飲んだりしたらダメといわねばならない!ニフェジピンやアムロジピンのFは50%以上あるからそこまで言う必要はない。坐薬や注射薬は初回通過効果を受けない。
*2)初回通過効果(first pass effect):薬物が消化管から吸収され肝を経て全身に移行していく前に、小腸や肝臓で代謝を受ける現象のこと。肝で代謝されやすい経口剤では消化管で吸収後、門脈経由で肝を通過し、代謝されてから血中に移行するため生物学的利用率Fが低下する。CYP3A4の基質となる薬物は一般的に小腸における初回通過効果を受けやすいため、シンバスタチン・アトルバスタチンやフェロジピンなどバイオアベイラビリティの低い薬はCYP3A4の基質が多いことに気づく。これらの薬はグレープフルーツやイトラコナゾールと絶対に一緒に飲んじゃダメってことは知ってるよね?Fが小さいからだよ。薬剤情報提供用紙を渡すだけでなく薬剤師は口頭でも絶対にグレープフルーツを食べたり飲んだりしたらダメといわねばならない!ニフェジピンやアムロジピンのFは50%以上あるからそこまで言う必要はない。坐薬や注射薬は初回通過効果を受けない。
*3)バイオアベイラビリティ(F:bioavailability、生物学的利用率とも言う):薬物が血管外投与された時に生物学的に利用できる量として循環血中に移行した割合のこと。一般的には血管外投与(経口、筋注、直腸内投与など)された未変化体の血中における総量(AUC: area under the curve)と、同じ量を静注投与した時の総量(静注投与時のAUC)の比率で表す。たとえば経口剤の場合では経口投与された量に対して、循環血中に入った量の割合のことを指し、Fで表す。インタビューフォームで静注製剤と経口薬を同量投与してAUCに差がなければFは1に近い、逆に経口薬のAUCが静注投与時と比べてとても小さいときにはFが1よりもずいぶん小さいと考えられる。Fが小さい薬物は吸収が悪いか、肝による初回通過効果を受けて消失しやすいかのどちらかだと考えればわかりやすい。
*4)CYP(Cytochrome P450):薬物代謝酵素で最も重要なチトクロームP450のこと。最近、CYPの分子種は数十種類、存在することがわかり、CYPの分子種別に相互作用メカニズムが解明されつつある。主要なisoformとしてCYP3A4、CYP2D6、CYP2C19、CYP2C9、CYP1A2がある。
*5)poor metabolizerとultrarapid metabolizer:薬物を正常に代謝できる能力を有する個体をEM: extensive metabolizer(またはrapid metabolizer)という。それに対し代謝酵素の遺伝的な酵素欠損によって薬物を十分代謝できない個体をPM: poor metabolizer(またはslow metabolizer)という。CYP2D6に関して言えばエチオピア人やサウジアラビア人の中には10~20%程度、日本人にも1~2%非常に高い活性を持つUM: ultrarapid metabolizerが存在し、日本人では10%前後、正常型と欠損型の中間の活性を示すIM: intermediate metabolizerが存在することが分かっている。
*6)TDMに基づく至適投与設計:TDMとは治療薬物モニタリングtherapeutic drug monitoringのこと。同一用量を投与しても人によって効果の出方、すなわち感受性が異なる原因として、①同じ用量を投与しても薬物血中濃度が同じにならないという薬物動態の個人差と、②同じ濃度であっても効果の出方すなわち感受性が異なるという薬物動力学の個人差が考えられる(図5)。
 そして多くの場合、前者の①薬物動態学的な原因によって引き起こされる個人差のほうがより大きいことが明らかにされている。薬物の薬理作用は作用部位の受容体と結合する薬物量の影響を受けるので、投与量よりも血中濃度の方が薬理効果との相関性がはるかに高いと考えられる。そのため薬物の血中濃度を測定し、薬理作用が最大限に、副作用が最小限になるような血中濃度域(有効治療域)内に収まるように投与量を個別化することが、より合理的に薬物投与を行えることになる(図6)。このように薬物動態学と薬物動力学を科学的根拠にして、有効かつ安全な薬物療法を実現すること、これがTDMの基本である。
そして多くの場合、前者の①薬物動態学的な原因によって引き起こされる個人差のほうがより大きいことが明らかにされている。薬物の薬理作用は作用部位の受容体と結合する薬物量の影響を受けるので、投与量よりも血中濃度の方が薬理効果との相関性がはるかに高いと考えられる。そのため薬物の血中濃度を測定し、薬理作用が最大限に、副作用が最小限になるような血中濃度域(有効治療域)内に収まるように投与量を個別化することが、より合理的に薬物投与を行えることになる(図6)。このように薬物動態学と薬物動力学を科学的根拠にして、有効かつ安全な薬物療法を実現すること、これがTDMの基本である。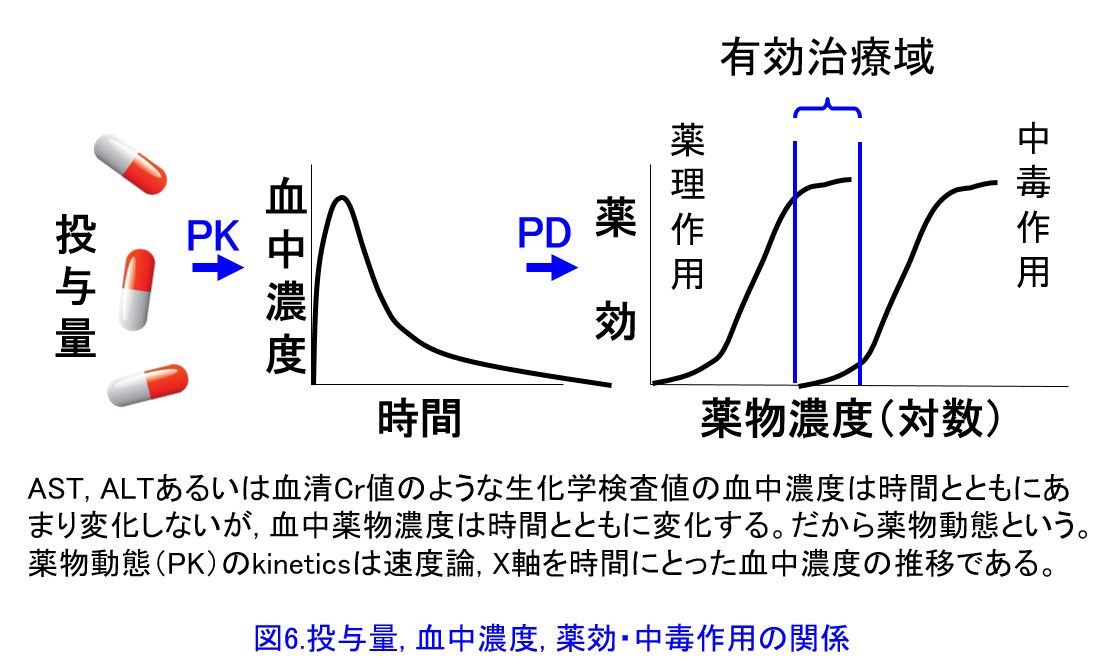 TDMは薬物動態の得意な薬剤師が中心となって投与設計ができるので、薬剤師の腕の見せ所だ。ただしβ遮断薬は比較的安全性の高い薬物であるため、研究目的以外にTDMが実施されることはない。
TDMは薬物動態の得意な薬剤師が中心となって投与設計ができるので、薬剤師の腕の見せ所だ。ただしβ遮断薬は比較的安全性の高い薬物であるため、研究目的以外にTDMが実施されることはない。
引用文献
1. Lardinois CK, Neuman SL: The Effects of Antihypertensive Agents on Serum Lipids and Lipoproteins . Arch Int Med 148: 1280-1288, 1988.
2. Prichard BN : The beta-adrenergic blockade withdrawal phenomenon. J Cardiovasc Pharmacol 5: S56-S62, 1983.
3. Shand DG, Rangno RE: The disposition of propranolol. Elimination during oral absorption in man. Pharmacology 7: 159-168, 1972.
4. 石崎高志: β受容体遮断薬の臨床薬理学. 診断と治療 77: 2853-2865, 1989.
5. 田中利明, 他: Investigation on the interethnic differences in the pharmacokinetics of nifedipine and nisoldipine. 臨床薬理27: 31-32, 1996
≪ 理解度テスト ≫
1.以下の薬物は何で経口投与できないんだろう?
①ニトログリセリン(狭心症治療薬)
②ゲンタマイシン(アミノグリコシド系抗菌薬)
③セファゾリン(セフェム系抗菌薬)
2.以下の薬物のバイオアベイラビリティが低い原因は?
①バンコマイシン(グリコペプチド系抗菌薬)0%
②アシクロビル(抗ヘルペスウイルス薬)20%
③シンバスタチン(高コレステロール血症治療薬;スタチン薬)5%
3.以下の設問に答えなさい。
①EPA、DHA、ビタミンE、βカロチンは食後か空腹時のどちらが吸収がいい?
②ビタミンB2、ビタミンB12は食後か空腹時のどちらが吸収がいい?
≪ 解 答 ≫
1.以下の薬物は何で経口投与できないんだろう?
①ニトログリセリン錠で初回通過効果を受け完全に消失するため、血中には全く入らない。つまりF=0であるため、静注投与、舌下投与、貼付剤として投与可能だが経口投与しても意味がない。
②ゲンタマイシンはアミノグリコシド系で極性が高い親水性薬物。脂質二重層を通ることができない。ということは吸収率が0%なので経口投与しても意味がない。だけどカナマイシンカプセルが使われているのは、吸収されないから腸内殺菌には都合が良いためなんだ。
③セファゾリンはβラクタム系なので、アミノグリコシド系と同様に極性が高い親水性薬物。脂質二重層を通ることができない。だけどABPCやAMPC、セファレキシン、セファクロルなどまれに吸収率が高い抗菌薬があるのは例外!なんで例外かっていうとこれらの構造がたまたまアラニルアラニンというジペプチドの構造と似ていたために小腸のペプチドトランスポータのPEPTが、これらのβラクタム薬を「ペプチドだから吸収しなくっちゃ」と勘違いして吸収された例外中の例外。これらのほかにもセフカペンピボキシル、セフジトレンピボキシル、セフテラムピボキシル、セフポドキシムブロキセチル、セフジニルなどのように意図的に脂溶性の高い基を付けて無理やり吸収させようとしている第3世代経口セフェムがある。これらの吸収率は分かっているもので14~50%と低いし、吸収率が分かっていないものもある。だけど第3世代経口セフェムって要る?近年、喘息、アトピー、鼻炎、食物アレルギーといった僕が子供のころ(1960年代)には聞いたこともなかったアレルギーマーチが増えているが、2歳までに抗菌薬を使用した子供に多いということが問題になっている1)。Fが小さいってことは感染部位には到達しにくく、必要な腸内細菌を殺すことにならないだろうか?しかもピボキシル基は体内でピバリン酸になって、カルニチンと結合して尿中に排泄されるため、血清中の遊離型カルニチン濃度が低下して低血糖が生じる危険な症状が多くの小児で報告されている。
1)Hanada KY, et al: Influence of Antibiotic Use in Early Childhood on Asthma and Allergic Diseases at Age 5 . Ann Allergy Asthma Immunol 119: 54-58, 2017
2.以下の薬物のバイオアベイラビリティが低い原因は?
①バンコマイシンは分子量が1486Daと大きいため、脂質二重層を通らない。つまり吸収されない。ただし、クロストリディオイデス・ディフィシル(Clostridioides difficile)の殺菌のために腎機能が極度に低下した透析患者の偽膜性腸炎に経口投与すると下部消化管粘膜が破壊され脂質二重層というバリアを通過し、腎から排泄されにくくなって血中濃度が上昇することがある。
②アシクロビルは投与量を増やすと吸収率が低下するため1日5回も投与しなければならない薬。おそらく親水性なので吸収されないのだろうが、たまたま小腸のトランスポータの基質になったからかろうじて飲み薬になったのだと思う。なぜなら添付文書の記載「健康成人にアシクロビル200mg及び800mgを単回経口投与した場合、48時間以内にそれぞれ投与量の25.0%及び12.0%が未変化体として尿中に排泄された。」の解釈は吸収されたものだけが全身循環に乗って腎臓を通って排泄されたと考えられる。投与量が多くなると吸収率が低下することでトランスポータによって吸収される薬物だと推測される。トランスポータは投与量が多くなると飽和して吸収率が低下する(吸収が飽和する)という特性を持つからだ。つまりFは12~25%以上と考えられる。静注製剤の添付文書には「健康成人へ5又は10mg/kgを1時間点滴静注した時、48時間以内にそれぞれ68.6%又は76.0%が未変化体として尿中排泄された」と記載されているので、腎排泄にもトランスポータが関わっているので(再吸収するトランスポータに飽和現象が認められているのが分かりますか?)、尿中排泄率が70%と仮定すると内服アシクロビルのFは17~36%程度で、やはり吸収率は高くない。
③シンバスタチンはCYP3A4の基質なので肝臓だけでなく小腸での初回通過効果を受けやすい。そういえばFが小さい薬物はCYP3A4の基質薬物が多いことに気づく。小腸での初回通過効果が大きいってことはグレープフルーツなどの相互作用のインパクトも大きいってことだ。だって5%のFが完全に初回通過効果を抑えられたら20倍になっちゃうんだものね。
3.以下の設問に答えなさい。
①まさに脂溶性薬物ばかり。これらは食後(特に脂っこいものを食べた後)には胆汁酸という界面活性剤が分泌されるので、吸収率が格段に良くなる。界面活性剤は洗剤のようなもの脂を乳化して溶かしてくれるからだ。
②これは食後。輸送担体によって吸収されるから、空腹時に投与すると胃内容排出速度(GER: gastric emptying rate)が速いので、数限りある輸送担体が100%キャッチできなくなるからGERがゆっくりになる食後の方が吸収は良い。これって20年くらい前の薬剤師国家試験に出題されていたんだけど、臨床的な意味はほとんどないと思う。だってこれらのビタミン剤は結構大量に含まれている。リポビタンDを飲んでしばらくすると尿が鮮やかな黄色になるのはビタミンB2が十分吸収されているからという証拠です。
「今日はここまで、それではまた次回お楽しみに!」
◆連載◆薬物動態学 2限目
2限目:プロプラノロールとアテノロールの違いからADMEを知ろう!
今回の要約:
①Ca拮抗薬、ARB、α遮断薬はすべて肝代謝型薬物なので腎機能が低下しても減量の必要はない。
②ACE-I、ループ利尿薬・サイアザイド系利尿薬、クロニジンは腎排泄型降圧薬。
③β遮断薬だけは薬によってさまざまでアテノロール、ナドロール、カルテオロールだけは腎排泄、それ以外は肝代謝と覚えよう。
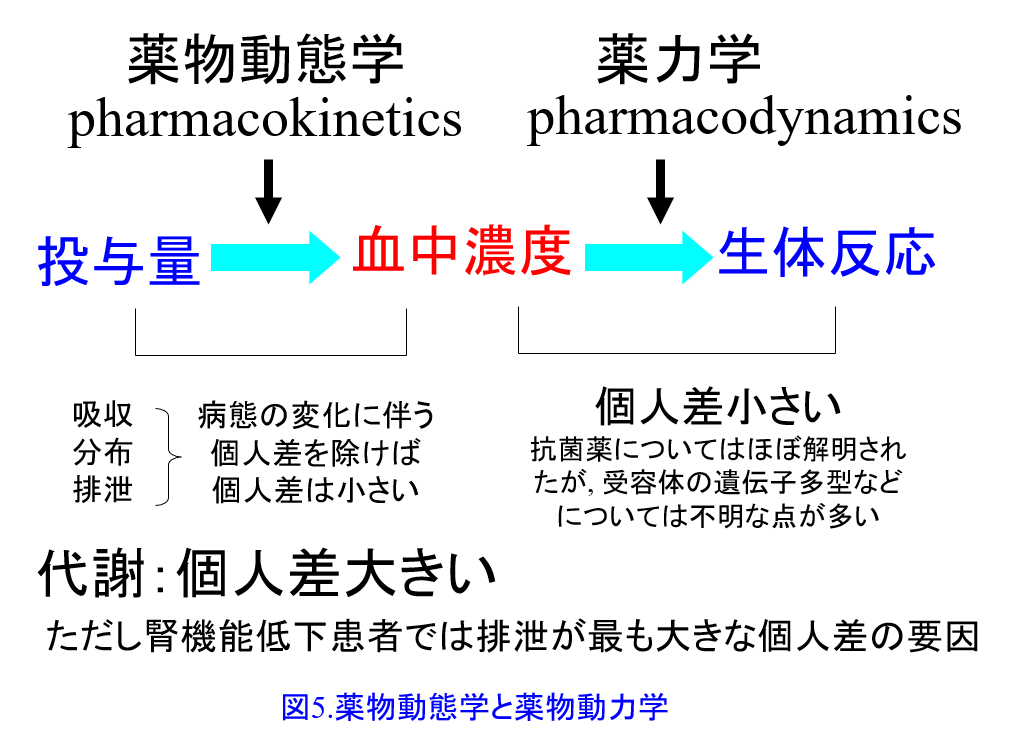
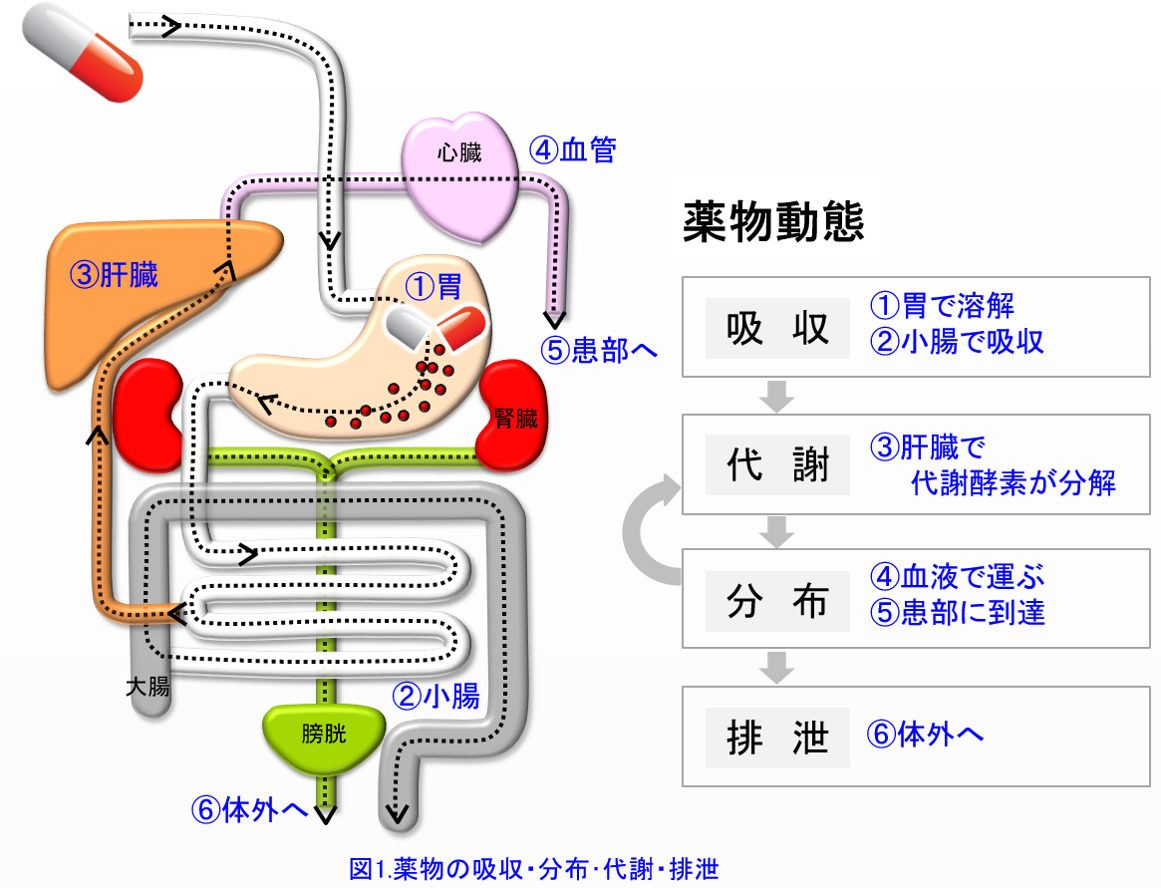
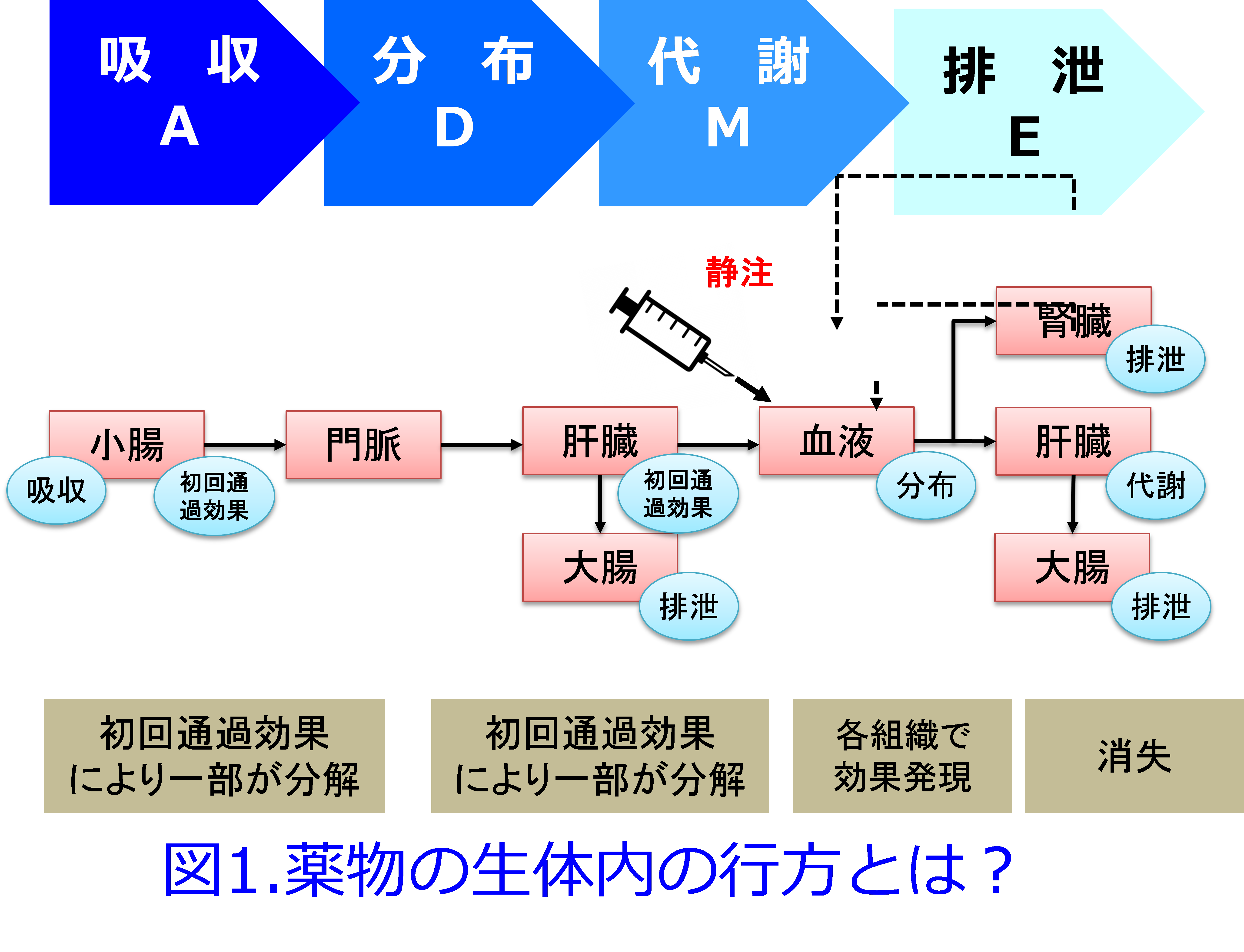
薬物投与設計に薬物動態学の知識が必要なことは言うまでもない。主に腎から活性体として排泄される薬物は腎機能低下患者では減量が必要であるし、主に肝で代謝される薬物、あるいは胆汁排泄される薬物は腎機能低下患者でも特殊な例外を除いて減量の必要はない。しかし現在、使用されている医薬品数は1病院あたり1000~1500品目以上にのぼると言われている。それらの薬物動態的特徴をすべて記憶するのは困難であるが、ADME*のポイントさえつかめば薬物動態はわかりやすく、腎機能低下患者の投与設計に非常に役に立つ(図1)。
たとえば降圧薬のうち、Ca拮抗薬、α遮断薬、アンジオテンシン受容体拮抗薬(ARB)、血管拡張薬などは多くが肝で消失する薬物であり腎機能低下患者では減量する必要はない(表1)。一方、ACE阻害薬のほとんどは水溶性薬物であり、利尿薬も腎排泄性のものが多いが、その薬理学的特性から腎不全患者でも減量する必要のないものが多い(表1)。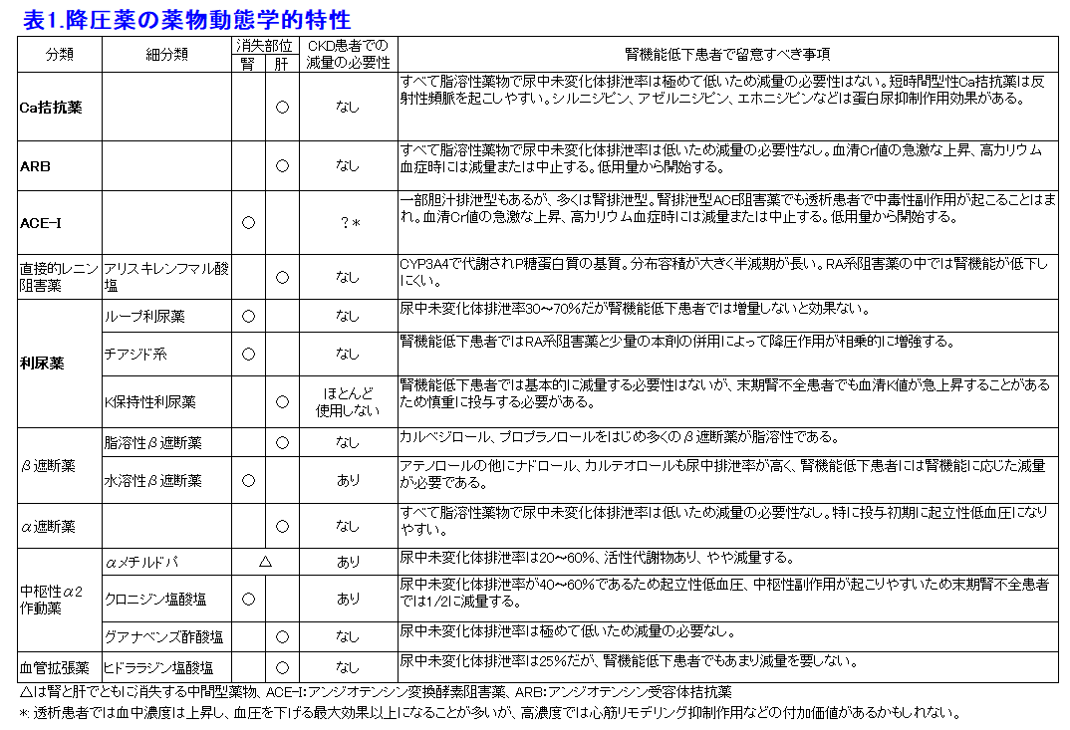
今回の連載の本題となるβ遮断薬は水溶性のものから脂溶性のものまで幅広く存在し、その薬物動態学的特徴は大きく異なる。
医学部や薬学部の学生達に「プロプラノロール(インデラル®)とアテノロール(テノーミン®)の違いを知っているだけ言って下さい」という質問をするとほとんどの人が「アテノロールにはβ1選択性がありますが、プロプラノロールには選択性がありません」と答え、その後は、「内因性交感神経興奮作用はどうだったっけ? 」「膜安定化作用は・・・?」という答え以外には、ほとんど言葉が出てこない。出てきた答えのほとんどはこのような狭義の薬理学(薬物作用学)的なことに終始する。β1選択性については選択性のないプロプラノロールを喘息患者に投与して、喘息発作を起こしてしまうと気管支が収縮して呼吸困難になって死亡することがあるから絶対に知っておかなくてはならない。だけど膜安定化作用や内因性交感神経興奮作用は通常、臨床的にあまり重要な意味を持たないから知っておく必要はあるのだろうか。
確かに薬理学の知識は非常に大切である。しかし医師が投与設計し薬剤師が処方監査するときに、この病態にはこの量でいいのか?どのような投与間隔にすればよいのか?と考えるが、その時に薬理学の知識はほとんど役に立たず、薬物動態学の知識が必要となる(図1)。「薬物動態って難しくって・・・。」などと言わずにトライしてみよう。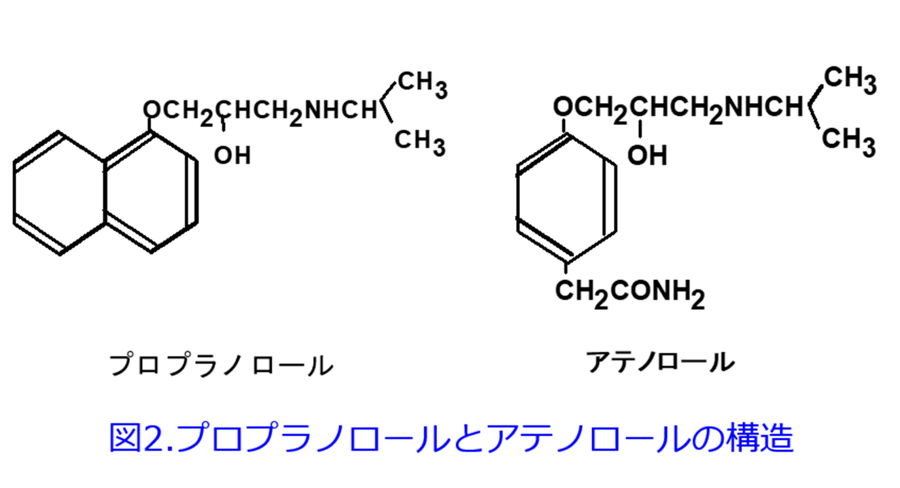
図2の2つのβ遮断薬の構造を比較すれば薬剤師であれば容易にプロプラノロールの方がアテノロールに比べて脂っぽい構造をしているなと気づくであろう。また表2にはβ遮断薬の脂溶性と水溶性の程度を示しており、その程度はn-オクタノール/水分配係数*2という値で示される。表2を見ればβ遮断薬の中でアテノロールが最も水溶性が高く、プロプラノロールはカルベジロールに次いで脂溶性が高いことが分かる。プロプラノロールとアテノロールは同じβ遮断薬でありながら物理化学的性質(物性)は全く異なり、差別化のポイントはプロプラノロールは脂溶性薬物であり、アテノロールは水溶性薬物であるという違いである。薬物のn-オクタノール/水分配係数はインタビューフォームの「有効成分に関する報告」のところに載っているが、この係数の数値を見て値が大きい、つまり脂溶性が高いほど、プロプラノロールの薬物動態に、そして数値が小さい、つまり水溶性が高いほど、アテノロールの薬物動態に近くなると考えてみるとわかりやすい。
*1)ADME:筆者はアドメと呼んでいる。A: 吸収absorption D: 分布distribution M: 代謝metabolism E: 排泄excretionの略。つまりこの4つを知ると薬物動態はほぼ理解できる(図1)。本来ならば吸収・分布・代謝・排泄の順であるが、吸収された薬物は門脈という太い静脈を通って肝臓に行き、あるものは初回通過効果を受けてから組織に分布し肝臓や腎臓を通って消失するため、筆者は図ではあえて吸収・代謝・分布・排泄の順にした。
*2)n-オクタノール/水分配係数:薬物の脂溶性・水溶性を表す物理化学的パラメータで、数値が大きくなると脂溶性が高くなる。o/w係数と略すが、Oil/Waterと理解すると覚えやすいし、わかりやすい。メーカーによってn-オクタノール/水分配係数, pH7.4の代わりにpH7.0になったり、オクタノールの代わりにクロロホルムなどの脂溶性の溶媒を使ったりすることもある。この係数の大きい脂溶性薬物は肝で代謝を受けやすく、組織に広く分布し、血液・脳関門も通過しやすい。また、透析で除去されにくいなどの特徴を有する。逆に係数が小さいと水溶性が高く、肝での代謝を受けにくく、腎で排泄されやすい。そのため腎機能低下患者では係数の小さい水溶性薬物は蓄積しやすいが、透析で除去されやすい1)。
引用文献
1. 平田純生, 他: 血液透析による薬物除去率に影響する要因. 透析会誌37: 1893-1900, 2004.
「今日はここまで、それではまた次回お楽しみに!」
◆連載◆薬物動態学 1限目
1限目:導入講義 薬剤師の存在価値はどこにある?
今回の要約
①薬物動態の考え方は薬剤師にとって大きな武器になる。これが医師との違い、薬剤師のアイデンティティといって過言ではない!
②だけど難解な薬物動態学の理論を理解しなくちゃいけないと思うと憂鬱になる。薬のそれぞれの性質・特徴を知ること、つまり「薬への興味」が薬物動態の習得につながると考えると楽しくなる。
「薬剤師なんて要らない?なんで要らないの?薬剤師は絶対に必要なんだよ!だって処方箋を書く医師は薬物動態や相互作用を知らないんだよ。だから患者さんが使っている薬の有効性・安全性を担保するために薬剤師が監査し、疑義紹介しなければならないんだ。多くの患者さんが薬物療法によって病気を治療している。薬剤師は患者さんの薬の安全性を守る最後の砦なんだ。」これはアレクサングシンデレラの前から言っており、熊本大学薬学部で繰り返し学生たちに話してきたことです。でも「薬物動態学」の大好きな薬剤師やそれにかかわる計算式を得意とする薬剤師はあまり多くないのが実態ではないだろうか。実際、処方箋監査をするのに「薬物動態学の知識って必要?」と思っている薬剤師も多いのではないだろうか?
「薬剤師は薬の専門家」、幅広い薬の知識を持っているのは薬剤師自身も薬剤師以外も自覚していることではないだろうか?この薬の特性、この薬の性質は何で表されるの?たとえば「どれくらいたてば効き始めてどれくらい効果が持続するの?」「体の中に薬が溜まり続けて害になることはないの?」「いつ飲んだら一番効果的?」「同じ成分なのに飲み薬と注射薬と投与量が同じこともあるし、飲み薬の方が注射薬よりもうんと量が多いことけど副作用は心配ないの?」「同じ量をのんでも人によって副作用が起きたり、効かなかったりすることがあるのはなぜ?」これは薬剤師にとってはおそらく容易に答えられる質問内容だが、医師には少し難しいかもしれない。
具体的には「バンコマイシンは健常者では1日1000mg投与するけど透析患者ではどれくらいに減量すればいいの?」「フェニトインの原末で投与量を間違えて死亡したり、テオフィリンの相互作用で死亡したケースがあるのはなんでなんだろう?」「アミオダロンは投与をやめても数か月間血中濃度が測定できるのはなぜ?ほかの薬とどう違うの?」「ワルファリンのタンパク結合率が下がると大出血するの?」「ACE阻害薬は腎排泄性、Ca拮抗薬やARBは肝代謝されるけど(つまり透析患者でも減量の必要がない)、「アテノロールやプロカテロール、ナドロールは透析患者で減量しなくてはならないけれど、同じβ遮断薬なのにカルベジロールやプロプラノロールは減量する必要はないのはなぜ?」などの質問は薬剤師だったら知っておくべきなのに、知らない人もいるかもしれない。知らない人こそ、これを読んでほしい。
ADMEのパラメータを覚えずに理解する方法
~コツは少ない水溶性薬物(腎排泄型薬物)を覚える~
アドメってご存知ですよね。ADME、つまり薬がどのように吸収され、どのように生体内に分布し、どのように代謝されて、どのように排泄されるのか(図1)?これ
 は薬の特性そのものなんだ。具体的な薬物動態パラメータ*1としてはバイオアベイラビリティ(F)、クリアランス(CL)、分布容積(Vd)、尿中未変化体排泄率(fe)、蛋白結合率(PBR)、消失半減期(t1/2β)、消失に関わる代謝酵素・トランスポータの基質になるか、他剤の阻害や誘導をするか。これらを使いこなせる薬剤師は上記の患者さんや医療スタッフのどのような質問にも、分かりやすく理論的に説明できるだけではなく、薬の血中濃度を自由自在に操り、コントロールすることができるのだ。その分かりやすさがアドヒアランスの向上、つまり薬を正しく使うこと、そして適正使用、有効かつ安全な薬物療法の提供につながる。そしてそれらができるのはこれらの基礎的概念を知っている薬剤師に他ならないのだ。汎用されている薬物は1500~2000くらいある。1種の薬物につき7~8のパラメータを覚えるとなると1万以上の数値を記憶する必要があるが、暗記なんて出来っこない。これからは理論的に理解していこう。キーワードは水溶性か脂溶性だ。言い換えれば腎排泄型薬物か肝代謝型薬物かを知っておけば、だいたいADMEに関わるパラメータが予測できる。そしてすべての薬物のうち腎排泄は2~3割しかない(図2)。
は薬の特性そのものなんだ。具体的な薬物動態パラメータ*1としてはバイオアベイラビリティ(F)、クリアランス(CL)、分布容積(Vd)、尿中未変化体排泄率(fe)、蛋白結合率(PBR)、消失半減期(t1/2β)、消失に関わる代謝酵素・トランスポータの基質になるか、他剤の阻害や誘導をするか。これらを使いこなせる薬剤師は上記の患者さんや医療スタッフのどのような質問にも、分かりやすく理論的に説明できるだけではなく、薬の血中濃度を自由自在に操り、コントロールすることができるのだ。その分かりやすさがアドヒアランスの向上、つまり薬を正しく使うこと、そして適正使用、有効かつ安全な薬物療法の提供につながる。そしてそれらができるのはこれらの基礎的概念を知っている薬剤師に他ならないのだ。汎用されている薬物は1500~2000くらいある。1種の薬物につき7~8のパラメータを覚えるとなると1万以上の数値を記憶する必要があるが、暗記なんて出来っこない。これからは理論的に理解していこう。キーワードは水溶性か脂溶性だ。言い換えれば腎排泄型薬物か肝代謝型薬物かを知っておけば、だいたいADMEに関わるパラメータが予測できる。そしてすべての薬物のうち腎排泄は2~3割しかない(図2)。 少ない方が覚えやすいので、腎排泄型薬物を覚えれば、残りは肝代謝型薬物だ。150種くらいある抗菌薬のうち、殺菌性抗菌薬はほぼ腎排泄型*2と覚えて間違いない(表)。
少ない方が覚えやすいので、腎排泄型薬物を覚えれば、残りは肝代謝型薬物だ。150種くらいある抗菌薬のうち、殺菌性抗菌薬はほぼ腎排泄型*2と覚えて間違いない(表)。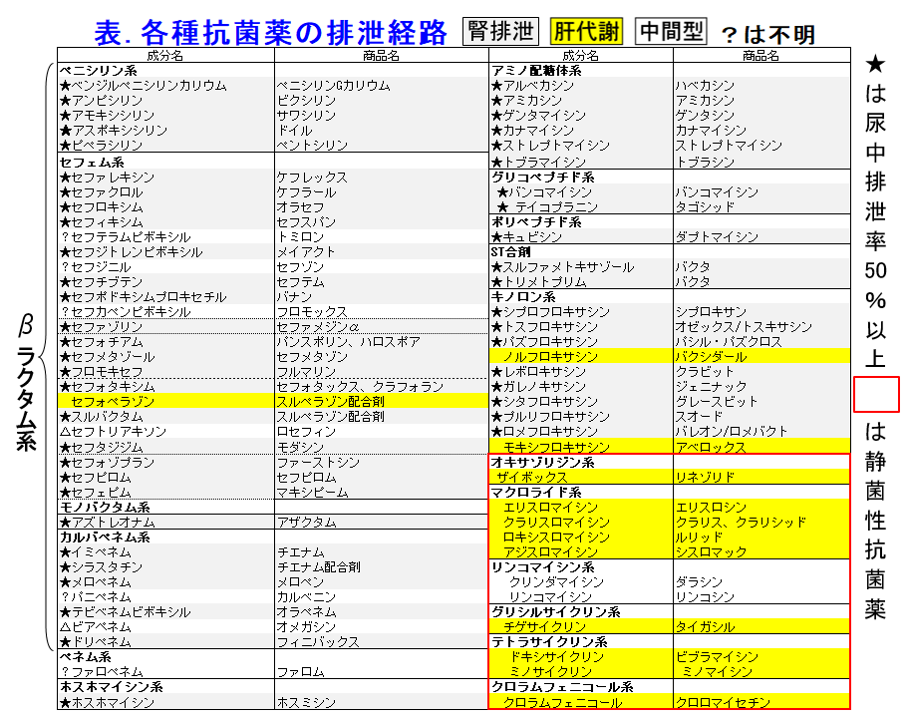 しかもこれでだけで腎排泄型薬物のうち約100種類以上を占める。となると抗菌薬以外で腎排泄型薬物の数は残りはわずかだ。例外だけ覚えればいいんだ。楽だ。そしてそれらの性質はよく似ていることをこれから実証しよう。では始めよう。
しかもこれでだけで腎排泄型薬物のうち約100種類以上を占める。となると抗菌薬以外で腎排泄型薬物の数は残りはわずかだ。例外だけ覚えればいいんだ。楽だ。そしてそれらの性質はよく似ていることをこれから実証しよう。では始めよう。
*1)薬物動態パラメータ:日本腎臓病薬物療法学会では1年に4冊の学会誌(うち1冊はは学術大会要旨集)を発行し、そのうち3冊には約2000の薬物の1/6にあたる300前後の最新の薬効別薬物の腎機能別用量に加え、クリアランス(CL)、分布容積(Vd)、尿中未変化体排泄率(fe)、バイオアベイラビリティ(F)、蛋白結合率(PBR)、半減期(t1/2β)、消失に関わる代謝酵素・トランスポータの基質になるか、他剤の阻害や誘導をするか、特記事項などの情報が載っている。さらに2年に1回、すべての約2000薬物の全情報が掲載されたグリーンブックを発行している。2020年度版は3月にすでに発行されたが、この学会の会計年度は8月末であるため、2020年8月末までに入会すれば、2019年9月以降に発刊された学会誌とともに、グリーンブックが送られる。また2020年6月発売予定のじほうの「腎機能別薬剤投与量POCKETBOOK 第3版(税込3960円)」も2020年8月末までに会員になれば無料配布される。
*2: 殺菌性抗菌薬はほぼ腎排泄型:理由をうまく説明できないので、単なる偶然かもしれないが、殺菌性(菌量を減らす抗菌薬)の抗菌薬はほぼ腎排泄性と思って間違いない。この場合、数の少ない脂溶性抗菌薬であるマクロライド系、テトラサイクリン系、オキサゾリジノン系、リンコマイシン系、グリシルサイクリン系、それにクロラムフェニコールなどは脂溶性抗菌薬で静菌性抗菌薬(細菌数を減らすのではなく増殖を止める)であると覚えよう。それに対しβラクタム系、アミノグリコシド系は細胞外液のみにしか分布しない水溶性薬物であるし、バンコマイシンは尿中排泄率90%で透析患者には腎機能正常者の1/5以下に減量が必要な水溶性で腎排泄性の抗菌薬。ダプトマイシンもそうだ。ただし殺菌性抗菌薬の中でもキノロン系は日本ではレボフロキサシンの1人勝ち状態なので、腎排泄と思われがちだが、ノルフロキサシンや欧米では評価の高いモキシフロキサシンは腎機能低下患者でも減量の必要がない。静菌性の中ではST合剤が例外的に腎排泄だ。キノロン系は脂溶性薬物の特徴である組織移行性が高いため、レジオネラやクラミジアなどの細胞内寄生菌にも効果がある。もちろんVdも大きい。表の中に青色ではなく白や黄色のβラクタムがあるがこれらは物性は水溶性だが、たまたま蛋白結合率が高いセフォペラゾンとセフトリアキソン、そして吸収率が分からないため腎排泄かどうかさえ微妙なピボキシル基のついた経口第3世代セフェムなどばかりである。重症感染症では殺菌性抗菌薬は静菌性抗菌薬よりも優先される。ということはよく効く抗菌薬は腎機能に応じた減量が必要なのだが、βラクタム系抗菌薬の安全性は高く、怖いのはアレルギー性副作用なので初回投与量は減量せずしっかりと初濃度を上げて、速やかな効果が期待できるような投与設計をしよう。
「今日はここまで、それではまた次回お楽しみに!」

