◆連載◆薬物動態学 6限目
6限目:クリアランス、半減期を理解できれば投与量・投与間隔の設定ができる!
今回の要約:
①水溶性薬物は腎不全患者で減量が必要である。
②腎機能は加齢とともに低下する。
③脂溶性薬物は肝不全患者では減量・投与間隔の延長が必要であろうが、減量指標となる検査値はないので、血中濃度を測定しないと投与設計できない?
腎の糸球体濾過量GFR*1は70〜130mL/minが正常値で、アテノロールの全身クリアランス(肝での代謝は無視できるためほぼ腎クリアランス=全身クリアランスと考えて良い)が80mL/minということは、アテノロールでは腎臓の糸球体を血液が1回通過しただけで、8割近くが排泄されることを意味する。水溶性が高いアテノロールは尿細管で再吸収されることもない。全身クリアランスと腎クリアランスがほぼ等しいため、腎障害者ではアテノロールのクリアランスは低下し、t1/2が延長するため、投与量を減量するか、投与間隔を延長することが必要になる。n-オクタノール/水分配係数ではセリプロロールやメトプロロールよりも大きいものの、尿細管分泌されやすいため尿中排泄率の高いカルテオロール(ミケラン®)やナドロール(ナディック®)もアテノロールと同様に、腎不全患者では同様に減量の必要がある。
一方、肝臓の血流量は1,100〜1,800mL/min(この70〜75%は門脈血で、25〜30%が肝動脈血)で、プロプラノロールの全身クリアランス*2は800mL/minである。プロプラノロールの腎からの排泄はほとんど無視できるため、プロプラノロールの全身クリアランス=肝クリアランスと考えてよい。だから、血液が肝臓を通るごとに血中のプロプラノロール濃度は低下する。重度の肝障害や肝硬変では半減期(t1/2)*3が延長するため与間隔の延長が必要になる。肝血流律速型薬物*4であるプロプラノロールのCmaxやAUCは著明に上昇するため、投与量の減量が必要になる。腎不全患者ではプロプラノロールの投与量を減量する必要はないと思われるが、腎不全患者では初回通過効果による肝代謝が低下するため、バイオアベイラビリティ(F)が上昇するという報告1)もある。近年の報告では小腸の吸収速度が低下するという説も提示されている2)が、腎不全でなぜこのような変化が起こるのかについては明らかにされていない。透析患者にプロプラノロールの内服薬を投与する時には多少の減量は必要かもしれないが、初回通過効果を受けない注射薬では減量の必要はない。
とこのように述べたが、ではどうやって減量するかについては腎排泄型薬物はGFRまたはクレアチニンクリアランス(CCr)に応じた投与設計が可能である。実測するGFRやCCrを実測するのは蓄尿が必要で手間暇もかかるため、通常は血清クレアチニン値*5を測定し、その値によって推算GFR(eGFR)または推算CCrを腎機能として投与設計をしている。しかし肝代謝型薬物にはこのような肝の代謝機能を表す適切な検査値がない。ASTやALTは肝細胞障害を表す検査値であるし、γ-GTP、血清ビリルビンなども代謝機能とは相関しない。腎機能は慢性糸球体腎炎や糖尿病性腎症、高血圧などによって徐々に低下するとともに、このような原疾患のない人でも加齢とともに低下する。つまり高齢者は慢性腎臓病(CKD)であると、疑ってみるべきだ。これに対し、お酒に強い人は高齢者になっても、若いころから全く飲めない人よりもエタノールを代謝する能力が強い。肝機能も加齢によって低下するが、代謝機能は今まで述べてきたように遺伝的な個人差の方が大きい。だったら全員遺伝子を調べてから薬物を投与すれば投与設計はよりやりやすくなるだろうと思いますよね。だけどワルファリンの主な代謝酵素はCYP2C9で、薬効の指標となるビタミン K エポキシド還元酵素複合体 1(VKORC1: vitamin K epoxide reductase complex 1)の遺伝子が分かれば薬物動態PKも薬物動力学PDもわかっているので完璧になったかというと、そうではない。いまだに凝固しやすさの指標であるPT-INRを測定せざるを得ない3)。だから肝代謝型の薬物の投与設計は難しい!テーラーメイド医療は確かにより有効かつ安全な投与設計に貢献するだろうが、筆者はTDMが不要になる時代はまだまだやってこないように思う。
プロプラノロールの全身クリアランス(ほぼ肝クリアランス)は800mL/min、アテノロールの全身クリアランス(ほぼ腎クリアランス)は80mL/minで、両者の間には10倍の開きがあるため、プロプラノロールの消失は10倍速いと思われがちだが、t1/2はプロプラノロールで3.8時間、アテノロールで6時間で2倍足らずである。これはプロプラノロールの分布容積が約4L/kgと大きいため、血中濃度は低く、肝ではその低濃度の血液を毎分1000mL以上取り込んで、そのうち800mL分の血液中のプロプラノロールを完全に代謝して血中から消失させていることを意味している。
またアテノロールの場合、分布容積が比較的小さいため、血中濃度は高く、腎の糸球体ではやや高濃度の血漿を毎分、100〜120mL糸球体で濾過して、そのうち80mL分の血液中のアテノロールを完全に排泄して消失させていることになる。このことは血中消失半減期とクリアランスの関係から理解できる。つまりt1/2=ln2/Kel=0.693×Vd/CLで表されるため、薬物の分布容積(Vd)が大きくなれば半減期は延長し、クリアランス(CL)が大きくなれば半減期は短縮する。GFRの正常値はほぼ100mL/minであるため、一度腎を通過しただけで完全に消失する薬物のクリアランスは100mL/minとなり、尿細管からの薬物の分泌がない限り、腎のみで消失する薬物のクリアランスが100mL/minを越えることはあり得ないが、尿細管分泌される薬物は結構ある。
例えばβラクタム系抗菌薬はほぼ腎排泄と考えれば、CL=(ln2×10L)/1hr=115mL/min>GFRとなるので、半減期1hr未満のものは糸球体濾過だけでなく尿細管分泌されていると考えられる。βラクタム系抗菌薬であればVdはそんなに違わない。セフトリアキソンの蛋白結合率が90%と高いため、アルブミンにトラップされ間質液に移行しにくいので、血中濃度が比較的高くなるため0.2L/kg以下になるのが例外的なものだろうが大きな差ではない。しかしセフトリアキソンは半減期が7~9hrと非常に長いため、外来で投与できる唯一のβラクタムといってもよいだろう。Vdが少し小さいだけなのに半減期がうんと長くなるのはなぜなんだろう?これはセフトリアキソンの水溶性が高いためもともと腎排泄だけど、たまたま蛋白結合率が90%と高いため、糸球体濾過されるクリアランスが非常に小さいためと考えられる。
でも尿細管分泌されるβラクタムの半減期はとても短い。古い薬だけど感染性心内膜炎や梅毒に今でも有効なベンジルペニシリン(ペニシリンG)の半減期は30分。時間依存性だから1日6回点滴することもある。クリアランスは1,024mL/minと肝血流依存性薬物と疑いたくなるが、おそらく尿細管分泌のクリアランスが高いのだろう。そしてペニシリン系、カルバペネム系の多くの半減期が1hr前後と短いので、糸球体濾過されるだけではなく尿細管から分泌されることによって腎クリアランスが100mL/minを超えているためと考えられる。
最後にβ遮断薬の怖いところは気管支収縮による喘息症状の悪化だけでなく、低血糖を起こしやすいことも挙げられる。β遮断薬を併用していて、投与量を間違えると非常に怖い薬にはシベンゾリンというⅠa群の抗不整脈薬がある。シベンゾリンによる低血糖はSU薬のように膵臓β細胞を刺激してインスリン分泌を促し、その作用は血中濃度依存性であるため400ng/mL以下では低血糖は起こらないが、シベンゾリンの有効治療域(200〜800ng/mL)と非常に近いので怖い。しかもβ遮断薬と同じくCYP2D6の基質でもある。さらにシベンゾリンの難儀なところは、腎排泄性であるにもかかわらず、分布容積が6.8L/kgと大きい(組織移行性が高い)ため、いかなる血液浄化法でも全く除去できないこと。筆者は血液透析では2L/kg以上の分布容積の薬物は除去不可能という論文を書いている。シベンゾリンによる低血糖やQT延長が高齢者で起こりやすいので高齢者で心停止症例が2名起こったため、メーカーから「適正使用のお願い」が出た。その中には①腎障害の程度により投与量を減じること、②高齢者では、少量(たとえば1日150mg )から開始すること、③本剤の投与中は臨床検査を定期的に行い必要に応じて適宜血中濃度を測定すること と書かれていたのはなぜだろう?もちろん、前述のように未変化体尿中排泄率55~62%の腎排泄性薬物であることやVdが大きいため血液浄化によって救命できないこと、高齢者は腎機能が低下すること、以外にもこの薬が「非線形の薬物動態」をとることも一因として考えられるのではないかと思う。ここで、非線形薬物動態を示す薬物を紹介する(表)。 フェニトインが非常に有名だが(図1)、現在は散剤としては10%散しかないが、20年くらい前には原末が販売さされており、誤調剤によって死亡例が出たため、原末が製造中止になった経緯がある。テオフィリンにシメチジンが併用されても皆さんが疑義紹介しないと思うが、併用することによって死亡した症例が報告されている4)。これは論文中には考察されていないが、医師がテオフィリンの嘔気をテオフィリンの中毒症状ではなく胃障害の悪化と思ってシメチジンの増量を行ったためにテオフィリンが非線形の血中濃度の上昇を示して死に至ったと筆者は解釈している。薬剤師ならこれらの非線形薬物動態を示す薬物はすべて記憶してほしい。ここでは話がややこしくなるのでミカエリス-メンテン式の話はやめておこう。Km と Dmax を決定するには異なる2つの投与量における定常状態での血中濃度が必要だが、実臨床ではこのようにして投与設計をすることはまずないからだ。
フェニトインが非常に有名だが(図1)、現在は散剤としては10%散しかないが、20年くらい前には原末が販売さされており、誤調剤によって死亡例が出たため、原末が製造中止になった経緯がある。テオフィリンにシメチジンが併用されても皆さんが疑義紹介しないと思うが、併用することによって死亡した症例が報告されている4)。これは論文中には考察されていないが、医師がテオフィリンの嘔気をテオフィリンの中毒症状ではなく胃障害の悪化と思ってシメチジンの増量を行ったためにテオフィリンが非線形の血中濃度の上昇を示して死に至ったと筆者は解釈している。薬剤師ならこれらの非線形薬物動態を示す薬物はすべて記憶してほしい。ここでは話がややこしくなるのでミカエリス-メンテン式の話はやめておこう。Km と Dmax を決定するには異なる2つの投与量における定常状態での血中濃度が必要だが、実臨床ではこのようにして投与設計をすることはまずないからだ。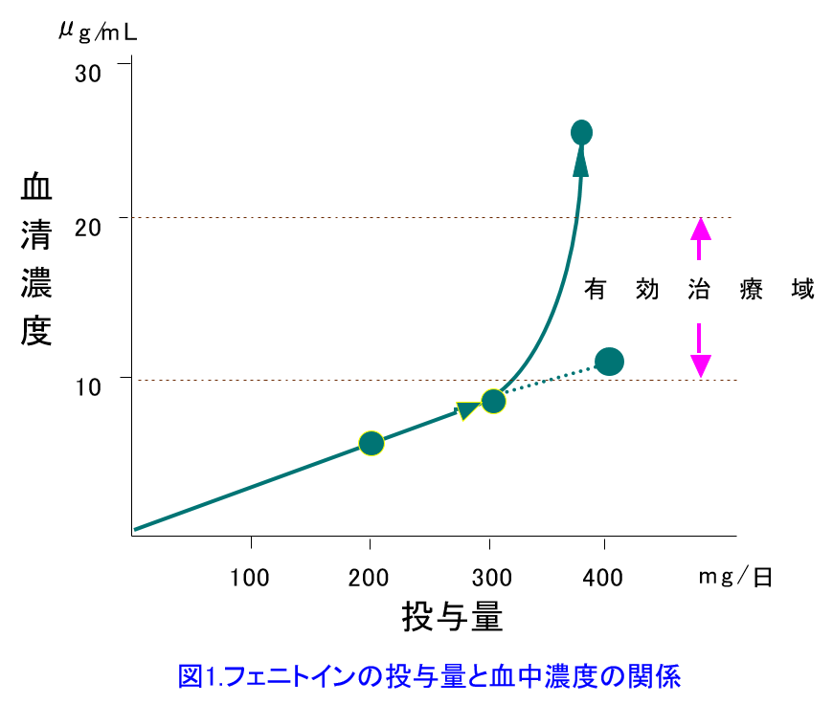
*1)糸球体濾過量(GFR: glomerular filtration rate):糸球体から単位時間に、どれだけの濾液が濾過されるかを表すもの。糸球体で完全に濾過されて、尿細管では再吸収もされない生体内物質のクレアチニンを用いた推算GFR(eGFR)、あるいはクレアチニンクリアランスが腎機能の検査として一般的にGFRの代用として用いられる。
*2)クリアランス(CL):薬物の除去能力を示すパラメータ。単位時間あたりの体内から薬物が減少していく速度の薬物血中濃度に対する割合。一般にクリアランスは肝クリアランス(肝での薬物の代謝)と腎クリアランス(腎からの薬物の排泄)を加算したものと考えてよい。薬物のクリアランスが腎からの排泄によるものが主である場合(ファモチジンやアシクロビル、イミペネムなど)には、腎不全患者では蓄積しやすいため思わぬ副作用が現れることがある。
*3)半減期(t1/2):正確には血中消失半減期と言い、通常は消失相における半減期t1/2βを表す。ある薬物の濃度が1/2に減少するまでに要する時間。つまり体内から薬物が排泄される速度の目安となり、半減期が長いと薬効が延長し、中毒性副作用が生じた時には副作用も長く続くことを意味する。本来なら尿中へ排泄される薬物は、腎不全では体内に蓄積し、薬物の半減期が延長する。そのため腎機能低下患者を扱う施設(高齢者は腎機能が低下するためほぼすべての施設)では有用な薬物動態パラメータとなる。経口投与した薬物は指数関数的に体内から排泄されるためt1/2の4倍の時間をかければ投与された薬物の約94%は排泄されてしまう(図2)。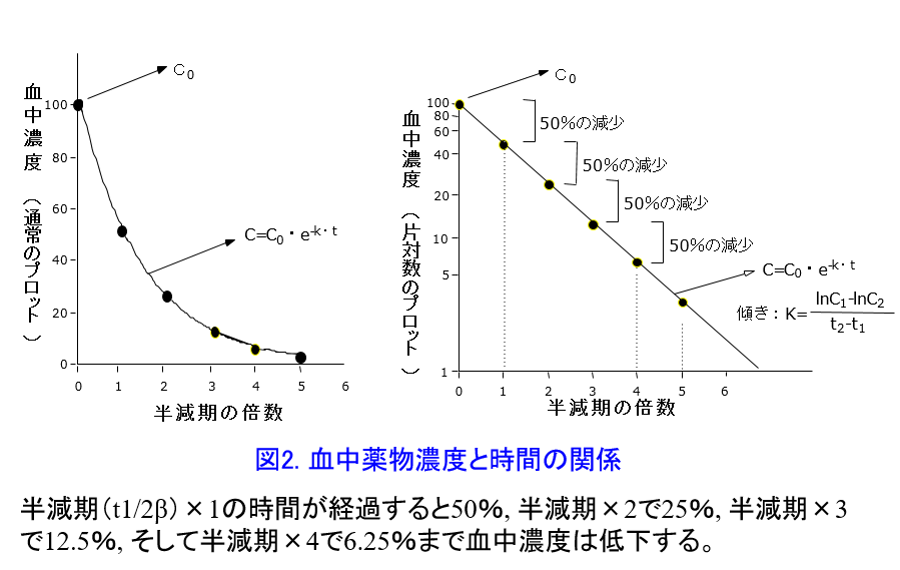 また、t1/2βは反復投与時の定常状態濃度に到達する時間を知ることもできる(図3)。 一方、t1/2αは分布相における半減期であり、t1/2βに比べ安定したデータが得られるとは限らないし実臨床で使われることはまずない
また、t1/2βは反復投与時の定常状態濃度に到達する時間を知ることもできる(図3)。 一方、t1/2αは分布相における半減期であり、t1/2βに比べ安定したデータが得られるとは限らないし実臨床で使われることはまずない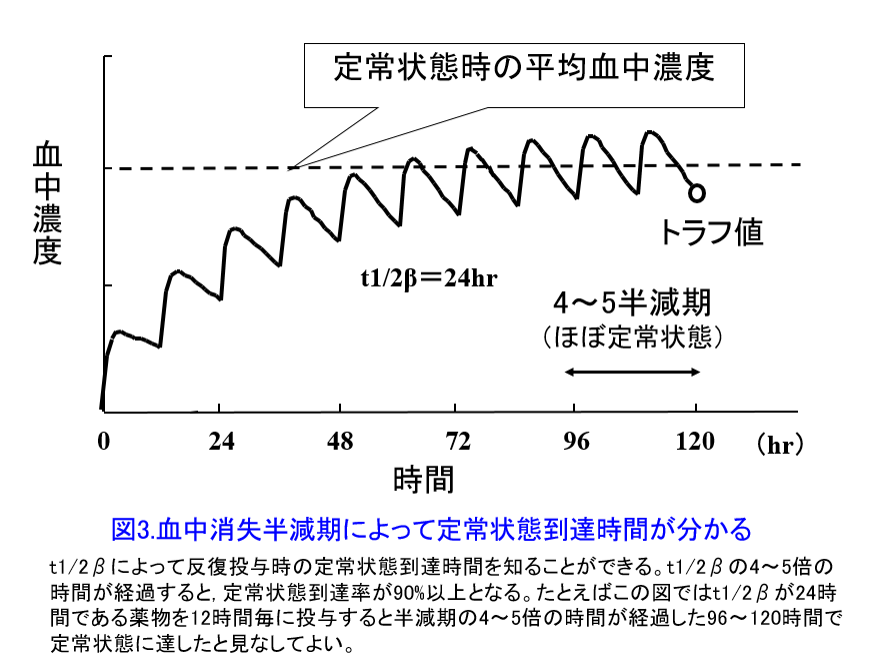
*4)肝血流律速型薬物:薬物の血漿クリアランスが肝血流量に近い薬物のことで、肝障害時には肝実質細胞量が減少し、門脈圧亢進によって肝外シャント(これにより食道静脈瘤などが発現する)が形成され、消化管から肝に至る門脈血が肝臓を経ずに体循環に入る。肝血流律速型薬物では経口投与後の肝初回通過効果が著明に低下するため、経口投与後のCmaxが著明上昇し、健常者の数倍に上昇することも珍しくない。肝血流律速薬物の特徴は肝初回通過効果を受けやすいので、バイオアベイラビリティが低く、肝障害ではCmaxとAUCは著明に増加するが半減期はあまり変化しない。肝血流律速薬物には脂溶性β遮断薬の他にCa拮抗薬、ニトログリセリン、プラゾシン、ジルチアゼム、モルヒネ、ペンタゾシン、アスピリン、アセトアミノフェン、スピロノラクトン、三環系抗うつ薬、リドカインなどがある。
*5)血清クレアチニン値:クレアチニンは全く蛋白結合せず、糸球体で100%濾過され、尿細管で再吸収されないまま尿中に排泄されるため、優れた腎機能マーカーになるがわずかに尿細管分泌される。濾過されたクレアチニン量=尿中に排泄されたクレアチニン量になるため 血漿Cr濃度×GFR =尿中Cr濃度×尿量/日で表される。CCrは時間あたりに濾過される原尿の産生速度(限外濾過された濾液量)に尿細管分泌される20~30%を加えた値になるため、腎機能正常者のCCrはCCr = GFR+20~30mL/min=120~130mL/minになる。血清クレアチニンは生体内の筋肉のクレアチンの最終代謝産物であるため、筋肉量の少ない高齢者ではeGFRは過大評価されやすいことも覚えておこう。
引用文献
1)Bonde J., et al.: Atenolol inhibits the elimination of disopyramide., Eur J Clin Pharmacol 28: 41-43, 1985
2)Bianchetti G, et al: Pharmacokinetics and effects of propranorol in terminal uraemic patients and in patients undergoing regular dialysis treatment. Clin Pharmacokinet 1: 373-384, 1976.
3)Pirmohamed M, et al.; EU-PACT Group. A randomized trial of genotype-guided dosing of warfarin. N Engl J Med 369: 2294-2303, 2013
4)Anderson JR, Poklis A, Slavin RG: A fatal case of theophylline intoxication. Arch Intern Med, 143: 559-560, 1983
「今日はここまで、それではまた次回お楽しみに!」

