第16回 基礎から学ぶ薬剤師塾 Q&A
第 16回 基礎から学ぶ薬剤師塾 Q&A
物性から薬物動態を理解してみよう
~「動態=薬の顔・特徴」だと思えば難しくない~
チャットによる質問
①今井病院 粕谷美枝子先生
Q.薬物動態学が本当に苦手で大嫌いでしたが、平田先生のご講演を拝聴するたびに、その重要性を痛感しています。基本から勉強し直するためにお薦めの【薬物動態学】の参考書をお教え頂ければ幸いです。
A.僕も薬物動態学はむつかしい、特に難解な式を理解できないし、2-コンパートメントモデルなんて実臨床に本当に必要なの?と思っていました。薬物動態を身近にしてくれたのは現どんぐり工房の菅野彊先生が1998年に書かれた「わかる臨床薬物動態が理論の応用」という医薬ジャーナルの本でした。とても分かりやすい解説とかわいいイラストが薬物動態学のハードルを下げてくれました。僕にとっては革命的な本でした。ただし残念ながらこの医薬ジャーナル社は負債を抱えて事業停止になりましたので、この本は廃版になっていますが中古が手に入るかもしれません。
菅野彊先生はその後、「薬剤師のための『添付文書の読み方10の鉄則』改訂第3版( アドバンスクリエイト株式会社)」や「薬物動態を推理する55Question(南江堂)」を書かれていますし、どんぐり工房のお弟子さんの佐藤ユリ先生が「どんぐり未来塾の薬物動態マスター術 第2版(じほう)」を著されています。慶応義塾大学薬学部の大谷壽一先生の「マンガでわかる薬物動態学」を僕は読んだことがないのですが、大谷先生(九大大学院の時の僕のメンターです)の薬物動態学の講演はとても分かりやすく、濃い内容だったのできっと素晴らしい内容だと思います。これらの本をじっくり読んでいただけると薬物動態学を好きになるかもしれません。 それと僕の場合、このような入門書で、ある程度、薬物動態が理解できるようになったら、いわゆる大学で使っている教科書の加藤隆一先生の「臨床薬物動態学(改訂第5版): 臨床薬理学・薬物療法の基礎として」、緒方宏泰先生の「第4版 臨床薬物動態学: 薬物治療の適正化のために」「ウィンターの臨床薬物動態学の基礎―投与設計の考え方と臨床に役立つ実践法」などの教科書を3冊以上を読んで薬物動態理論を補強しました。よく売れているシリーズの「薬がみえる」vol.4は薬物動態学だけでなく薬力学や相互作用もかなり詳しく、そして分かりやすく解説されていますので、若い皆さんにはこれが一番かもしれません。
理解できないようなむつかしい数式を理解することはあきらめて、読み飛ばしていいのです。だって2-コンパートメントモデルなんて、何度も採血しないといけないので、臨床で使うのは無理があるし、分からないことはどうやっても分からないのだから!でも、これらの複数の教科書を読むと、すでに入門書で理解したことであっても、もっとわかりやすく理解できるようになるヒントが隠されていますし、「これって実臨床に使えそう」、「以前に体験した症例はこれで説明できる!」という薬剤師としての「気づき」が臨床薬剤師としての実力をアップしてくれるのだと思っています。

②たかだ調剤薬局 永石潤先生
Q.アセトアミノフェンのお話がありましたが、胃腸障害の副作用はないと考えてよろしいでしょうか?
A.僕が米国で研修させてもらった大学病院でもがん患者さんに「痛いときに」頓服でアセトアミノフェン650mg錠を6回分/日(3,900mg/日)、痛みのある多くの患者さんに投与されていました。癌性疼痛がきつくなれば服用錠数が徐々に増えるので、服用錠数が痛みのVASスケールの役割をして、0錠から2錠、4錠と増えることを強オピオイドの投与量を増やすマーカーにしていました。また米国の別の病院の小児科ではTPN(total parenteral nutrition)施行時、つまり絶食時の発熱や未熟児の発熱に対しアセトアミノフェンの懸濁液が汎用されていましたが、これは解熱に用いる低用量投与では胃障害が少ないことの裏づけと考えてもよいでしょう。
ただしアセトアミノフェンは用量増加に伴い胃腸障害を起こすことがありうるため、鎮痛用量では空腹時服用は推奨されません。日本ではアセトアミノフェンは添付文書上では解熱目的には1回300~500mg を頓用とし原則として1日2回まで、鎮痛目的には1回300~500mgを4~6時間おきとなっています。
NSAIDsを空腹時に飲むとのたうち回るような強烈な胃障害を起こしますが、OTC薬のタイレノールのパッケージには「空腹時にものめる優しさで、効く」と書いてあるように、NSAIDsに比べると胃障害は格段に弱いのですが、日本の添付文書では解熱用量でも添付文書上は空腹時の投与は避けることが望ましいとなっており、特に用量が多いときには胃障害を起こしやすくなるため、食後に投与すべきだと思っています。
③平成横浜病院 廣瀬里美子先生
Q.体重が多いのは一口に腎不全による浮腫であったり筋肉であったり脂肪太りだったりと色々ですが薬物動態の違いはどう理解すればよいでしょうか。基本的でお恥ずかしいのですがアドバイスお願いします。
A.薬物動態における「体重」の判断は薬用量の設定時にどう判断するか?という質問だと思って回答させていただきます。
筋肉が多い人は病気しにくいのですが、ジゴキシンはNaポンプ阻害薬なのでNa+-K+-ATPaseの豊富にある筋肉には血中濃度の10~20倍、心筋には30~50倍の濃度で分布するため、分布容積が大きくなります(初回負荷投与するとすれば多めに投与する必要があります)。でも患者さんの薬用量はジゴキシンが腎排泄性であるためVdではなく腎機能、つまり腎クリアランスによって決まります。
浮腫であれば間質液が増えていますので、細胞外液のみに分布する親水性薬物(脂質二重層を通って細胞内に移行できない薬物)の投与設計では重要です。アミノグリコシド系抗菌薬やβラクタム系抗菌薬がそのような親水性薬物です。ではアミノグリコシド系抗菌薬に関する例題を解いてみましょう。
例題:通常時の体重が50kgの肝硬変患者がMRSA肺炎に罹患した。本症例は肝硬変による腹水を伴う溢水により体重が65kgに増加している。この患者にアルベカシン(ハベカシン®)の初回投与量の投与設計をどのようにすべきか。アルベカシンの目標ピーク濃度は17µg/mLとし、Vdは0.3L/kgとする。
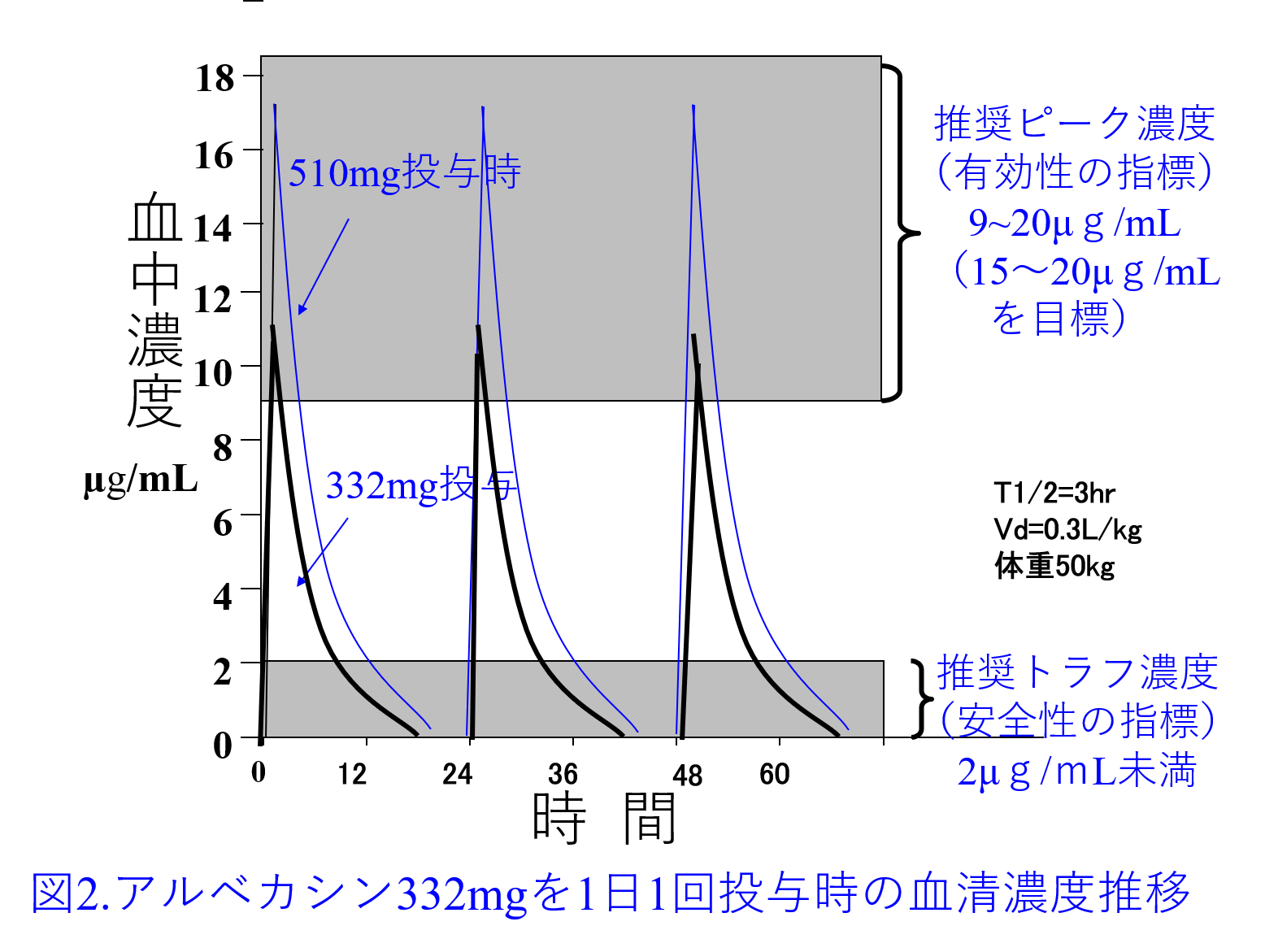
解答:アルベカシンXmgを65kgの患者に投与し17µg/mLを目標ピーク濃度にするとXmg/(0.3L/kg×65kg)=17µg/mLとなり、332mgを投与すると十分なピーク濃度を保てるはず(図1左)。ただし腹水は細胞外液のため、実際には通常体重50kgのVd 15L+腹水15Lが分布容積に近似すると考える。つまり溢水患者のVdは感染症患者のVd(0.3L/kg×50kg)に体重増加量15Lを加算して、Xmg/(0.3L/kg×50kg+15L)=17µg/mLとなり、目標ピーク濃度を17µg/mLにするならば510mgの投与量が必要(図1右、図2)。初回投与量は腎機能による差はありませんが、2日目以降は腎機能に応じた減量または投与間隔の延長が必要になります。
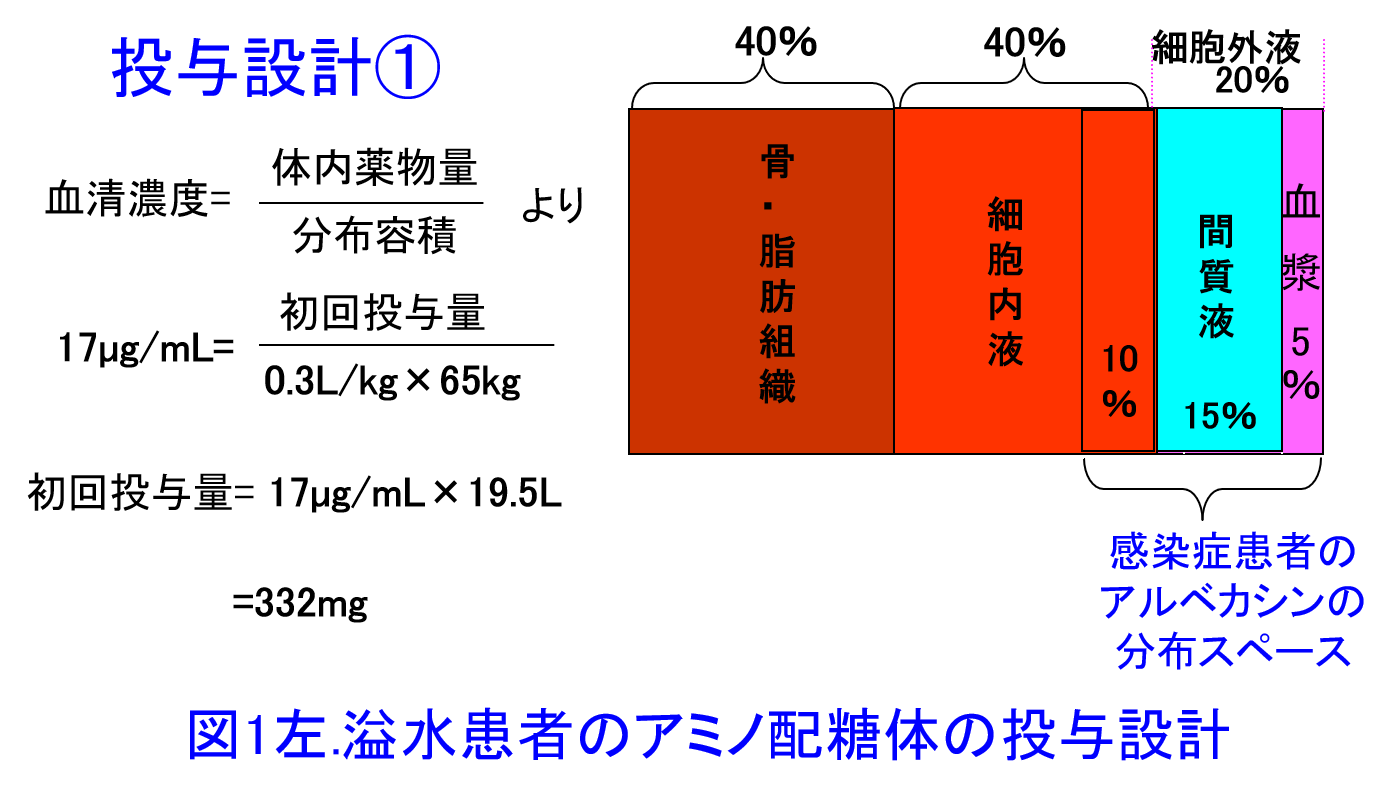
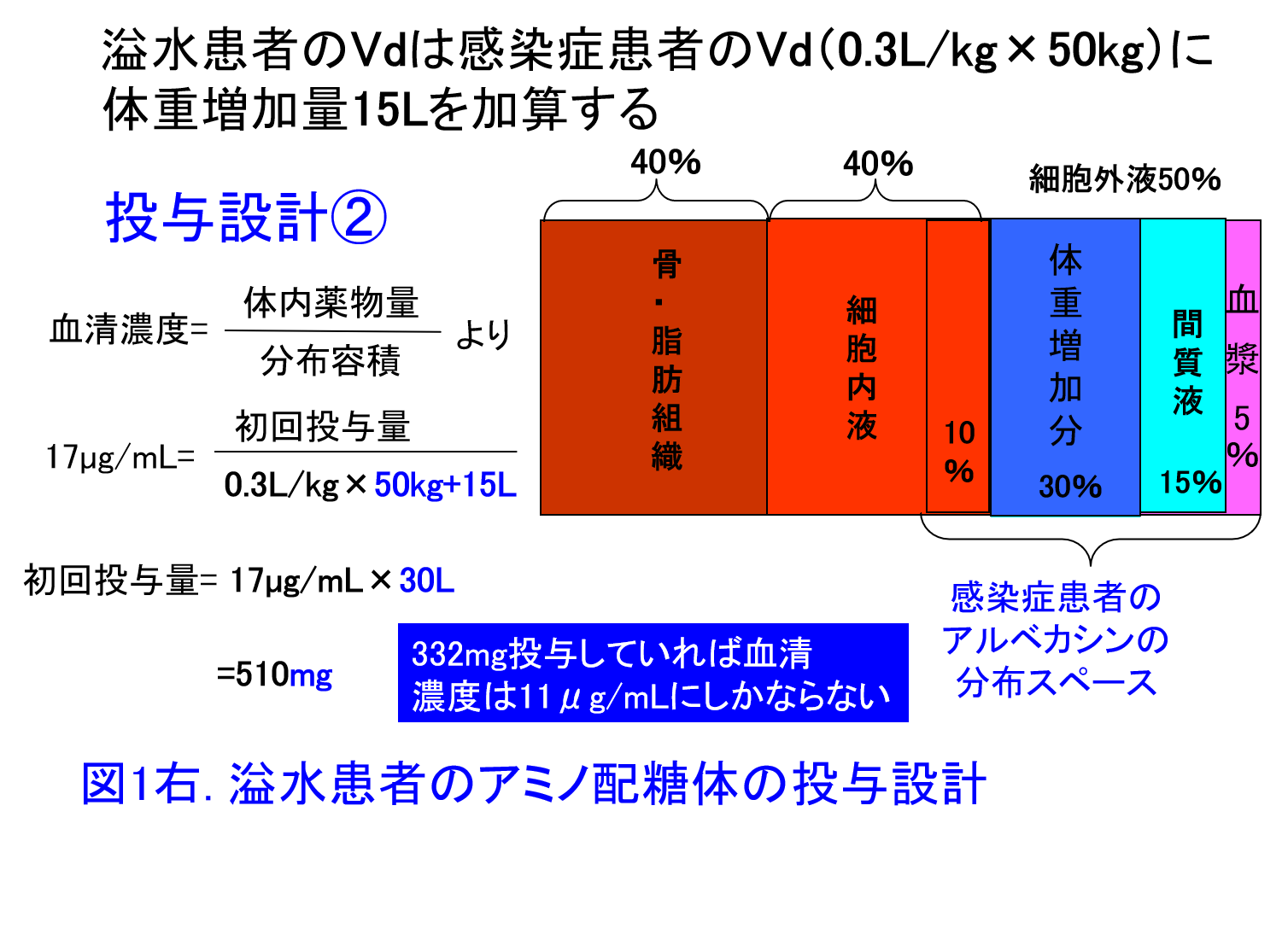
ただし本症例が肝硬変ではなく、末期腎不全による尿量減少によって体重が65kgに上昇しているとすれば、主治医には保存期腎不全患者であれば腎毒性のない他剤を選択すべきです。
添付文書には「1日1回150〜200mg(力価)を30分〜2時間かけて点滴静注する(2回に分けてもよい)」と書かれているので、医師の多くが「こんな大量投与したことがない」と言って引いてしまいますが、200mg/日では効きません。アミノグリコシドの添付文書のほとんどがピーク濃度が低いため効かず、ましてや2回に分けるとピーク値は下がりトラフ値が上がって、効きめはより弱くなって、腎障害が起こりやすくなります。
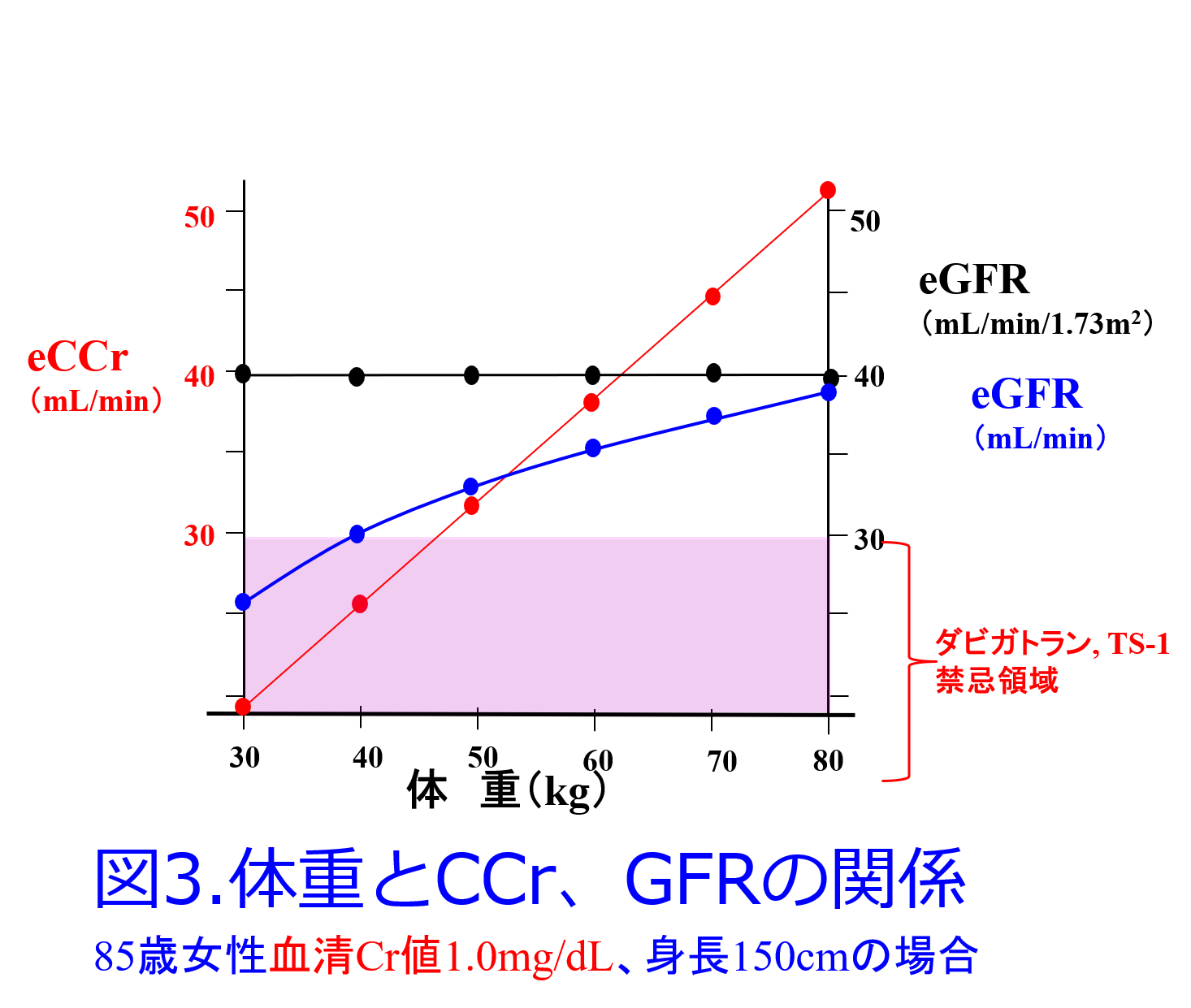
ただし浮腫があって体重が増えても腎機能がよくなるわけがないので(腎うっ血によってかえって悪くなることがあります)、eGFRや推算CCrに代入する体重は浮腫のないときの体重を使いましょう。
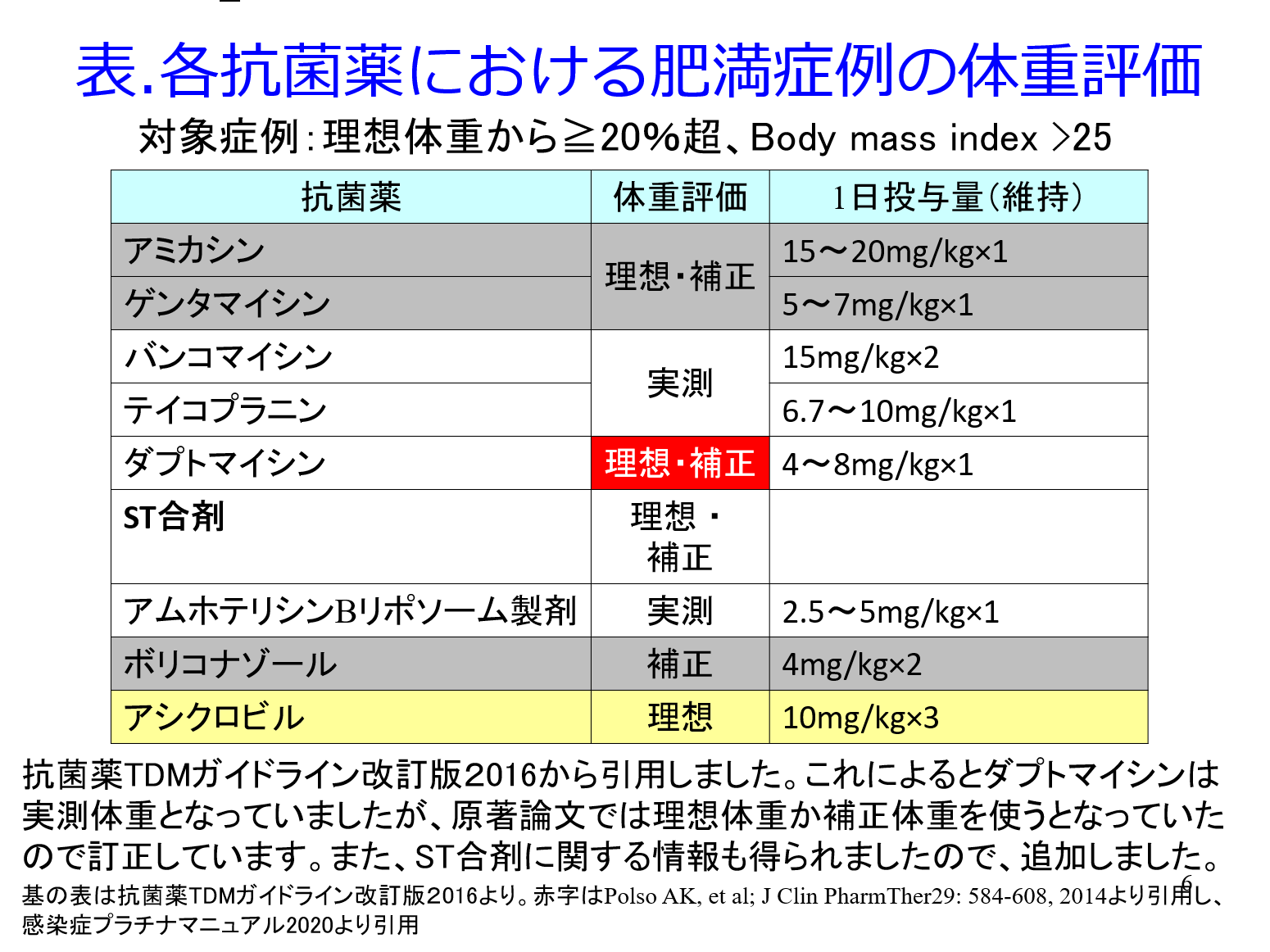
肥満患者で腎機能を推算するときに問題になるのが、推算CCrで身長が考慮されていないため、体重が2倍になると腎機能も2倍に評価されますが(図3)、脂肪太りの場合も、太ったために腎機能がよくなるわけではないので(一般的に肥満はCKDの進行要因になります)、太っていないときの体重は理想体重ですが、生来肥満気味の人は体重が多い分だけ、筋肉も使いますので、筋肉量も増えると考えると、通常、補正体重を使うのがよいとされています。
理想体重(男性)=50+{2.3×(身長−152.4)}/2.54
理想体重(女性)=45.5+{2.3×(身長−152.4)}/2.54
補正体重(kg)= 理想体重+[0.43×(実測体重-理想体重)]
ただし薬物によって体重の評価に何を使うのかが異なります(表)。僕自身は組織に分布しやすい(Vdの大きい)薬物は実測体重、親水性の高い薬物は理想体重を使うイメージを持っています。例えばバンコマイシンは実測体重を用いますが、米国の病院で200kg以上の肥満患者がMRSA敗血症で入院してきて「スミオ、バンコマイシンのトラフが5µg/mLにしかならないのよ」と相談を受けましたが、投与量は4gを超えて投与したことがないので、4gを初日投与したとのこと。PubMedで調べるとバンコマイシンは実測体重で投与設計することが分かったので、「8g/日投与しなきゃ効かないよ」と答え、実際に倍量投与してトラフ値が10以上になりました。
④伊奈オリーブ薬局 米坂由可里先生
Q.フェノフィブラート を肝機能低下傾向の方が服用していました。その後肝機能は改善しましたが、腎機能が悪化しました。どのように理解すればよろしいでしょうか?
A.この限られた情報で判断することはなかなかできないのですが、フィブラート系の投与によって腎機能が悪化すると、ふつうは横紋筋融解症による腎機能悪化を疑います。骨格筋が壊死して融解し、筋肉内の成分が血中に溶けだして、ミオグロビンが尿細管に詰まって急性腎障害が起こります。クレアチンキナーゼ上昇とともに LDH, AST, ALT などが上昇し、血尿が観察されれば、横紋筋融解症と考えてよいでしょう。フェノフィブラートの活性代謝物のフェノフィブリン酸の尿中排泄率は73%と高いため、腎排泄性薬物ですが、肝機能低下傾向患者に発症した理由はこれだけの情報では不明です。もしかして横紋筋融解症によってAST, ALTが高くなったため、肝機能低下傾向と判断したのではないでしょうか?
⑤今井病院 粕谷美枝子先生
Q.グリメピリド1mgを腎機能CCr35mL/minくらいの80歳代の患者さまに使用しており、低血糖症状と思われる症状が時々出るのですが、減量提案をしても処方医にあまり取り上げていただけません。認知機能も低下しており本人の自覚症状も薄いため、本日の先生のお話を聴いて低血糖症状の遷延化が不安になりました。 このような場合、減量提案よりも処方変更を提案した方が良いでしょうか。
A.腎機能の低下した後期高齢者の低血糖、とても危ないですね。SU薬とナテグリニドは重篤な腎機能低下(CCr<30mL/min)には禁忌です。CCr35mL/minであれば安全域の広い薬であれば投与しても構わないのですが、SU薬の低血糖と抗凝固薬による出血は超ハイリスク薬にあたる副作用ですからCCr<30mL/minには禁忌となっていてもCCr<50mL/minでも投与しない方が無難な薬と言えます。講演でお話ししましたように表に示すSU薬とナテグリニドには活性代謝物があり、それらは親化合物よりも親水性が高いため特異的に腎機能低下患者で蓄積しやすいのです。だからCCr35mL/minだからという理由でSU薬の投与にこだわる医師であれば、活性代謝物のないグリミクロンⓇ錠がより低血糖リスクが少ないので、変更を提案してみてはいかがでしょうか?以下の3点で理論武装しましょう。

①腎機能低下患者は遷延性低血糖が起こりやすく、重症低血糖はインスリン拮抗ホルモンであるカテコラミンの分泌を介して重症高血圧、低カリウム血症、QT延長→トルサード・ポアン→心停止など、心血管病変の悪化原因になるとても危険。
②活性代謝物のあるアマリールⓇ錠はインスリン抵抗性を改善する作用のある第3世代SU薬と言われているが、活性代謝物のないグリミクロンⓇ錠の方が安全。ミチグリニドが禁忌じゃないのにナテグリニドだけが禁忌なのは発売後に透析患者が重症低血糖事故が起こったため。
③80歳代でCCr35mL/minという腎機能は不可逆的に(進行性に)腎機能が悪化するため、重篤な腎機能障害でSU薬が禁忌になる腎機能になるのは間近です。
時間内に回答できなかった質問
⑥南相馬市立総合病院 中島先生
Q.薬剤の効果の持続時間は薬剤が有効血中濃度域にある間と考えています。薬剤毎の有効血中濃度域はどのように調べたら良いのでしょうか
A.薬剤の有効治療域は常に有効下限以上の濃度でないといけないわけではありません。前述のようにアミノグリコシド系抗菌薬のように、トラフ値が低いほど腎障害が起こりにくいので、血中トラフ濃度がゼロになっても構いません。アミノグリコシド系抗菌薬やキノロン系のように殺菌力の強い抗菌薬にはPAE(post antibiotic effect:抗菌薬残存効果)があるため、MIC以下のゼロになっても抗菌メカニズムは持続しますから。このようにPKだけではなく、PDも考慮した投与設計が必要になります。
すべての薬に有効治療域が設定されているわけではありません。TDM対象薬であっても有効治療域が不明な抗てんかん薬があります。抗てんかん薬はアドヒアランス不良でてんかん発作を起こすため、アドヒアランスの確認の意味だけでもTDMを実施する価値があります。TDM対象薬の治療域に関してはこのブログ「育薬に活用できるデータベース」の「2.薬物動態・TDM」に知りうる限りの有効治療域が載っています。
⑦高砂市民病院 白木先生
Q.CYPの寄与率や阻害率を確認する方法はありますか。
⑦佐賀大学医学部附属病院 橘川奈生先生
Q.CYPの寄与率などを用いて計算できる薬剤についてご教示いただけますと幸いです。薬剤のプロファイルにより異なるかと存じますが、約何倍までですと安全性の面から許容されますでしょうか。
A.これらに関しましては僕は専門家ではないので、よくわかりません。鈴木洋史先生、大野能之先生の著された「これからの薬物相互作用マネジメント 臨床を変えるPISCSの基本と実践 第2版(じほう)」を参照してください。
例えばスタチン薬のシンバスタチンのFは5%と極めて低いのは、CYP3A4の寄与がほぼ100%のため小腸のCYP3Aによって初回通過効果を受けやすいから→CYP3A4を100%近く阻害するボリコナゾールやイトラコナゾールでは血中濃度が約20倍近くになるはず。そしてグレープフルーツを食べたりすると10倍近く血中濃度が上がるので、横紋筋融解症が起こりやすい→薬剤師はFの小さいシンバスタチン、アトルバスタチン、フェロジピンに関しては「グレープフルーツを食べたり飲んではいけません」という薬剤情報提供用紙を渡すだけではだめで、ちゃんと口頭でも注意しなくてはならない などの理論展開が可能になります。
薬の安全性は薬によって大きく異なります。βラクタム系抗菌薬は腎排泄性薬物でアレルギー性副作用が怖いが、安全性が高いので、初回負荷投与は思い切りいこう。だけど2回目以降も減量せず投与すると1週間くらいで数倍以上の血中濃度が持続すると痙攣をおこすことがあるので、腎機能低下患者や高齢者に減量せずに継続投与はあり得ない。抗凝固薬のダビガトランは超ハイリスク薬であるため、血中濃度はほんの数倍でも非常に危険です。繰り返しますが、薬の安全性はこのように薬によって大きく異なります。
フェニトインは非線形薬物動態を取るTDM対象薬ですから数10倍の血中濃度になると「致死濃度」になるかというと、30年前くらいに恐怖の「アレビアチン原末」が売られていました。僕はこれは危ないと思っていましたが、当時の精神科医は1包に複数の抗てんかん薬の散薬を混ぜて投与することを好んでいたので、カサの高い10倍酸はではなく原末を好んでいたため、製薬会社も危ない原末の製造中止に踏み切れなかったのです。そこで10倍散の代わりに原末を調剤したという薬剤師の誤薬が10件以上も起こったのですが、十数症例目の誤薬でようやく死亡例が出たのです。フェニトイン濃度は10倍ではなく、非線形であるため、数百倍あるいは1000倍近くになったのかもしれません。その時「非線形でTDM対象薬のフェニトインでも人はそう簡単には死亡しないんだ」と感じた方は多かったと思います。でもCCr<30mL/minで禁忌のダビガトランは発売半年間で24名が出血死しました。24名中22名が70歳以上の高齢者です。
これで何が言いたいかわかりますか?フェニトイン服用患者は結構若年者や青年患者が多いですよね。何倍という血中濃度だけではなく、70歳以上の後期高齢者は弱い!しかも心房細動は心不全をきたすことが多い。心不全でフレイル、サルコペニアの高齢者は極めて脆弱、という患者側の要因も考慮しなくてはならないということです。ちなみに皆さんの把握している薬物動態パラメータは治験時に行われた第1相試験、つまり「若年青年男子」が対象なのです。でも疾病の多くは高齢者に発症し、当然薬を飲む多くの人は高齢者ですよね。薬の専門家である皆さんは薬物動態パラメータのデータを高齢者に翻訳しなければならないのです!PBRはアルブミン濃度の低い高齢者では低くなるはず、tmaxは消化管運動の遅延する高齢者では遅延するはず、腎機能は当然低下するはず…………のようにです。
⑧道ノ尾病院 渕上朋一先生
Q.薬物動態について、理解がより深まる講演をありがとうございました。講演の中で、ファーマコジェネティクスと薬物動態の話しがでてきましたが、エピジェネティクス機構が薬物動態の個人差となることはあるのでしょうか?
A.僕はこの分野の専門家ではありませんが、双子であっても1人は喫煙者、1人は非喫煙者であればCYP1A2の誘導により、テオフィリンやプロプラノロールのクリアランスが2倍近くの差が出てくるはずですし、飲んでいる薬によって耐性、自己誘導などを起こしえますので、環境因子によって薬物動態は変わります。したがってエピジェネティクス機構が薬物動態の個人差となることは十分にあると思います。

