NSAIDsによる腎障害
◆連載◆21日目 アセトアミノフェンについて深く知ろう③
NSAIDsによる腎障害 ~Triple whammyを防げ~
21日目 アセトアミノフェンについて深く知ろう
③鎮痛薬腎症はAKIではなく慢性腎不全。
その真犯人はフェナセチンだけではないことを突き止めたベルギーの論文を抄読してみよう!(1)
鎮痛薬腎症Analgesic nephropathyは腎乳頭壊死と間質性腎炎を特徴とする慢性腎不全です。これはオーストラリアやベルギーで発症率が高く、オーストラリアの女性透析患者の22%がフェナセチンによる慢性腎不全だったといわれています。フェナセチンを含むOTCの鎮痛薬の大量消費が主原因とされていましたが、現在ではアセトアミノフェン、ピリン系鎮痛薬、多くのNSAIDs(アスピリン、フェナセチン、フェニルブタゾン、インドメタシン、メフェナム酸、フルフェナム酸、フェノプロフィン、ナプロキセン、およびイブプロフェン)も発症原因になることが分かっています1)。乳頭壊死は剖検や腎切除後など例外的な患者でないと証明されなかったのですが、近年ではCTスキャンによって診断できるようになりました。鎮痛薬腎症はゆっくりと潜在性に進行するため、多くの鎮痛薬腎症の患者は重症になって尿毒症症状が現れてから受診することが多いようです2)。
フェナセチンはベテランの薬剤師の先生方はご存知だと思いますが、1887年から使われていたメジャーな鎮痛薬で、代謝されてアセトアミノフェンとして作用するのですが、後になってアセトアミノフェンが活性体と分かっただけで、歴史のあるフェナセチンの方が汎用されていたようです。長期に大量を服用した場合の腎障害や腎盂・膀胱腫瘍、血液障害の発生リスクの増大等が指摘されて1983年にフェナセチンが欧米で製造中止となり、日本での医療用フェナセチン(OTC薬のフェナセチンは1983年に中止済み)は重篤な腎障害の報告が相次いだため、遅れて2001年に製造中止になりました。
欧米でフェナセチンが製造中止になった1983年11月以降はオーストラリア、ベルギーおよび「フランダースの犬」で有名なフランダース地方(オランダ南部・ベルギー西部・フランス北部の地域)での鎮痛薬腎症は年々、減少しつつあります(図1)3)。 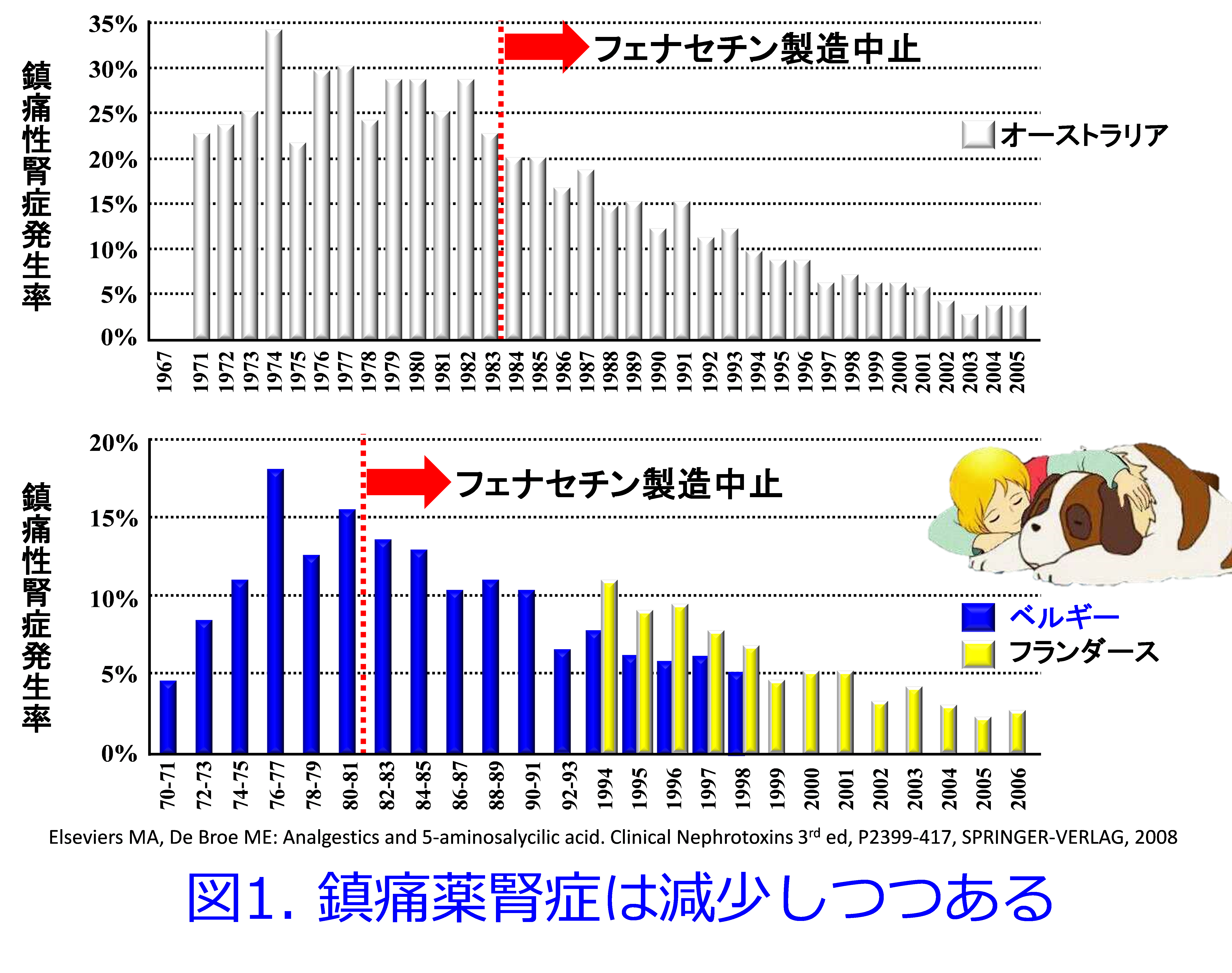 ここで紹介したいのはベルギーでの調査をまとめたElsevierの詳細な報告4)です。アセトアミノフェンが単独で腎障害を起こすか否かを最もクリアカットに説明できる論文だからです。この報告をしっかり読むと鎮痛薬腎症の実態(真犯人)が理解できると思います。フェナセチン製造中止になって7年後、つまり1990年のベルギー26区の透析の導入率と1983年のフェナセチンのみを鎮痛薬として含むOTC薬購入量との間に相関は認められておらず(図2)4)、当時汎用されていたAPC処方といわれる
ここで紹介したいのはベルギーでの調査をまとめたElsevierの詳細な報告4)です。アセトアミノフェンが単独で腎障害を起こすか否かを最もクリアカットに説明できる論文だからです。この報告をしっかり読むと鎮痛薬腎症の実態(真犯人)が理解できると思います。フェナセチン製造中止になって7年後、つまり1990年のベルギー26区の透析の導入率と1983年のフェナセチンのみを鎮痛薬として含むOTC薬購入量との間に相関は認められておらず(図2)4)、当時汎用されていたAPC処方といわれる  アスピリン、フェナセチン、カフェイン処方が1919年にオーストラリアで製剤化された(英語版Wikipediaより)OTC薬が問題だったことはこの当時から明らかだったようです。同様に26区の透析の導入率とアスピリンのみを鎮痛薬として含む1983年のOTC薬購入量との間にも相関は認められず(図3)、26区の透析の導入率と鎮痛薬
アスピリン、フェナセチン、カフェイン処方が1919年にオーストラリアで製剤化された(英語版Wikipediaより)OTC薬が問題だったことはこの当時から明らかだったようです。同様に26区の透析の導入率とアスピリンのみを鎮痛薬として含む1983年のOTC薬購入量との間にも相関は認められず(図3)、26区の透析の導入率と鎮痛薬  を2種類含む+カフェイン±コデインの複合剤のOTC薬購入量にはR=0.86の強い正相関が認められました(図4)。
を2種類含む+カフェイン±コデインの複合剤のOTC薬購入量にはR=0.86の強い正相関が認められました(図4)。

鎮痛薬腎症226名中、219名(97%)が鎮痛薬2剤+カフェインなどの複合剤を服用しており、フェナセチンが最多(鎮痛薬単剤+カフェインN=6、鎮痛薬単剤のみ N=1を除く)でした(図5上のバー)。ただし複数ブランドのOTC薬を服用していた症例はどのブランドのOTC薬が鎮痛薬腎症の原因になるのか不明なため除くと、179名に解析対象者が限定され(図5中のバー)、そのうち予想通りフェナセチン含有製剤が133名と圧倒的に多かったのでこれを除外しました。フェナセチン以外にも鎮痛薬腎症に関連している鎮痛薬があるとすれば何かということが、このフェナセチンを除いた=46人を解析すればわかるはずです(図5下のバー)。そして図5下の表を見れば一目瞭然です。フェナセチンを除けば鎮痛薬腎症の最多の鎮痛薬組成はピリン系2剤の複合剤で22名(こんなOTC薬は日本には存在しません)、アスピリンとアセトアミノフェンの複合剤が18名、アスピリンとピリン系の複合剤が4名、アセトアミノフェンとピリン系の配合剤が2名です。鎮痛薬単剤で腎症を発症したのは3%の7名のみですから、単剤ではほぼ鎮痛薬腎症を起こさないことは明らか、つまりアセトアミノフェンは単独投与では鎮痛薬腎症の原因にならないのです!今までにアセトアミノフェンを投与した群がNSAIDs群と同等に透析導入になった、あるいはアセトアミノフェン群の方がNSAIDs群よりも透析導入リスクが有意に高かったというのはすべてコホート研究かケースコントロールスタディでRCTではありません。前回に解説したとおり、CKD患者、高齢者であればNSAIDsではなくアセトアミノフェンが推奨されていたというバイアスを含んでいるためだったからだと平田は確信しております。

引用文献
1) Brix A: Toxicol Pathol 30: 672-674, 2002
2)Elseviers MM, et al: 鎮痛薬とアミノサリチル酸, “臨床家のための腎毒性物質のすべて”, De Broe ME, et al編, シュプリンガー・ジャパン, 東京, 2008, pp214-226, 2008
3)Elseviers MA, De Broe ME: Analgestics and 5-aminosalycilic acid. Clinical Nephrotoxins 3rd ed, P2399-417, SPRINGER-VERLAG, 2008
4) Elseviers MM, De Broe ME: Am J Kidney Dis 28: S48-55, 1996
◆連載◆20日目 アセトアミノフェンについて深く知ろう②
NSAIDsによる腎障害 ~Triple whammyを防げ~
20日目 アセトアミノフェンについて深く知ろう
②「アセトアミノフェンAKIを起こす」説は腎機能低下患者ではNSAIDsではなく優先的にアセトアミノフェンが投与されているバイアスがあるからだ!
腎機能が低下しているCKD患者にはNSAIDsの投与は推奨できませんが、それに代わる代替薬として欧米ではアセトアミノフェンが推奨されてきました。米国腎臓財団のAd Hoc Committeeは1996年から腎臓病患者への鎮痛薬としてアセトアミノフェンを推奨しており1)、アスピリンアレルギー、胃腸障害患者、利尿薬服用者、心疾患、高血圧、腎臓病、肝臓病患者、65歳以上の高齢者は医師の指示なしでNSAIDsの服用を禁止しています。これらの多くはNSAIDsによるAKIのリスク因子(育薬に活用できるデータベース→4.薬剤性腎障害→「3.表.NSAIDsによるAKIの危険因子」)と一致しています。
また米国老年医学学会の鎮痛療法ガイドラインでも非選択性NSAIDs、COX-2選択的阻害薬は極めて厳重に注意して投与すべきであり、特殊な症例を除いて投与してはならない(質の高いエビデンス、強力に推奨)としており、高齢者の持続的な痛みに対する初期および持続的薬物療法、特に筋・関節痛に対してはアセトアミノフェンを推奨(効果および安全性に関して質の高いエビデンスがあり、強く推奨)しています。ただしアセトアミノフェンは肝不全には禁忌、アルコール中毒・肝障害には慎重投与で1日投与量は4gを越えないことが重要とされています2)。
このように米国では腎機能の低下した患者さんには優先的にアセトアミノフェンが用いられているというバイアスが存在するためか1)、NSAIDsとの比較でアセトアミノフェンの方が透析導入リスクは低いという明確なエビデンスはなく、アセトアミノフェンの単独による腎障害についてはいまだに意見の一致を見ません3)4)。論文の中には腎機能低下患者にはCOX阻害によるAKI発症リスクが高くなるためNSAIDsは使われず、腎機能低下患者に優先的に投与されるアセトアミノフェンで末期腎不全になるという報告はrecruitment biasがあり、原因ではなく結果ではないかと主張する報告もあります5)。日本ペインクリニック学会もHP上で「アセトアミノフェンにはNSAIDsのような胃腸障害や腎障害の副作用はありません。しかし、アセトアミノフェンの副作用として肝障害には注意が必要です。」と明記しています6)。逆に高齢者の安全な薬物療法ガイドライン2015では「COX-2選択性NSAIDsやNSAIDsに含まれないアセトアミノフェンについても腎障害に対する安全性は確立していない。いずれも使用量は最小限にとどめるべきである。」となっていますが、これもエビデンスレベルだけから見ればアセトアミノフェンがNSAIDsではなく、CKD患者や高齢者に優先的に使われたために起こったバイアスによると思われます7)。「AKIを最も起こしやすいリスクの高い人は既存の腎機能低下患者(つまりCKD患者)および高齢者。そしてそのような人が透析導入になりやすい」ことは今や常識ですから(図)8)。 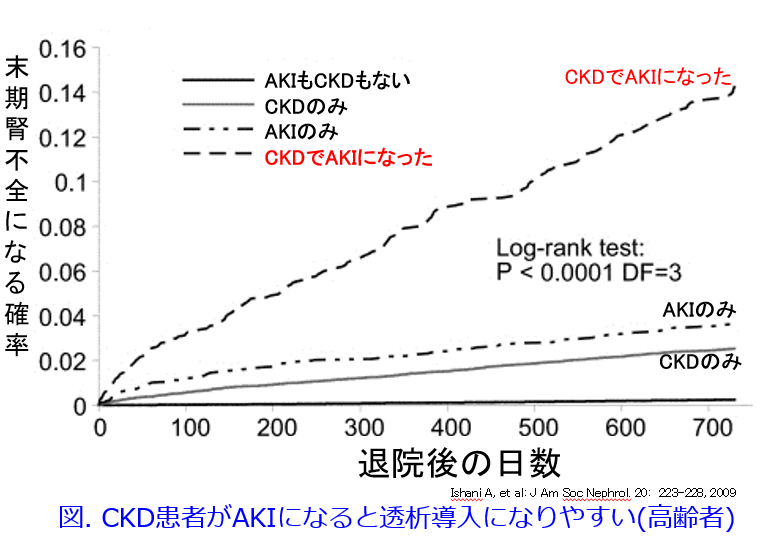 アセトアミノフェンは安全性だけではなく多岐にわたるベネフィットがあることを知っていただきたい
アセトアミノフェンは安全性だけではなく多岐にわたるベネフィットがあることを知っていただきたい
と思います(表)。

引用文献
1)Henrich WL, et al: Am J Kidney Dis 27: 162-165, 1996
2)American Geriatrics Society Panel on Pharmacological Management of Persistent Pain in Older Persons: J Am Geriatr Soc 57:1331-1346, 2009
3)Kuo HW, et al: Analgesic use and the risk for progression of chronic kidney disease. Pharmacoepidemiol Drug Saf 19: 745-751, 2010
4)Michielsen P, et al: Non-phenacetin analgesics and analgesic nephropathy: clinical assessment of high users from a case-control study. Nephrol Dial Transplant 24: 1253-1259, 2009
5)Campo A: Acetaminophen, aspirin, and renal failure. N Engl J Med 346: 1588-1589, 2002
6)日本ペインクリニック学会 (jspc.gr.jp)2021.08.14に閲覧
7)高齢者の安全な薬物療法ガイドライン2015, メジカルビュー社: 95-96, 2015
8)Ishani A, et al: J Am Soc Nephrol. 20: 223-228, 2009
◆連載◆19日目 アセトアミノフェンについて深く知ろう①
NSAIDsによる腎障害 ~Triple whammyを防げ~
19日目 アセトアミノフェンについて深く知ろう
①.アセトアミノフェンの薬理作用
アセトアミノフェンは一般的には安全性は高いものの、わが国では長らく添付文書用量が1.5g/日であったためか、十分量が投与できませんでした。そのため鎮痛用量に達していないので、鎮痛作用はNSAIDsよりも弱くなり、日本ではOTC薬の鎮痛薬や風邪薬の配合剤としては汎用されているものの、医療用医薬品としてはまだまだ使用頻度は低いようです。ただしアセトアミノフェンは薬剤性肝障害の原因薬物のトップですが1)、多くは自殺企図などの超大量服用が原因です。
薬剤性腎障害に関してはアセトアミノフェンの報告もありますが、NSAIDsによるGFR低下は速やかに起こり、AKIの原因薬物になるものの、アセトアミノフェンを含む鎮痛薬複合剤はいわゆる鎮痛薬腎症という乳頭壊死・間質性腎炎による慢性腎不全を起こします。特に透析導入の原因薬物としてはどちらが安全か、またアセトアミノフェン単独で腎障害を超すのか否かについては、いまだに明確な結論が出されていないのです。そのため本項ではNSAIDsとアセトアミノフェンの安全性について特に腎機能に着目して概説したいと思います。
アセトアミノフェンの薬理作用についてはいまだ明確に解明されていませんが、2005年にHögestättら2)はアセトアミノフェンの代謝物がアラキドン酸と結合することによってN-アシルフェノールアミン(AM404)が生成されることを明らかにしました。このAM404が強力な鎮痛作用を表すことが示唆されていますが、一般的にはアセトアミノフェンは主に中枢神経系におけるプロスタグランディン(PG)の合成を阻害して鎮痛効果をもたらすことが有力視されています。脳の体温調節中枢に対する内因性発熱物質の作用を抑制する一方、末梢のPGにはほとんど作用しないとされています。そのため抗炎症作用はほとんど期待できない代わりに NSAIDsに伴う4大副作用である胃腸障害、AKI、抗血小板作用による易出血性、アスピリン喘息はアセトアミノフェンではほとんど認められません。
これらのことから2002年よりわが国でのOTC薬であるタイレノールⓇは日本で初めて「空腹時でも飲める鎮痛解熱薬」になりました。ただし「かぜによる悪寒・発熱時には、なるべく空腹時をさけて服用すること」が付記されたままです。米国ではTPN(total parenteral nutrition)施行時、つまり絶食時の発熱や未熟児の発熱に対しアセトアミノフェンの懸濁液が汎用されていますが、これは解熱に用いる低用量投与では胃障害がないことの裏づけと考えてもよいでしょう。日本ではアセトアミノフェンは添付文書上では解熱目的には1回300~500mg を頓用とし原則として1日2回まで、鎮痛目的には1回300~500mgを4~6時間おきとなっています。
ただしアセトアミノフェンは用量増加に伴い胃腸障害を起こすことがありうるため、鎮痛用量では空腹時服用は推奨されません。解熱用量でも添付文書上は空腹時の投与は避けることが望ましいとなっています。また別の作用機序によって喘息を誘発することがあるため、喘息患者にはNSAIDsと同様、推奨されません3)。さらにアセトアミノフェンはNSAIDsのようにGFRを速やかに低下させることはないため単独ではAKIを起こさないものの、アセトアミノフェンを含む鎮痛薬の生涯にわたる累積服用量の増加により鎮痛薬腎症と称される乳頭壊死から不可逆性の末期腎不全になり透析導入に至ることがあります4)。
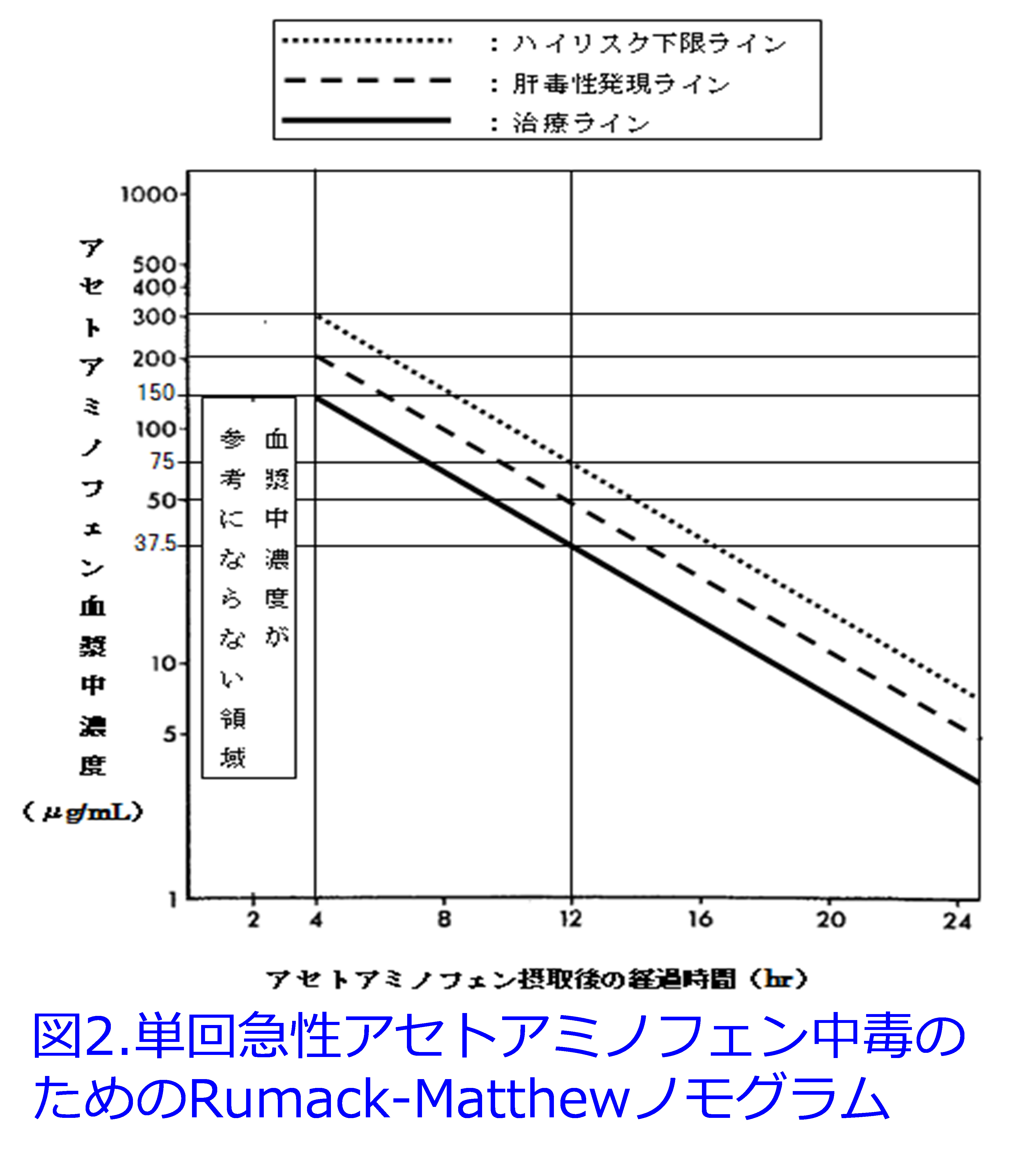
通常、アセトアミノフェンは約60%がグルクロン酸抱合、30%が硫酸抱合され尿中に排泄されますが5)、一部はCYP2E1によって反応性の高い毒性代謝物N-アセチル-P-ベンゾキノンイミン(NAPQI)になりますが、生成されたNAPQIは速やかにグルタチオン抱合されることによって、無毒化されて尿中に排泄されます。しかし7.5g/日以上の大量服用によりグルクロン酸、硫酸による抱合過程が飽和することによって、CYP2E1による代謝が促進されます。それによりグルタチオンが枯渇しやすくなる、あるいはアルコール依存症患者では肝臓のグルタチオン貯蔵がもともと低下しており、しかもCYP2E1が誘導されやすいため活性の高いNAPQIが蓄積して肝のタンパクと共有結合することによって肝細胞壊死を起こします(図1)。 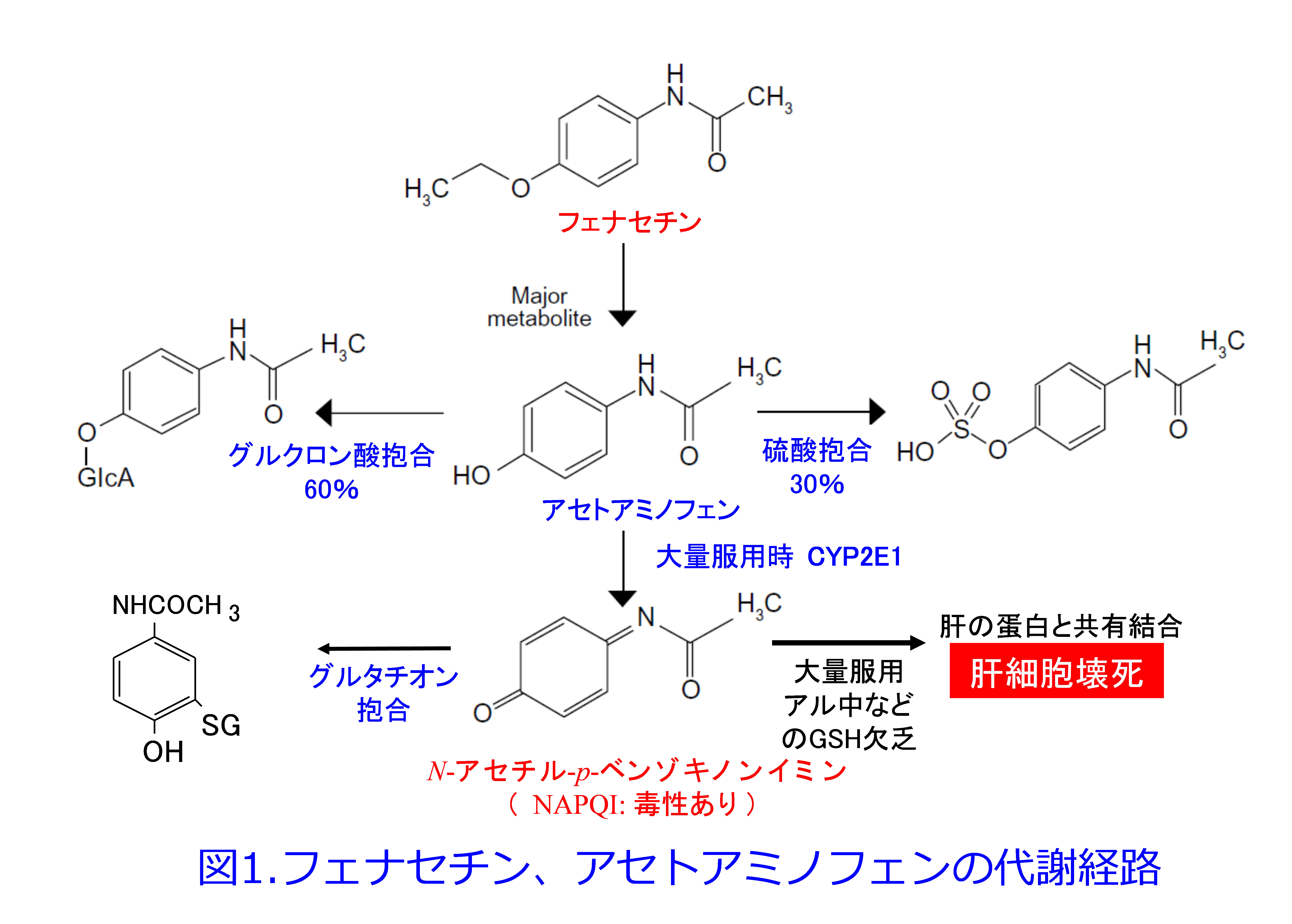 わが国ではアセトアミノフェンによる重篤な肝障害は自殺企図や誤飲によるものが多いのですが、初期症状に乏しいため、できるだけ速やかにN-アセチルシステイン(NAC)を投与します。NACはグルタチオンの前駆体となって、解毒作用を発揮します。アセトアミノフェンはTDM対象薬ではないのですが、薬剤性肝障害を起こしやすいため月1回の血中濃度の測定が算定できます。この場合、測定値が分離剤の影響を受けるため血清分離剤入り容器の使用は避ける必要があります。有効治療濃度は解熱剤として2~6µg/mL、鎮痛薬としては5~20µg/mLであり、肝障害を起こす中毒濃度は服用4時間後で200µg /mL、12時間後で50µg /mL以上とされています(図2)6)。
わが国ではアセトアミノフェンによる重篤な肝障害は自殺企図や誤飲によるものが多いのですが、初期症状に乏しいため、できるだけ速やかにN-アセチルシステイン(NAC)を投与します。NACはグルタチオンの前駆体となって、解毒作用を発揮します。アセトアミノフェンはTDM対象薬ではないのですが、薬剤性肝障害を起こしやすいため月1回の血中濃度の測定が算定できます。この場合、測定値が分離剤の影響を受けるため血清分離剤入り容器の使用は避ける必要があります。有効治療濃度は解熱剤として2~6µg/mL、鎮痛薬としては5~20µg/mLであり、肝障害を起こす中毒濃度は服用4時間後で200µg /mL、12時間後で50µg /mL以上とされています(図2)6)。
引用文献
1)Björnsson E, et al: Dig Liver Dis 38: 33-38, 2006
2)Högestätt ED, et al: J Biol Chem 280: 31405-31412, 2005
3)Shaheen SO, et al: Thorax 55: 266-270, 2000
4)Duggin GG: Am J Kidney Dis 28: S39-S47, 1996
5)Martin U, Eur J Clin Pharmacol 41: 43-46, 1991
6)Rumack BH, et al: Pediatrics 55: 871-876, 1975
◆連載◆18日目 米国医療制度の闇
NSAIDsによる腎障害 ~Triple whammyを防げ~
18日目 米国医療制度の闇
米国は先進国で唯一の皆保険制度のない国です。医療レベルは極めて高いのに、医療費は極めて高く、自分で保険会社の保険に加入していない人は病院に行く余裕はないので、超安値OTC薬のNSAIDsを大量購入します。米国の医療用イブプロフェンは800mgの錠剤もあるので、日本では胃障害が少なく鎮痛作用もマイルドなイメージがあるイブプロフェンも「ジクロフェナクと変わらないよ」と米国の薬剤師は言っていました。膝痛・腰痛で痛ければ安くて日本の2~4倍量のイブプロフェンを飲み、それでよくならなければすべて日本の倍量のナプロキセン、アスピリン、ケトプロフェンに手を出す。当然、胃障害と抗血小板作用による消化管出血によって1年に2万人近くが死亡していたのだと思います。
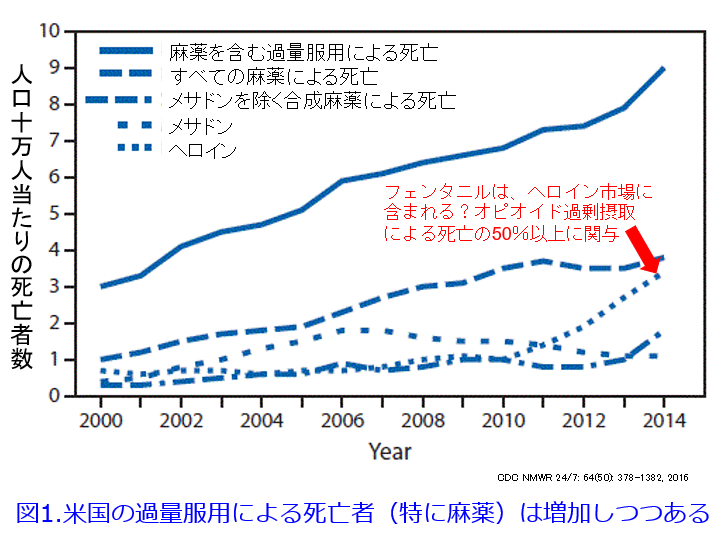
米疾病対策センター(CDC)によると、医者が処方した鎮痛剤の過剰投与による死亡は男女併せると1年に38,300人1)。ちなみに2016年の米国の薬物過剰摂取(副作用ではない)による死亡者は25~54歳が最多(副作用といえば後期高齢者のわが国と大きく異なります)で、2017年時点で63, 600人です。これにより米国の平均余命は短縮しつつあるといわれています2)。21世紀になってから過量服用による死亡者はNSAIDsからオピオイドに変わっているのです。米国では、合成麻薬の過剰摂取による死亡が2013年の約3,000人から2016年には約2万人へと大幅に増加しており、 2014年で4万人弱、2016年の薬物過剰摂取による死亡者は6万人を超えると見積もられています。この急激な増加には、不法に製造されたフェンタニルがヘロイン市場に導入された影響が大きいといわれています(図1)3)。
警察官2人に付き添われて、囚人服を着せられて退院する手錠をかけられた20歳前後の麻薬中毒の囚人を大学病院で何度見たことか……(図2: ただし写真は本物の囚人ではなく歌手で女優のTaylor Swiftさんです)。
 高額な民間保険に加入している人は世界最高峰の医療を受けられるのに、6人に1人の無保険者が交通事故で重傷を負うと、老朽化した群立病院County hospital(図3)の救命救急室ERに送られる。救急車の中で「County hospitalだけには行かないで!あそこに行くと生きて帰れないから」と叫んでも、民間保険に入っていない貧困者は衛生状態も決して良くないCounty hospitalに送られ、重症であっても抗生物質の自己点滴のやり方を薬剤師から指導を受けてすぐに退院させられる。これは実際にLAのCounty hospitalの薬剤師から聞いたことです。米国の無保険者に対する医療制度は2010年に成立したObama Careによって改善しましたが、2020年6月にコロナ禍の中でトランプ政権の共和党によって無効化を求める訴訟が行われましたが、1年後に訴えが退けられました。米国は医療の先進国なのにここの医療制度は病んでいます!
高額な民間保険に加入している人は世界最高峰の医療を受けられるのに、6人に1人の無保険者が交通事故で重傷を負うと、老朽化した群立病院County hospital(図3)の救命救急室ERに送られる。救急車の中で「County hospitalだけには行かないで!あそこに行くと生きて帰れないから」と叫んでも、民間保険に入っていない貧困者は衛生状態も決して良くないCounty hospitalに送られ、重症であっても抗生物質の自己点滴のやり方を薬剤師から指導を受けてすぐに退院させられる。これは実際にLAのCounty hospitalの薬剤師から聞いたことです。米国の無保険者に対する医療制度は2010年に成立したObama Careによって改善しましたが、2020年6月にコロナ禍の中でトランプ政権の共和党によって無効化を求める訴訟が行われましたが、1年後に訴えが退けられました。米国は医療の先進国なのにここの医療制度は病んでいます!
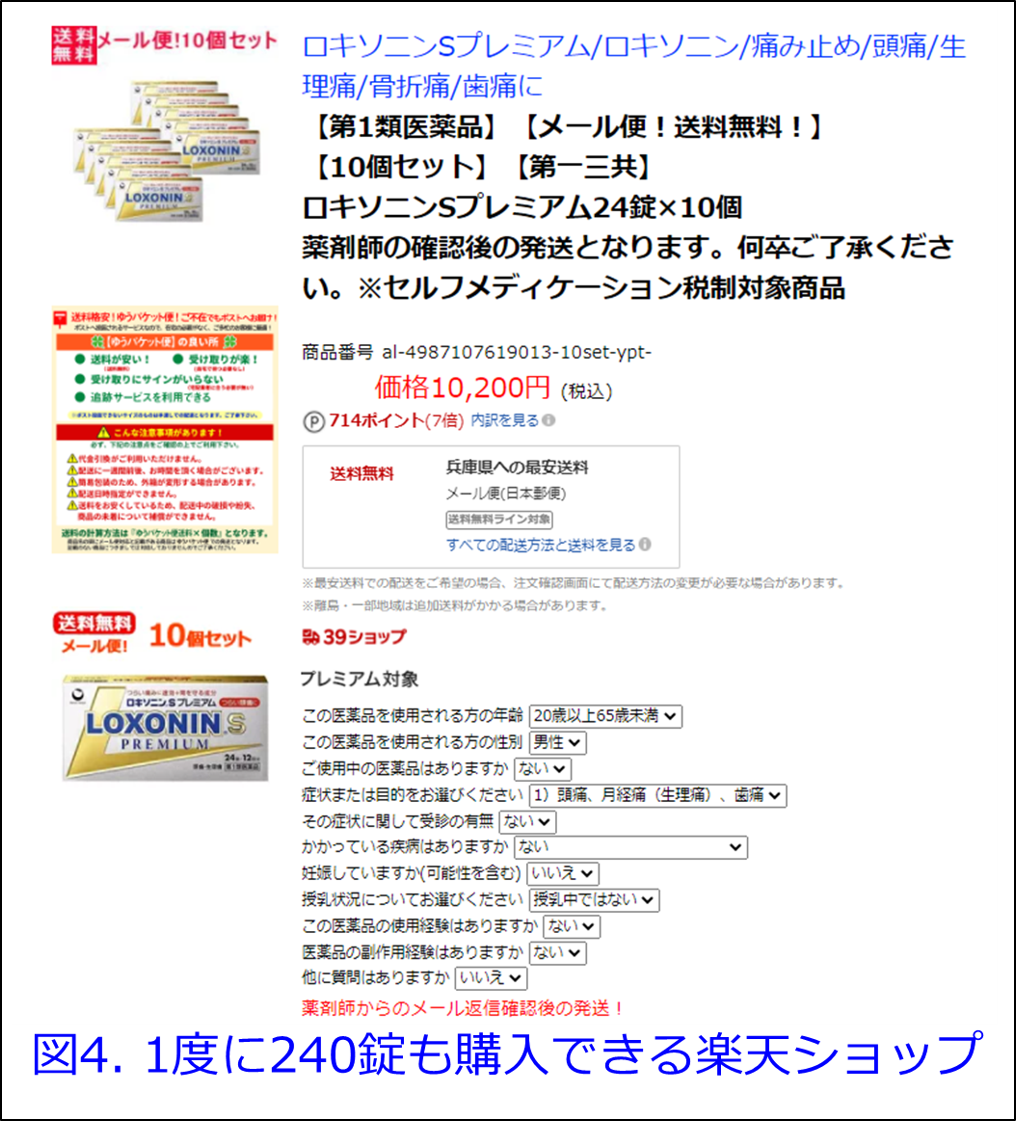
追伸:日本では原則として対面販売のみだったロキソニンⓇSやガスターⓇ10などの第1類医薬品は、「ネット販売で対面販売よりも副作用リスクが高いというデータは存在しない」とする楽天の三木谷浩史社長らの訴えが実り、2014年6月の改正薬事法施行でネット販売できるようになりました。薬剤師による確認を行ってから薬品が発送されるとなっていましたが、「薬剤師からのメール返信確認後の発送!」となっていますが、ロキソニンⓇSプレミアム24錠×10個でも非常に簡単に購入可能です(図4)。日本も米国のように病んだ国にならなければいいのですが・・・・。
引用文献
1) 2013年7月5日共同通信
2) 2017年12月21日/Health Day News
3) CDC: 2017: 66: 1197-1202
NSAIDsによる腎障害 ~Triple whammyを防げ~
17日目 米国で見た「Tylenol is not an NSAIDs」 というテレビCM と消化管出血による死亡者
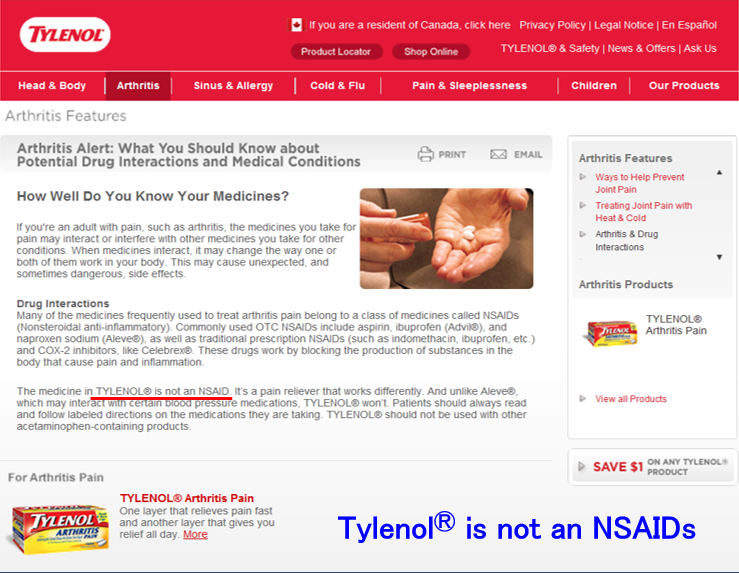
Native Speakerの人たちに医学用語や病名はあまり通じません。例えば腹膜透析peritoneal dialysisや腎不全renal failureといった言葉すらわからない一般人が多いのです。でも2005~2006年の米国留学中にタイレノールⓇのテレビCMで「TylenolⓇ is not an NSAIDs」というメッセージをよく見ました(写真)。要するにタイレノールⓇはNSAIDsじゃないので安全ですよということを言いたかったらしいのですが、でも、なんで「テレビを見ている一般民にNSAIDsが通じるの?」という疑問を持ちました。日本でも一般の方はNSAIDsって言ってもわかってくれない人がほとんどなのに…。
古い論文で恐縮ですが1998年のLazarouら1)の報告による1994年の米国における年間死亡者数は①心臓病74.3万人、②悪性腫瘍53万人、③脳血管疾患15万人の次の4位が10.6万人で総死亡者数221.6万人中6.7%にあたるのが何と「副作用死」だというのですが(図1)、その前後の報告で米国ではNSAIDsによる上部消化管出血などの副作用で、年に103,000人が入院し、変形性膝関節症に限っても1年に16,000人以上が死亡しています2)。

またリウマチに関しては少なくとも2,000人以上がNSAIDs服用に関連して死亡しているという報告があり3)、NSAIDsだけでも1年間に20,000人近くが死亡していたことから、Lazorouらの報告の信憑性は決して低くないと感じられます。
米国では人口の1/3の約1億人が慢性疼痛を抱えていると推定されており、2,500万人はQOLの低下する中等度~重度の疼痛を有するといわれています4)。米国でNSAIDsによる死亡者が多かった理由は容易に予測できます。おそらく肥満者が多いため膝関節痛や腰痛の発症率が日本よりも高く、米国は先進国で唯一、皆保険制度ではないため貧困者は適切な医療が受けられず、OTC薬のNSAIDsに頼るのです5)。日本では10錠で500~1000円するNSAIDsが米国では100錠で1000円足らずで買えます。しかもOTC薬でありながら日本の医療用医薬品の倍量が含まれている錠剤が、バリューサイズの1000錠入りイブプロフェン、ナプロキセン、アスピリンが飴玉やミントよりも安い超安値で売られています(図2)。アスピリンで効かなければイブプロフェンを、そしてそれでも効かなければナプロキセンを併用してしまう。
 あるいはNSAIDsと鎮痛薬の合剤を知らず知らずのうちに服用してしまい、これによる消化管出血による死亡が増えていたのであろうということは想像に難くありません。2001年には、アメリカでは300億錠のNSAIDsが薬局で販売されましたが、処方されたNSAIDsは7000万錠のみ、つまり処方薬は全体の0.23%に過ぎないのです。
あるいはNSAIDsと鎮痛薬の合剤を知らず知らずのうちに服用してしまい、これによる消化管出血による死亡が増えていたのであろうということは想像に難くありません。2001年には、アメリカでは300億錠のNSAIDsが薬局で販売されましたが、処方されたNSAIDsは7000万錠のみ、つまり処方薬は全体の0.23%に過ぎないのです。
上記の様々な理由からFDAでは「アセトアミノフェン肝障害とNSAID関連胃腸障害・腎毒性について」という文書で「OTC薬、処方薬の複数のNSAIDsにより消化管出血や腎障害を起こすことはよく知られているため、薬剤師はすべてのNSAIDsを含む製剤の容器正面または外箱にNSAIDsを含むと明示すること、成分にNSAIDsを含むことを明示し、1回推奨用量、1日推奨用量を超えて服用しない、他のNSAIDsとの併用を避けることや腎障害を起こしうること」を患者に指導するよう2004年1月22日に各州の薬剤師会に勧告していました6)。これによって米国では一般市民でもNSAIDsという言葉を理解するようになって、NSAIDsによる死亡者は減少したのだと思われます。
DMM英会話でフィリピンの先生はNSAIDsという言葉は理解できませんでしたが、以外にもIbuprofen、NaproxenというNSAIDsの成分名やアセトアミノフェンの別名のparacetamolもふつうによく知っていたのは驚きでした。
引用文献
1) Lazarou J, et al: JAMA 279: 1200-1205, 1998
2)Singh G: System.Am J Ther 7: 115-121, 2000
3)Fries JF, et al: Gasteroentenology 96: 647-655, 1989
4)NATIONAL INSTITUTES OF HEALTH Pathways to Prevention Workshop: September 29-30, 2014
5)Sakamoto C, et al: Br J Clin Pharmacol 62:765-772, 2006
6)www.fda.gov/downloads/Drugs/…/UCM171903.pdf
◆連載◆16日目 ワルファリンとNSAIDsを併用してはいけない本当の理由
NSAIDsによる腎障害 ~Triple whammyを防げ~
16日目 ワルファリンとNSAIDsを併用してはいけない本当の理由
医師、薬剤師を含め多くの医療人が、ワルファリン服用者がNSAIDsを併用することによって重篤な消化管出血が起こる原因は、ワルファリンの抗凝固作用とNSAIDsによる胃障害・抗血小板作用による出血、つまり薬物動力学的相互作用と思っているかもしれません。これは確かにあります。また一部の薬剤師はワルファリンの蛋白結合率が99%以上と高いため、同様にほぼ90~99%以上の蛋白結合率で高用量のNSAIDsを併用することによって、ワルファリンの遊離型分率が上がるためと考えている方もいるかもしれません。
しかし現在の薬剤学的な考え方では遊離型分率が上がってもワルファリンの肝代謝が亢進し、組織移行性が高まることによる分布容積増大によって遊離型濃度は変化しないのです(当ブログの薬物動態学が苦手なあなたへ→4限目の理解度テスト5.「蛋白競合による副作用ってある?」を参照)。20世紀の薬剤学で習っていたワルファリンとNSAIDsのフェニルブタゾン(製造中止)やブコローム(パラミジンⓇ)は蛋白結合の競合といわれていましたが、現在ではフェニルブタゾンやブコロームによるCYP2C9を介するワルファリンの代謝阻害によると考えられています(表1)。ただし今もNSAIDsのピロキシカム(バキソⓇカプセル)の添付文書には、ワルファリンとの相互作用の機序について「本剤のヒトでの蛋白結合率が99.8%と高いため、ワルファリンの活性型が増加するためと考えられる。」と書かれていますが、表1の著者Rolan PEは「蛋白結合置換の相互作用、なんでこれらが臨床的に重要なの?」と述べています。

平田も病院薬剤師時代に、ワルファリン服用者にロキソプロフェンが併用されることによって、透析患者さんが消化管出血によって突然死したことを経験しました。その時のデスカンファレンスはとても沈痛だったことを覚えており、その時には薬物動力学的相互作用+蛋白結合の競合阻害を疑っていました。それ以来、透析患者のNSAIDsは胃への直接刺激の少ない坐薬の頓服処方に変更していただくことが多くなりました。
薬剤師として知っておくべきことは薬物動力学的相互作用だけでなく、NSAIDsの多くがCYP2C9で代謝され、ロルノキシカムはCYP2C9阻害薬でありS-ワルファリン濃度(AUC)を1.58倍上昇させる(ラセミ体で1.32倍)1)といったワルファリンとの薬物動態学的相互作用の問題です。イブプロフェン、インドメタシン、メフェナム酸、ピロキシカム、テノキシカム、セレコキシブもCYP2C9を阻害し、セレコキシブに関してはワルファリンの相互作用により重篤な出血の副作用を起こした報告があります2)。さらにわが国の報告では19人のワルファリン服用患者のセレコキシブ併用前のPT-INRが併用前1.53±0.43が、併用後2.18±1.01 に上昇した(P<0.01)といわれています3)。しかもセレコキシブの米国添付文書には「遺伝子型または他のCYP2C9基質(ワルファリン、フェニトインなど)の既往歴/経験に基づいて、CYP2C9のpoor metabolizersであることがわかっている、または疑われる成人患者では、推奨される最低用量の半分(変形性関節症で100mgを1日2回、関節リウマチでは100~200mgを1日2回)で治療を開始する。」と記載されていますが、わが国の添付文書には残念ながらここまで踏み込んだ記載はありません。
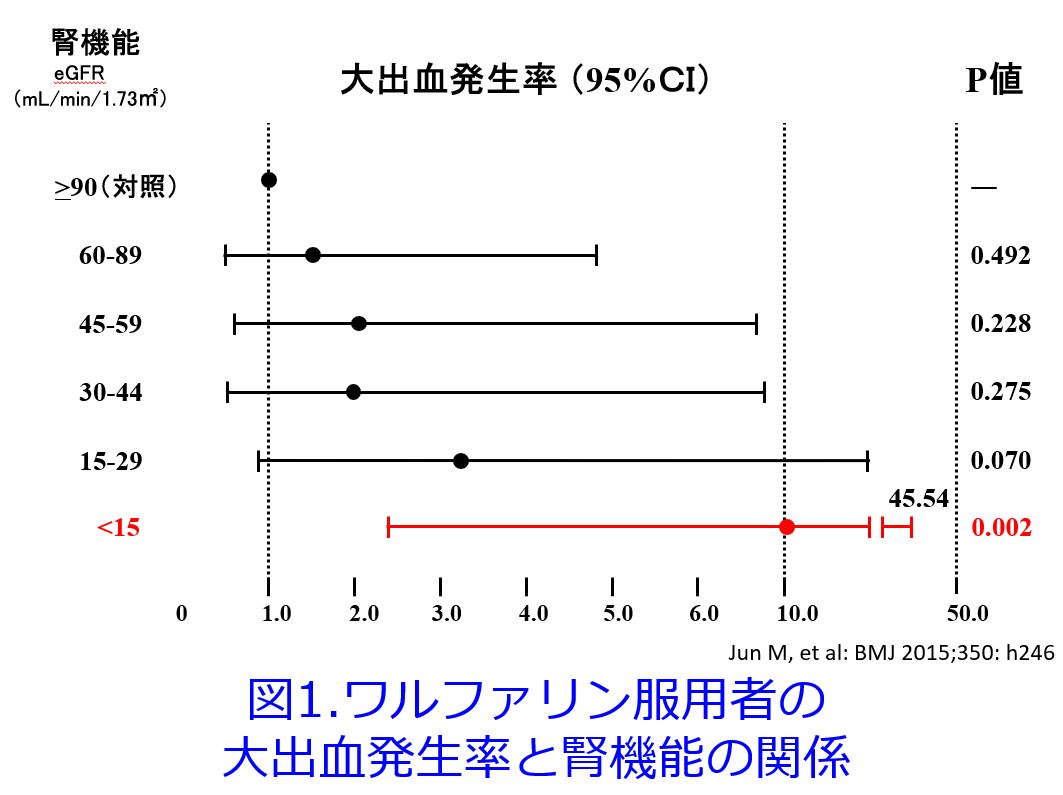
また、ワルファリン服用患者へのNSAIDsの投与は消化管出血のリスクを高めるため、極めて慎重であるべきであり、このような症例にはNSAIDsではなくアセトアミノフェンを併用していただきたいと切に思います。平田の米国での経験では、薬剤師の運営するAnticoagulation Clinicを訪れる患者さんの鎮痛療法はアセトアミノフェンばかりで、NSAIDsの処方は抗血小板薬としての低用量アスピリン併用例を除けば皆無でした。またワルファリン服用者の大出血は腎機能が悪化するほどリスクが高くなることが知られており、末期腎不全では有意に大出血発生率が上昇します(図1)4)、GFR<30mL/minではCYP2C9代謝が阻害されS-ワルファリン濃度が27%上昇し半減期が20%延長することも報告されています5)。そのためPT-INRの目標値は通常2.0~3.0ですが日本の高齢者では1.6~2.6、透析患者は2.0以下とされています。
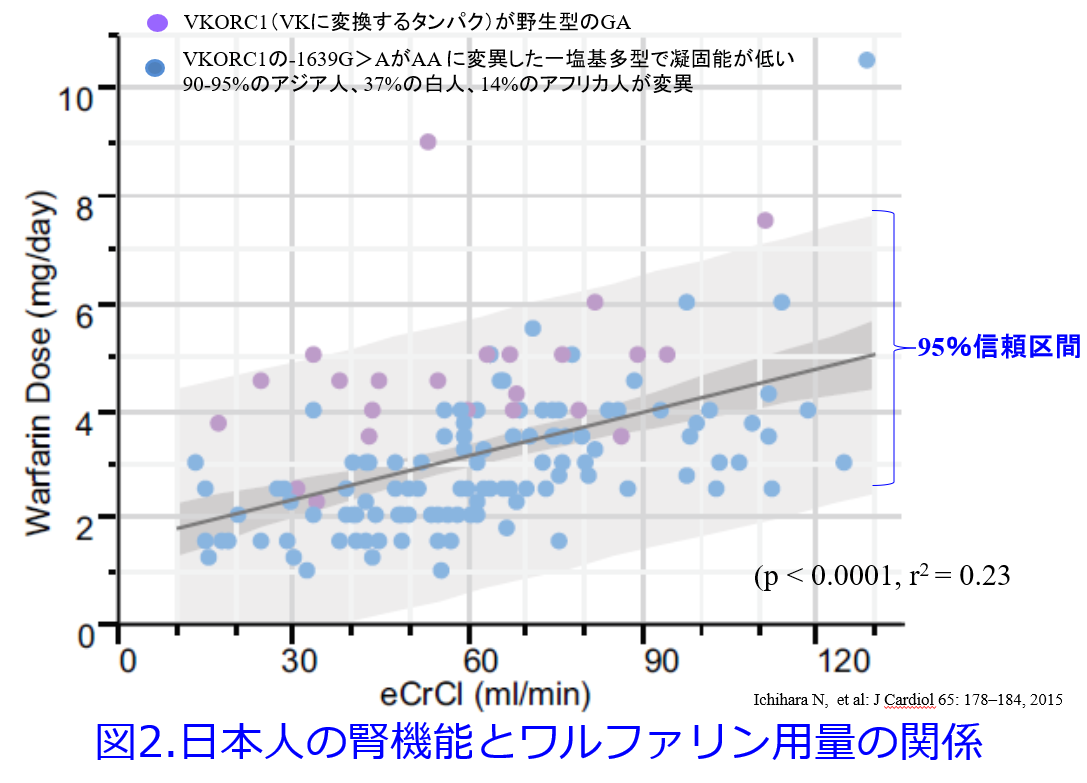
米国のAnticoagulation Clinicでは5mg/日を超えて投与されている患者さんが大半を占めていたのですが、もともと上記の理由により日本人のワルファリン用量は3.21±1.46mg/日と少なめです。この理由として最近になって日本人ではVKORC1の変異患者が多いことが明らかになっています(図2)6)。この報告ではVKORC1の遺伝子多型とともに日本人では腎機能の低下に伴い、ワルファリンの非腎クリアランスが低下しワルファリン用量を少なくしなくてはならないこと、野生型ではワルファリン用量が高めでであることを示しました(図2の紫色の〇)。
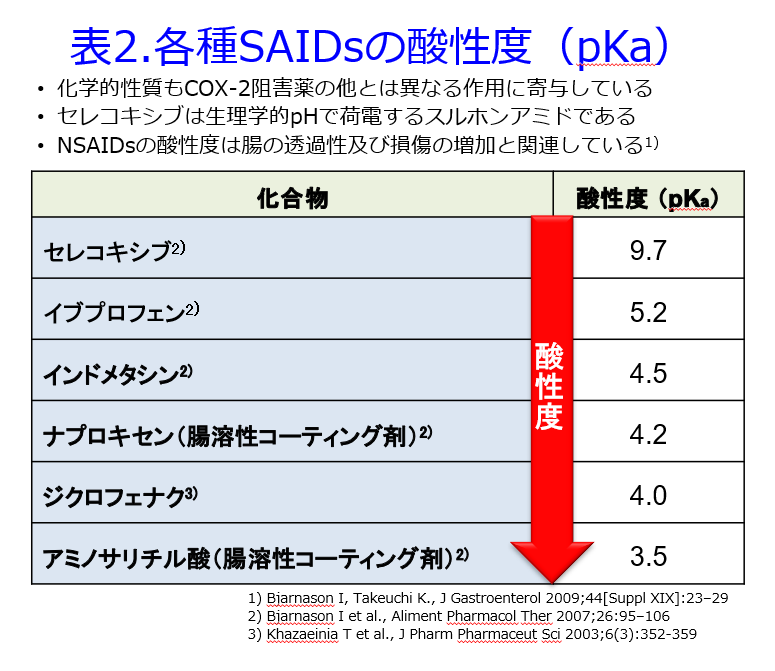
ここまでCYP2C9のことについて書いてきて、ふと気づいたのですが、イブプロフェン、インドメタシン、メフェナム酸、ピロキシカム、テノキシカム、セレコキシブなど多くのNSAIDsはCYP2C9の基質(ロキソプロフェンは不明)ですが、末期腎不全になるとCYP3A4も1A2も2C19も発現量が低下するのですが、最も顕著に低下するのがCYP2C9なのです7)。ひょっとしたら透析患者などの末期腎不全患者にNSAIDsを単回投与でなく、常用量で漫然投与すると代謝されないため、過量投与になり、中毒性副作用が起こりやすくなる、あるいはワルファリンの代謝をより強力に阻害して出血しやすくなることなどが考えられるかもしれません。これは平田の薬剤師の「気づき」です。NSAIDsの蛋白結合率はイブプロフェン99%、インドメタシン99%、メフェナム酸85-99%、ピロキシカム99%、セレコキシブ97%と極めて高いのですが、腎不全患者では尿毒素の蓄積と低アルブミン血症によって蛋白結合率が低下しますが、これによる薬効増強はないことはすでに説明しました(当ブログの薬物動態学が苦手なあなたへ4限目参照)。しかしこれだけ蛋白結合率の高い薬物の遊離型濃度を測定することは非常に難しそうです。しかも尿を濃縮して排泄することができない透析患者の血漿は夾雑物が多くて測定しにくいのです。どなたか分析技術の高い方を巻き込んで、末期腎不全患者の遊離型NSAID濃度は腎機能正常者に比し高いということを証明してもらえませんでしょうか?このネタなら英語論文になりますし、考察などは平田が協力させていただきます。
胃障害リスクはアセトアミノフェン、セレコキシブが+、他のNSAIDsは2+、そしてアスピリンは6+と評価されているのだから8)。「空腹時のNSAIDsの服用は消化管穿孔によって生命を危うくする行為」だということを知っていただきたい。透析患者の半数以上がPPIを服用するほど、胃が脆弱で、食事も満足に取れないのに痛みがあるとロキソニンⓇ錠などが処方されることが何度もあったが、胃障害の頻度が極めて高かったため、平田が薬剤師時代には特に高齢者では低用量のボルタレンⓇサポやインダシンⓇ坐薬などに変えてもらっていた。これだと胃への直接刺激を回避できるし、坐薬なので痛くないときには無理して挿入することがないので漫然投与も防げたのではないかと思う。
引用文献
1)Kohl C, Steinkellner M: Drug Metab Dispos 28: 161-168, 2000
2)Malhi H, et al: Postgrad Med J 80: 107-109, 2004
3)鈴木信也, 他:医薬品情報学18:35-241, 2016
4)Jun M, et al: BMJ 2015;350: h246
5)Albrecht D, et al: Thronm Haemost 117: 2026-2033,2017
6)Ichihara N, et al: J Cardiol 65: 178-184, 2015
7)Deri MT, et al: pharmacol rep 72: 1695-1705, 2020
8)Wells BG, et al ed: Pharmavotherapy Handbook sixth edition
◆連載◆15日目 NSAIDsのパップ剤や全身作用する貼付薬は安全?
NSAIDsによる腎障害 ~Triple whammyを防げ~
15日目 NSAIDsのパップ剤や全身作用する貼付薬は安全?
モーラスⓇテープなどのいわゆるNSAIDsの貼付薬ではどうなのか?これについてはよく質問を受けますので考察してみましょう。医学中央雑誌ではロキソプロフェン×AKIで88件ヒットしましたが(2021年8月12日の調べ、以下も同じ)、パップ剤に関しては間質性腎炎を含む報告が少数例あるのみです。ロキソプロフェンテープ×AKIは0件でロキソプロフェンパップ×AKIは0件。ただし局所パッチ剤での間質性腎炎の症例報告がありました(Int Med 53: 1131-1135, 2014)。
ではモーラスⓇで有名なケトプロフェンパップはケトプロフェン×AKIで35件(AKI症例はなし)、ケトプロフェンパップ×AKIで0件、モーラスⓇ×AKIでは34件ヒットしましたがAKIの報告なし。ケトプロフェンテープ×AKIで1件だけですがAKI症例ではなくkey wordsに入っていただけでジェネリックの製剤についてのものでした。
胃障害についてはケトプロフェン経皮製剤大量使用(20 mg×8枚/日)による小腸出血が中止後に回復した報告がありますし1)、NSAIDs小腸による障害に関しては酸分泌抑制薬の併用は無効です2)。2年にわたり治癒が遷延した胃潰瘍が,ケトプロフェン経皮製剤(40 mg×4~6枚/日)の使用中止により2か月後に治癒したという症例があります3)。モーラステープの経皮吸収率はインタビューフォームによると69.7 %という、経口投与以上ではと思わせる高さです。テープを何枚も貼付すると内服薬カプセルの常用量である50mg連続投与時のAUCよりも高くなり、胃への直接刺激がないだけでもましではなく、胃潰瘍の原因になるということです。ロコアⓇテープでも出血性胃潰瘍の学会報告はあります。
ではロコアⓇテープなどの経皮吸収型NSAIDsで腎障害は起こりうるのか?インタビューフォームから血中濃度の推移を見てみましょう。図1に40mg単回投与時のエスフルルビプロフェン貼付薬と錠剤のフルルビプロフェンの血中濃度推移を示しますが、これは実は軸の幅が異なりますし、S体とラセミ体の違いがあります。
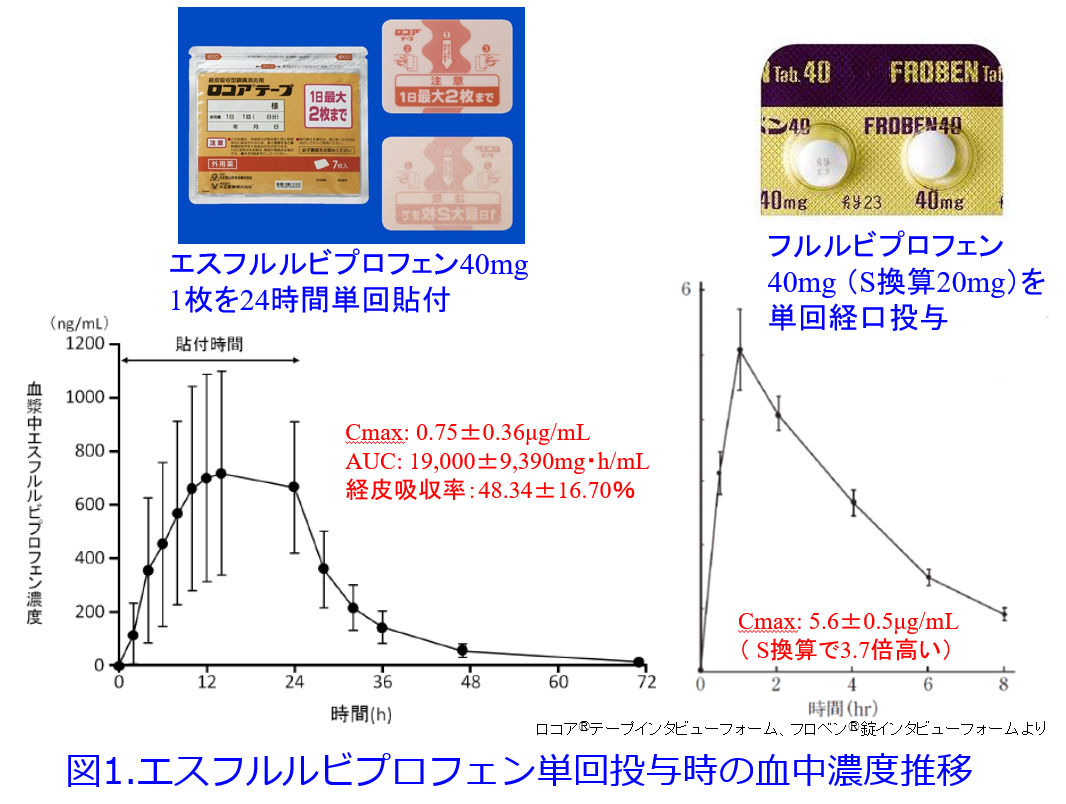
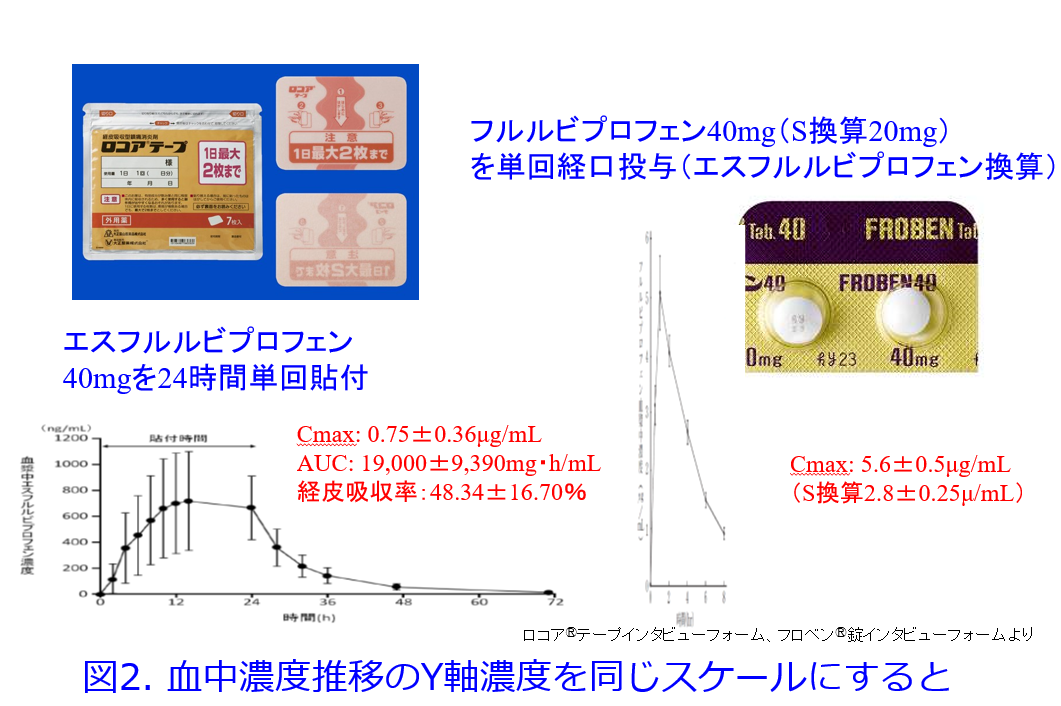
図2はエスフルルビプロフェン換算にした経口剤のY軸の血中濃度、X軸の時間のスケールを貼付薬に合わせたものですが、経口剤ではピーク濃度が高く、消失が早く、かたや貼付剤のピーク濃度は低く消失が遅いのが分かりますが、AUCはロコアⓇテープ2枚貼付時の全身曝露量がフルルビプロフェン経口剤の通常用量投与時と同程度に達します。
これまでの報告の多くで長時間作用型のNSAIDsはAKIを起こしやすいのではということに焦点を当てた検討はされていますが、短時間型のNSAIDsがAKIを起こしにくいという明確なデータはあまり見たことがありません。ロコアⓇテープによるAKIの報告は地方学会レベルの発表が1報、地域の医学雑誌に1報あります。
PubMed検索では「Esflurbiprofen patch×AKI」、「Ketoprofen patch AKI」では全くヒットしませんでしたが、「Loxoprofen patch×AKI」で76歳の女性でロルノキシカム投与によりネフローゼレベルの蛋白尿を伴う微小変化型の腎炎・間質性腎炎を発症した報告があります4)。ロルノキシカムの投与によってネフローゼを発症したのですが、中止により改善傾向だったところ、ロキソプロフェンパッチを投与すると、アルブミン尿が再燃し腎機能が悪化したという報告です。ただしステロイドなどの治療なしで投与中止のみによって回復しています(図3)4)。
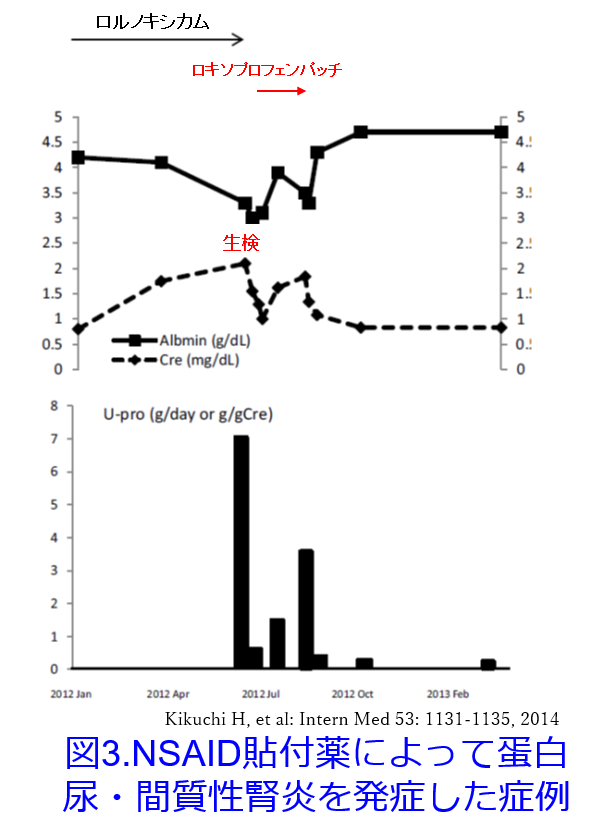
ロキソニンⓇパップ2枚を反復投与した時の活性体AUCは内服の37.6%、Cmaxは約20ng/mLとロキソニン錠活性体trans-OH体のCmax850ng/mLのわずか、2.3%しかありません。しかし特にアレルギー性の間質性腎炎、免疫系を介した蛋白尿など用量依存的でないAKIは無視できないように感じました。
例えば免疫チェックポイント阻害薬(ICI)を用いると免疫系が賦活化され、T細胞の免疫寛容の破綻を反映する尿細管間質性腎炎、糸球体障害による蛋白尿が起こりやすくなることが話題になっています。場合によっては透析をしてでもがんを治すべきか、がんが悪化してでも透析導入を避けるべきか、非常に苦しい選択を迫られることがあります。ICIによるAKIはNSAIDs、PPIの併用によって発症率が高くなるという報告もあり5)6)、特にNSAIDsが問題になっています。平田自身は局所作用する外用NSAIDsはAKIを起こしにくく、安心と思っていましたが、ICI投与時には、この考えは正しいとは言い切れません。報告はあまりされていないものの、外用であってもアレルギーや免疫系を介する腎障害に関しては、やはり安全とは言えないのではと思っています。13日目の図3のNSAIDsによる腎障害の③免疫反応が介在するポドサイト障害による微小変化型ネフローゼ症候群、膜性腎症などの糸球体障害、④アレルギー性間質尿細管性腎炎の発症は濃度依存的ではないため、NSAIDsを経口から貼付薬や外用薬に変更してもAKIを起こしうると思われます。
ただし高齢者で多いのは中毒性の①輸入細動脈収縮による腎前性AKI以外にも、様々なメカニズムでAKIを発症します。②尿細管を栄養する輸出細動脈の虚血による尿細管壊死(脱水状態が持続すると重篤化します)のメカニズムですから、高齢者に関しては吸収率の低い局所作用型のNSAIDs貼付薬は経口製剤に比べると腎障害のリスクは少なくなると考えられます。
引用文献
1)Hirose S, et al: Scand J Gastroenterol 53: 120-123, 2018
2)Maiden L, et al: Gastroenterology 128: 1172-1178, 2005
3)木本正英, 他: 日本プライマリケア学会 42: 158-161, 2019
4)Kikuchi H, et al: Intern Med 53: 1131-1135, 2014
5)Cortazar VB, et al: J Am Soc Nephrol 31: 435-446, 2020
6)Shirali AC, et al: Am J Kidney Dis 68: 287-291, 2016
NSAIDsによる腎障害 ~Triple whammyを防げ~
14日目 経口NSAIDsを使うとしたら腎障害の少ないエビデンスレベルの高いものは何?
経口NSAIDsとして使うとしたら腎障害の少ないものはあるのでしょうか?プロドラッグで腎におけるPG阻害の程度が他のNSAIDsと比べ軽いといわれていたクリノリル?(腎組織において再度非活性型に変換されるため、腎機能障害が少ないとされていた)やCOX-2選択性が高いとわれていたハイペン?などが、AKIを起こさないという確たるエビデンスがないのに、メーカーに騙されて使っている医師が多かったようですが、これは今も続いているようです。COX-2選択性阻害薬のセレコキシブに関しては腎障害が少ないという報告は筆者が検索しただけでも少なくとも6報ありました。腎障害患者にはアセトアミノフェンと並んで推奨できる可能性のある唯一のNSAIDとなるかもしれません。今回はそれらの論文を精査してみましょう。
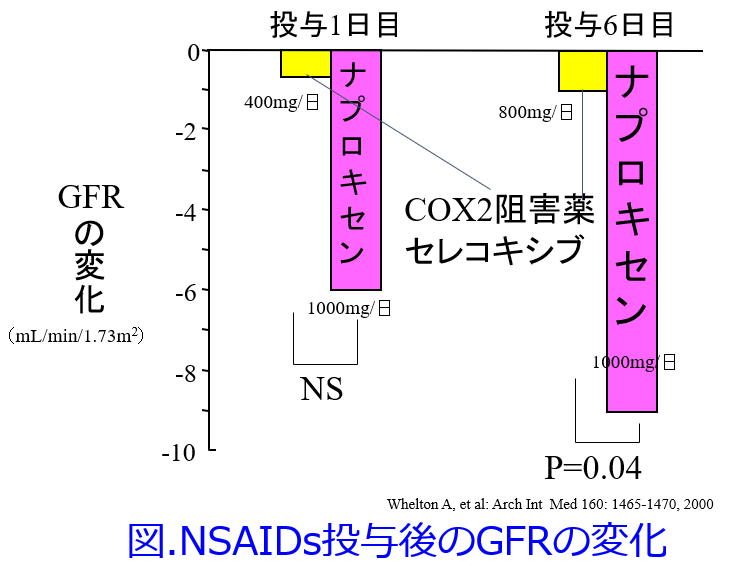
① 無作為化クロスオーバー単盲検比較試験でナプロキセン1000mg/日群に比しセレコキシブ800mg/日群では有意にGFR低下度が軽度であったが、セレコキシブ400mg/日群もGFR低下度が軽度ではあったが有意ではなかった(図)。Whelton A, et al : Arch Intern Med 160: 1465-1470, 2000
② 600人を対象にした無作為化二重盲検プラセボ比較試験でジクロフェナクでは有意な血清Cr値上昇を認めたが、セレコキシブでは差がなかった。McKenna F, et al: Scand J Rheumatol 30: 11-18, 2001
③ 腎機能の悪化リスク (2.38 rofecoxib vs 0.70 celecoxib; P < 0.01)、腎不全になるリスク(2.22 vs 1.09; P < 0.01)はrofecoxibに比し、セレコキシブで有意に低かった。Zhao SZ, et al: Clin Ther 23: 1478-1491, 2001
④ 19,163人のコホートスタディでセレコキシブはロフェコキシブに比し、末期腎不全に移行するリスクが有意に低かった。Kuo HW, et al: Drug Saf 19: 745-751, 2010
⑤ 44人の男性前立腺がん患者のコホートスタディ。セレコキシブ800mg/日の大量投与でもeGFRに変化がなかった。Benson P, et al: Clin Nephrol 78: 376-381, 2012
そして最後の論文は
⑥ 24,081人の患者を3種のNSAIDsにランダムに割り付けたPRECISION study(RCT)で重篤な腎イベントはイブプロフェン群(平均2,045±246mg/日で日本人用量の3倍以上)に比しセレコキシブ群(平均209±37mg)で有意に低かったが、ナプロキセン群(852±103mg/日)とは差なし。Nissen SE, et al: N Engl J Med 375: 2519-2529, 2016
ただし⑥の論文に関してはFunded by Pfizer(ファイザー社による資金提供で行った試験)でした。セレコキシブの平均用量は平均209±37mg(セレコキシブの最大用量は400mg/日ですが、400mgカプセルもあり、急性の痛みの管理と原発性月経困難症の治療のために、投与量は最初に400mgの後200mgを追加可能です。これは日米でほぼ共通です)でほぼ日本の常用量200mg/日と同じであったのに対し、イブプロフェンは600mg/日程度が日本の常用量なのに対し、平均2,045±246mg/日で日本人用量の3倍以上でした(イブプロフェンの最大用量は医療用で3,200mg/日、OTC薬で1,200mg/日)。これはいくら何でも明らかに日本に比しイブプロフェンの用量が多すぎなので、日本で応用できるとは思いません!しかもこの稿の①⑤の論文で使用しているセレコキシブは800mg/日と⑥のこの論文の4倍量でナプロキセンに有意差を付けてGFRの低下が軽減されたのです。⑥の大用量のイブプロフェンに比し、低用量のセレコキシブの方が腎障害が少なくなるのは当たり前ではないでしょうか。それにしても2,000mg/日を超える投与量のイブプロフェンと比較するなんて、意図的じゃないのかな・・・。日本ではイブプロフェンは比較的安全性の高いNSAIDと思われていますが、米国では日本の常用量の5倍用量以上の投与が可能なので他のNSAIDsと同じ扱いでした。イブプロフェンはマイルドなイメージで安全なのではなく、日本人用量が少なかっただけだと今は思っています。
COX-2選択的阻害薬の第1号のrofecoxibは世界中で、8,000万人以上の人々使われブロックバスターになりましたが、88,000~140,000例の重篤な心臓病が発生して市場から撤退しました。しかもメーカーのメルク社はこれらのリスクに関する情報をキャッチしていながら、公表を差し控えたことが明らかになり、大問題になりました。セレコキシブも同じCOX-2選択的阻害薬ということで、疑念がかけられましたが、8,246,403人の大規模研究ですべてのNSAIDsを総合すると心不全の入院リスク入院が24%増加している中で、セレコキシブが一般的な服用量で心不全のリスクを高めたという根拠がないことが明らかになりました(図2)1)。
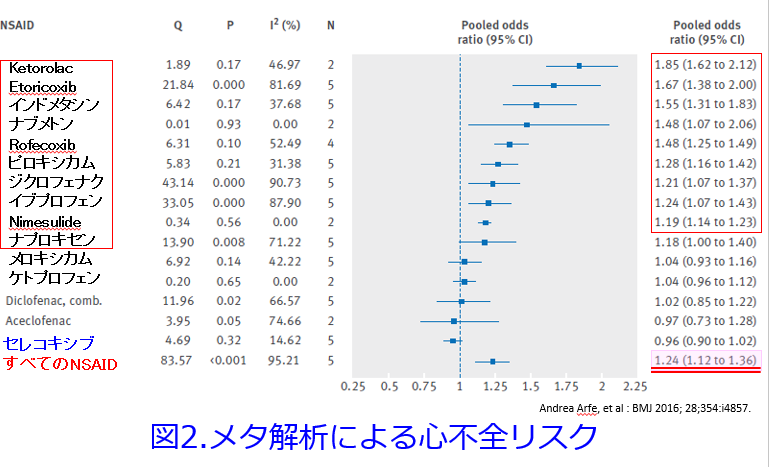
ジクロフェナクについてはあまり良い報告がありません。NSAIDs使用開始から30日以内のMACE(主要な心血管イベント)発症率を比較するとイブプロフェン群、ナプロキセン群に比し有意に発生率が高いという報告2)、ジクロフェナクは1日投与量の2倍で心不全リスクが2倍以上になるという報告1)、ジクロフェナク服用30日以内の心血管リスクはNSAIDs非投与群に比しすべてのMACEの発症率が有意に高く、アセトアミノフェンに比し、主要心血管病変の発症率が有意に高く、イブプロフェン、ナプロキセンに比しMACEの発症率が有意に高いことなどが報告されています3)。
引用文献
1)Andrea Arfe, et al : BMJ 2016; 28;354:i4857.
2)Schmidt M: BMJ 2018 Sep 4;362:k3426. doi: 10.1136/bmj.k3426.
3)Carter S, et al: JAMA Network Open. 2018;1(3):e180756. doi:10.1001
◆連載◆13日目 NSAIDsの腎障害は腎前性腎障害(腎虚血)だけじゃない
NSAIDsによる腎障害 ~Triple whammyを防げ~
13日目 NSAIDsの腎障害は腎前性腎障害(腎虚血)だけじゃない
~ 4種類のAKIと1種類の慢性腎不全 ~
薬剤性AKIの原因薬物のワースト3はほとんどの報告でNASIDs、抗菌薬、抗がん薬で、その中でもNSAIDsは抗菌薬と常に1位、2位を争うほど薬剤性AKIの原因薬物として頻度が高いのです(図1)1)。
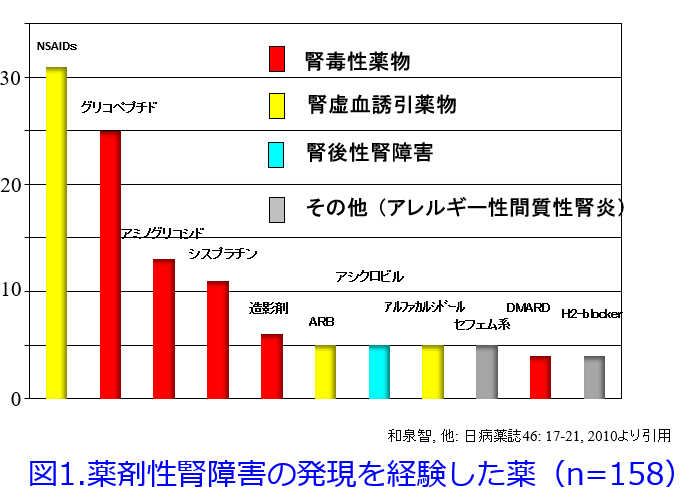
ただし高齢者を対象とすると脱水による腎虚血を来たしやすいためNSAIDsが薬剤性腎障害の原因薬物のトップになります2)。腎機能が低下しているCKD患者ではレニン‐アンジオテンシン-アルドステロン系(RAAS)や交感神経系が亢進して腎機能の低下を食い止めています。これにより糸球体過剰濾過が起こり、腎の仕事量増大によってネフロン数は経時的に低下する状態にありますが、PGI2やPGE2やヒト心房性利尿ペプチド(hANP)などの血管拡張物質によって腎機能の悪化を食い止めているのです。
NSAIDsによる薬剤性腎障害のメカニズムはシクロオキシゲナーゼ(COX: cyclooxygenase)の阻害を介してPGの生合成を阻害する薬理作用に起因します。PGI2やPGE2は血管拡張物質ですが、これらの産生を低下させることによってNSAIDsは輸入細動脈の血管を収縮させ、腎血流の低下から、GFRの低下をもたらします(図2)3)。
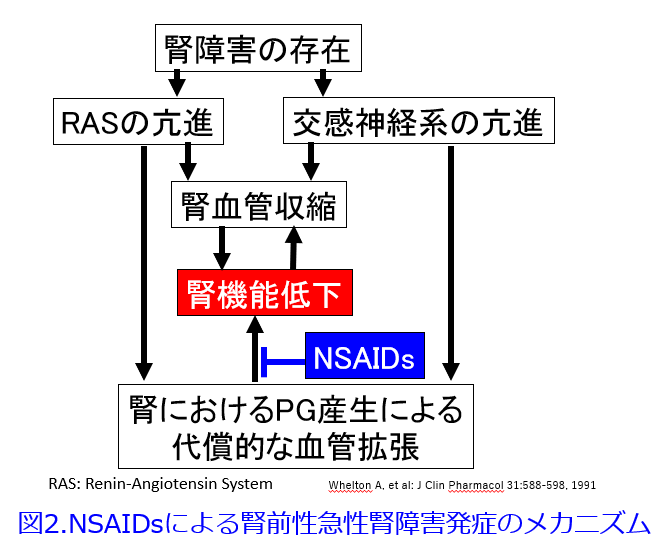
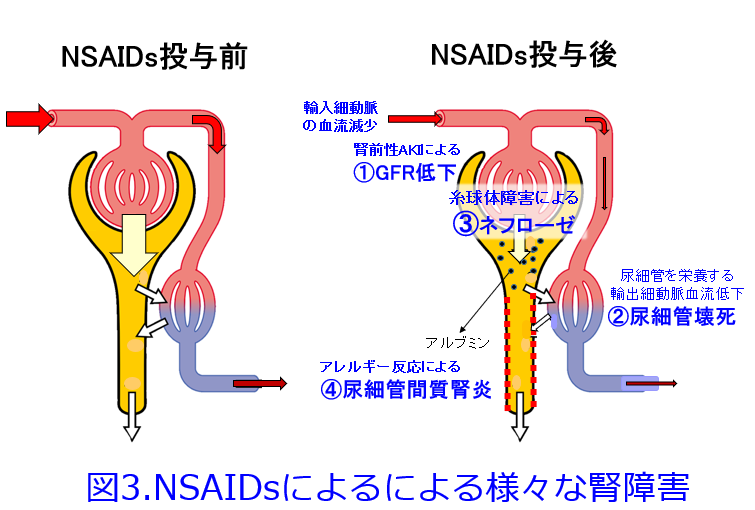
NSAIDsは上述のような①輸入細動脈収縮による腎前性AKI以外にも、様々なメカニズムでAKIを発
症します。②尿細管を栄養する輸出細動脈の虚血による尿細管壊死(脱水状態が持続すると重篤化します)、③免疫反応が介在するポドサイト障害による微小変化型ネフローゼ症候群、膜性腎症などの糸球体障害、④アレルギー性間質尿細管性腎炎(図3)、さらにこれまで紹介したAKIではなく、慢性腎不全に至るのがOTC薬のアスピリン+アセトアミノフェンなどの鎮痛薬配合剤の長期大量連用による腎乳頭壊死(鎮痛薬腎症)があります。
米国老年医学学会の疼痛治療ガイドラインでも非選択性NSAIDs、COX-2選択的阻害薬は極めて厳重に注意して投与すべきであり、特殊な症例を除いて投与してはならない(質の高いエビデンス、強力に推奨)となっています4)。高齢者の持続的な痛みに対する初期および持続的薬物療法、特に筋・関節痛に対してはアセトアミノフェンを推奨(効果および安全性に関して質の高いエビデンスがあり、強く推奨)しています5)。ただしアセトアミノフェンは肝不全には禁忌、アルコール中毒・肝障害には慎重投与で1日投与量は4gを越えないことが肝要です6)。
COX-2は炎症時に産生され、血管内皮や平滑筋、糸球体に限局して発現し、血管透過性亢進、発熱、痛みの発生に関与しているため、抗炎症作用のみを期待するにはセレコキシブ、メロキシカム、エトドラクなどの選択的COX-2阻害が望ましいことが期待されています。しかしCOX-2は例外的に腎臓と脳では構成型酵素であるためCOX-2選択的阻害薬でも腎障害が非選択性NSAIDsと同様に起こると考えられています。ただしCOX-2選択的阻害薬の中には多くの論文で、他の非選択的NSAIDsよりも腎障害を起こしにくいという報告があるものがあります。それは次回に解説させていただきます。
引用文献
1)和泉 智, 他 日本病院薬剤師会雑誌, 46: 17-21, 2010
2)Baraldi A, et al: Nephrol Dial Transplant, 13: 25-29, 1998
3)Whelton A, et al: J Clin Pharmacol 31:588-598, 1991
4)American Geriatrics Society Panel on Pharmacological Management of Persistent Pain in Older Persons: J Am Geriat Soc, 57: 1331-1346, 2009
5)Swan SK, et al: Ann Intern Med, , 133: 1-9, 2000
6)Henrich WL, et al: Am J Kidney Dis 27: 162-165, 1996
◆連載◆12日目 Triple whammyによる脱水を早期発見せよ
NSAIDsによる腎障害 ~Triple whammyを防げ~
12日目 Triple whammyによる脱水を早期発見せよ
Triple whammyによる腎機能の悪化は脱水の早期発見で悪化を食い止めることが可能です。ではどうやってこれらの腎前性AKIの診断をしているかというと、血清クレアチニン値の上昇、尿量の減少はすべてのタイプのAKIの診断基準ですが、最も正確な腎前性AKIのマーカーは尿中Na排泄分画(FENa: fractional excretion of sodium米国人はフィーナと発音する)が1%未満、あるいは尿中Na濃度の低下、
尿浸透圧の上昇などで鑑別できるという検査です(表1:このような一覧表はこのブログのカテゴリ→育薬に活用できるデータベース→薬剤性腎障害で印刷も可能です)。
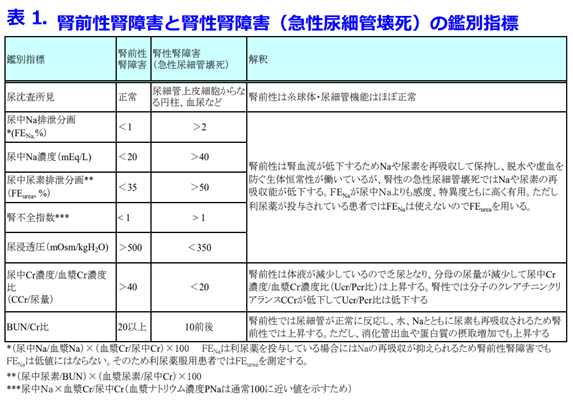
尿中Na排泄分画=(尿中Na/血漿Na)×(血漿Cr/尿中Cr)×100 で示されますが、Triple whammyには利尿薬が含まれますので、Naの尿中排泄が増えるのが当然ですから、利尿薬併用者では特異度の高いFENaが信頼できないためFEurea(尿中尿素排泄分画:35%未満で腎前性、50%以上で腎性腎障害を疑う)を測定しますが、このような尿検査は腎臓内科以外ではあまりやりません。
そのためより簡易な腎前性AKIのマーカー(脱水のマーカー)としてはBUN/Cr比>20が使いやすいと個人的には感じております。通常はBUN/Cr比は10程度ですが、脱水になると20を超えます。ではCrに比べて尿素濃度だけが上がるのはなぜだかわかりますか?Crは尿細管からわずかに分泌されますが、再吸収されないため、生体内物質で最も優れた腎機能マーカーですが、尿素もCrと同様に窒素老廃物として尿中に排泄されますが、再吸収されてしまうのです。脱水時に腎臓は尿量を減らして、脱水を防ぎます。その時にCrは全く再吸収されませんが尿素は水・Naとともに再吸収されるため、Crは上がらないのに、BUNのみ上がってBUN/Cr値が通常、10だったのが20を超えてしまうということで、BUN/Cr>20が脱水のマーカーとなるのです。
病院薬剤師であれば検査値で脱水が分かるため、医師に輸液を依頼すれば済むことですが、検査データの得られない保険薬局で脱水を早期にキャッチする方法をご存知でしょうか?一番簡単な方法は爪毛細血管再充満時間≧2秒です(3秒という人もいますが原著論文では2秒だったと思います)。これは片方の人差し指を5秒間圧迫すると、つめの色はピンク色から白色になりますが、圧迫を解除しても2秒以上白色のままだと特異度95%で脱水を疑えます。そして口腔内を観察させていただくと、唾液がなく口腔粘膜乾燥があれば感度85%で脱水が疑われるので、この2つを組み合わせると非常に高い精度で脱水を発見できます(表2)1)。
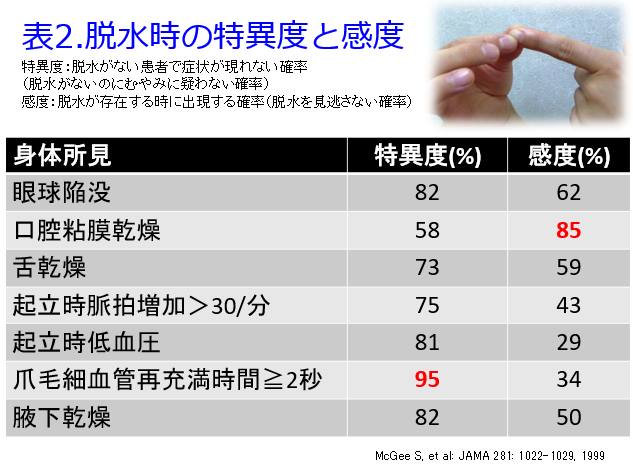
もともと大災害や大事故などの時に大量の救急患者が押し寄せた時に、どの患者をICUに入れるかを決める簡易な判断として、爪毛細血管再充満時間≧2秒を使っていたそうです。これが2秒以上だと循環機能が低下しているため優先的にICUに入れるというトリアージに有用だとされています。この簡単な検査をMcGeeが脱水に使えることを明らかにしました1)。もっと簡単なのは体重減少や血圧の低下ですので、保険薬局には体組成も測定できる体組成計や血圧計を置いておくべきでしょう。
著名な輸液の専門家は皮膚の張り(ツルゴール)の低下が脱水の良いマーカーになることで推奨しています。手の甲をつまんでピラミッドを作ると速やかに元に戻るのですが、脱水をきたすとピラミッドがそのままになります(図)。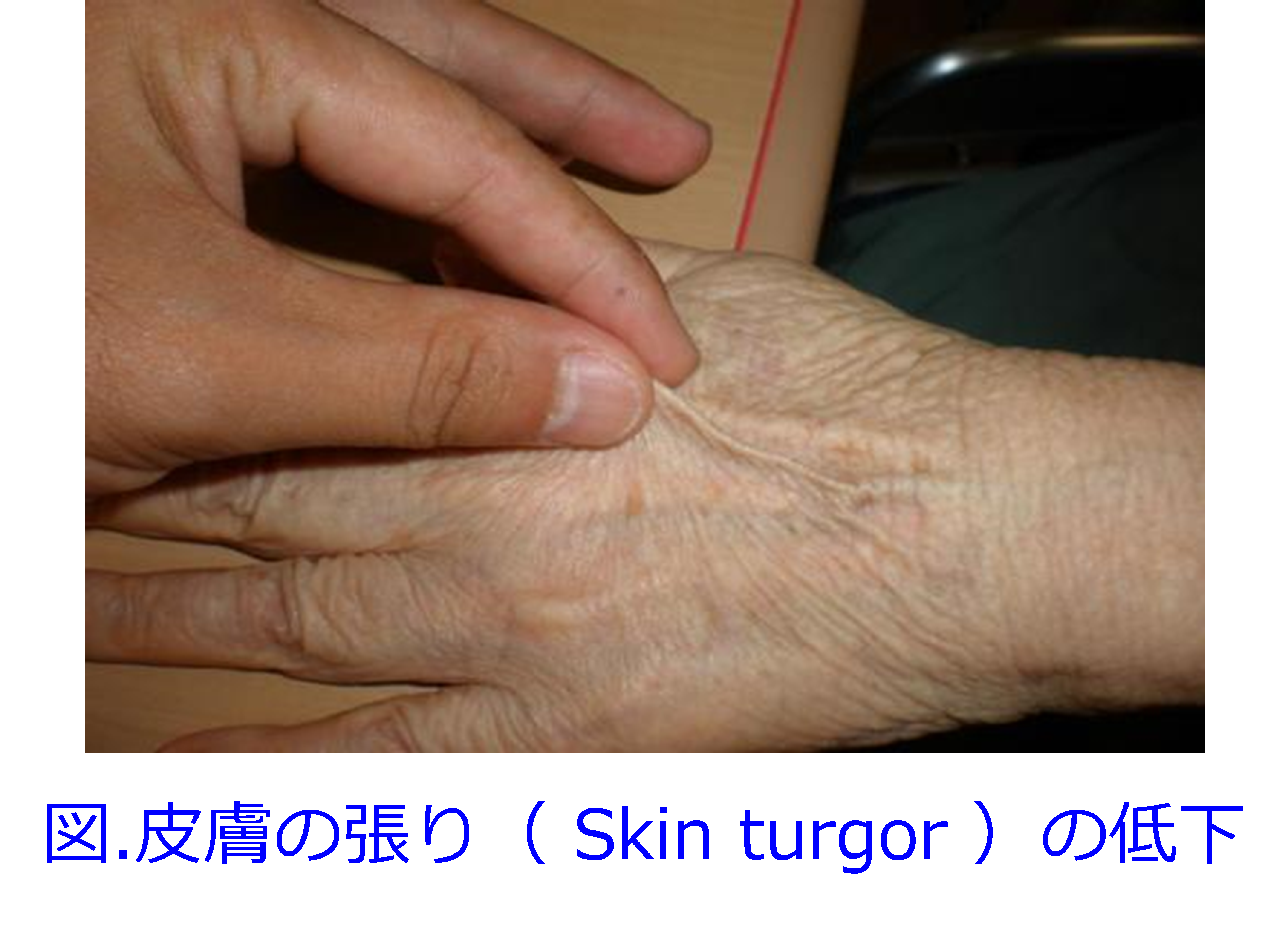 ただし高齢者はしわが多いのでもともとツルゴールが低下している方もいるそうですが、これらの簡単な脱水の見分け方は、患者さんやその家族の方に覚えていただいてもいいのではないかと思っています。
ただし高齢者はしわが多いのでもともとツルゴールが低下している方もいるそうですが、これらの簡単な脱水の見分け方は、患者さんやその家族の方に覚えていただいてもいいのではないかと思っています。
脱水になりやすいリスクを持っている患者さんはもともと腎機能が低下しているCKD患者、高血圧患者、糖尿病患者、高齢者で起こりやすく、脱水状態(下痢・嘔吐、夏季の発汗、発熱、感染症、食べられない、起立性低血圧、腋下乾燥、口腔内乾燥、急激な体重減少)、そして薬剤についてはTriple whammyなど、詳しくは1日目の表. NSAIDsによる腎前性急性腎障害の危険因子が参考になります。
引用文献
1)McGee S, et al: JAMA 281: 1022-1029, 1999

