2015年11月
論文・学会発表実績を更新しました
2015年度の論文実績、学会発表実績を更新しました。
詳細はコチラ ⇒ 熊本大学薬学部臨床薬理学分野HP
◆連載◆腎機能評価の10の鉄則 2日目
2日目ですね。最初に各種腎機能パラメータにはどのようなものがあり、どのよう使い分ければよいのかについてまとめてみたいと思います。
腎機能の見誤りによって腎排泄性経口抗凝固薬による出血死、腎排泄性抗がん薬による骨髄抑制による敗血症死など、重篤な有害反応が現れることがあります。あるいは腎毒性のある抗菌薬の過量投与によって腎機能が急激に悪化し透析導入になることもあります。腎機能の正しい見積もりは中毒性副作用によって死に結びつく腎排泄性ハイリスク薬の投与設計はもちろん、高度腎機能低下患者・末期腎不全患者の中毒性副作用腎毒性の防止、あるいは「腎障害に禁忌」の腎機能を正しく判断する際にも必ず身につけておきたいものです。
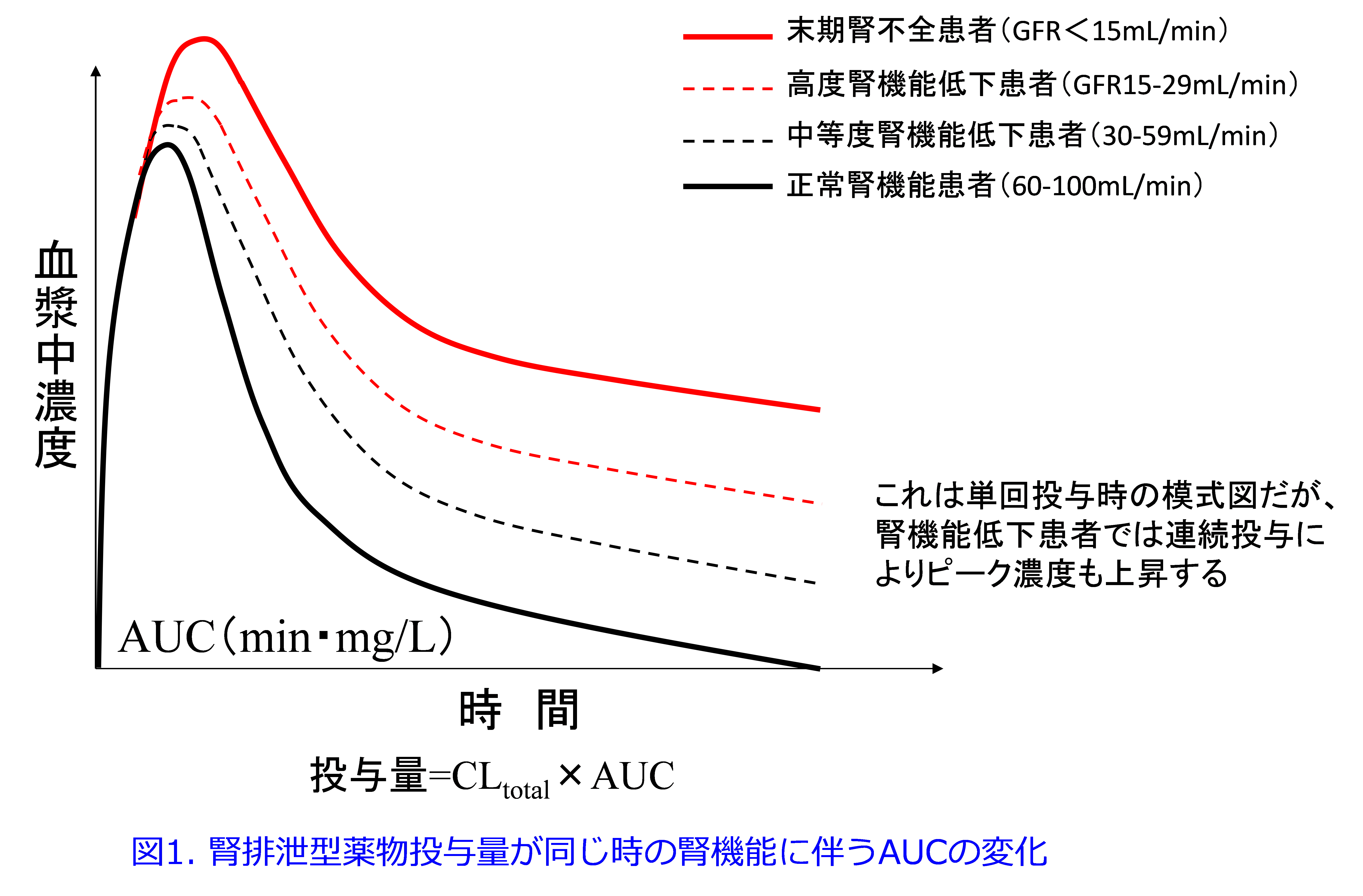
AUCで表す薬物の血中濃度は投与量が同じであれば総クリアランス(CLtotal)に依存します。
投与量=CLtotal×AUC
腎排泄型薬物のクリアランスは患者の腎機能、つまりGFR(mL/min)と相関します。すなわちGFR(mL/min)が低下すれば腎排泄型薬物の血中濃度が上昇し、中毒性副作用が起こりやすくなります(図1)。腎機能低下患者では腎機能が低いほど、または薬物(活性体)の尿中排泄率が高いほど、1回投与量を減量するか投与間隔を延長する必要があります。そのため患者の腎機能を正確に評価し、薬物の活性体の尿中排泄率を把握することは非常に重要です。
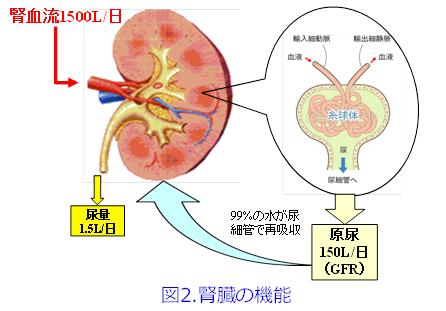
腎臓は1個100~150g程度と体重の1%に満たないのに循環血(心拍出量5L/min;7,200L/日)の20%、つまり約1,500L/日の血流量があります。そのうち10%が細動脈から成る糸球体で濾過されて、つまり約150L/日の原尿が産生されます。そのうち99%の水分、必要な栄養素を再吸収し、不必要な生体内物質を尿細管分泌して1.5L/日の不要な濃縮尿を生産しています(図2)。
時間当たりの原尿の産生速度が腎機能、すなわち糸球体濾過量(GFR: glomerular filtration rate)として表されます。つまり150L/日≒6L/hr=100mL/min=GFRとなり、GFRの正常値は100mL/minです。イヌリンクリアランス(GFR)で用いるイヌリンは生体内で代謝されず、タンパクと全く結合せず、完全に糸球体濾過され、尿細管で全く再吸収も分泌もされないため糸球体濾過量のgold standardになります。チオ硫酸Naや造影剤のイオヘキソールなどでもほぼGFRに近い値が得られますが、クレアチニン(Cr)は生体内物質のため、薬物を静注投与する必要がないのでより簡便に腎機能を測定できます。またCrは産生速度が一定で、代謝されることなく、タンパクと結合せず完全に糸球体濾過され、尿細管で再吸収されますが、わずかに尿細管分泌されるため、GFRよりも20~30%高めの値になります(図3)。
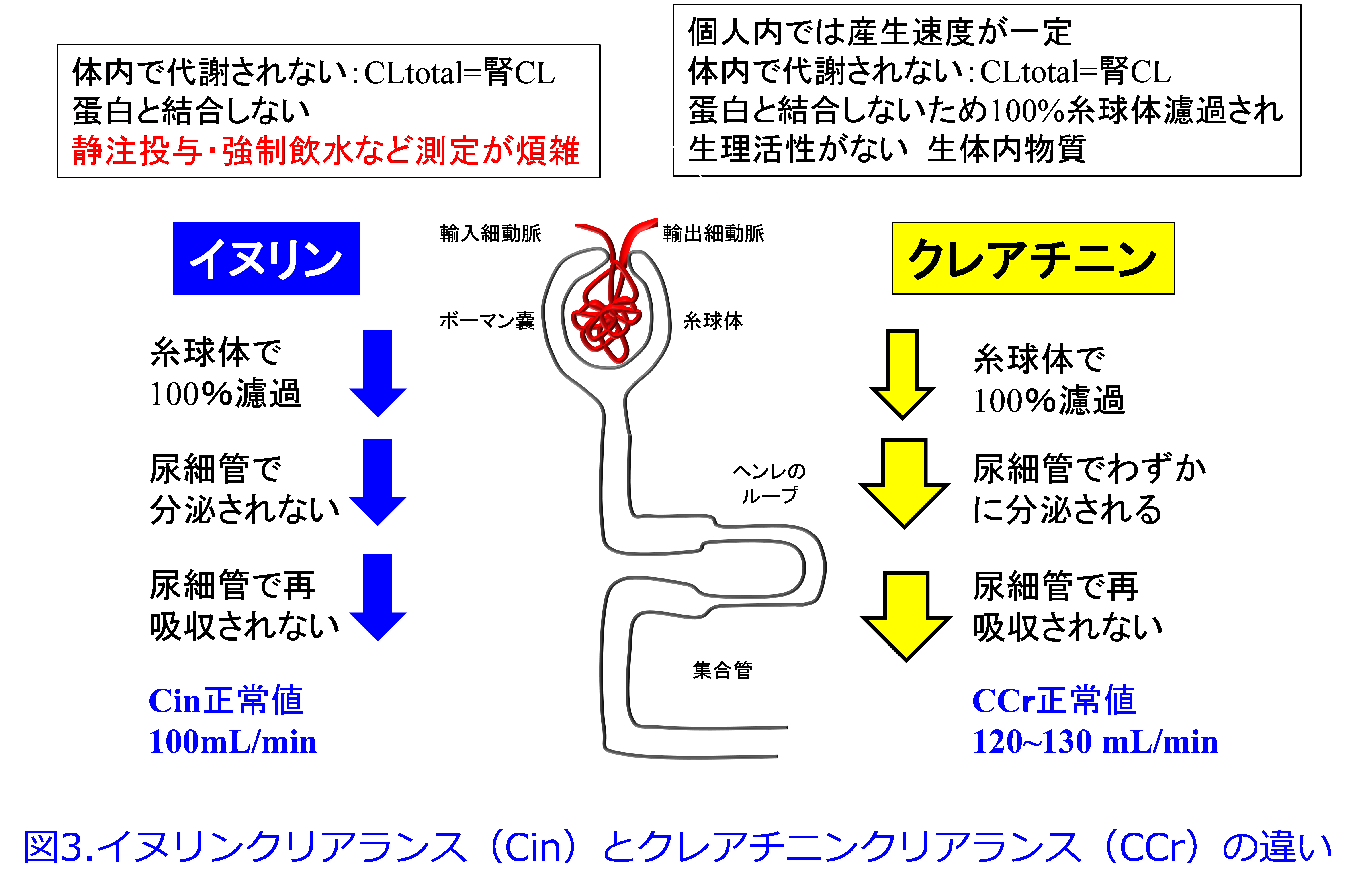
古い論文や教科書ではCrは腎機能が悪化すればするほど尿細管分泌の寄与が増すと言われていましたが、実際にはその寄与は小さく、腎機能が悪化すればゼロに収束するため、投与設計上、大きな問題にはなりません。しかしCockcroft & Gault(CG)式による推算CCrはGFRより高値になるので0.789倍し(若年者のみ)、 GFRとして評価できます。
一般的に、簡易に腎機能を評価するには日本人向けGFR(糸球体濾過量)推算式が用いられます1)。ただし通常、検査箋に書かれている推算GFR(eGFR)の単位はmL/min/1.73m2になっており、これはCKDの診断指標のために作られたものです(たとえばeGFRが40mL/min/1.73m2であればCKDステージG3bというように(図4))。
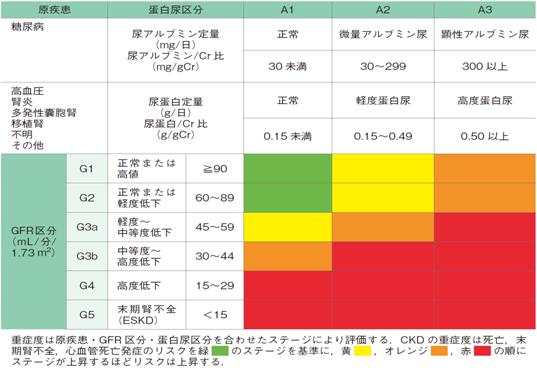
図4. CKDの重症度分類 (CKD診療ガイド2012)
薬物投与設計に用いる腎機能は日本人向けGFR推算式で体表面積補正を外したもの、あるいはCG式を用いた推算CCrを用います。
日本人向けGFR推算式(18歳以上の成人が対象であり、小児には適用できません)。
eGFR (mL/min/1.73m2)=194×Cr-1.094×Age-0.287×0.739(女性)
CG式を用いると2)
薬物投与設計にはeGFR(mL/min/1.73m2)の体表面積補正を外すために、患者の体表面積を算出して補正を外し、eGFR (mL/min)として評価する必要があります。また逆に実測CCr(mL/min)は体表面積されていないので、日本の多くの病院の検査室や検査センターではCKD診断指標にするため、患者の体表面積を算出して体表面積補正CCr(mL/min/1.73m2)とする慣習が今もなお残っています。これも薬物投与設計時には未補正値にする必要があるのと、0.715倍するとGFRに換算して評価できます3)。
体表面積を算出するDu Boisの式4)
BSA(m2)= 体重(kg)0.425 × 身長(cm)0.725 ×0.007184
体表面積未補正eGFRは以下の式で求められます。
体表面積未補正eGFR=体表面積補正eGFR×BSA/1.73
引用文献
1)Matsuo S, Imai E, Horio M, Yasuda Y, Tomita K, Nitta K, et al: Revised equations for estimated GFR from serum creatinine in Japan. Am J Kidney Dis 2009; 53: 982-992.
2)Cockcroft DW, Gault MH: Prediction of creatinine clearance from serum creatinine. Nephron 16: 31-41, 1976
3)日本腎臓学会編: 腎機能の評価:成人. CKD診療ガイド2012, P1-4東京医学社, 東京, 2012
4)Du Bois D, Du Bois EF; A formula to estimate the approximate surface area if height and weight be known. Nutrition 5: 303-313, 1916
ただし以下の2項目は予測式の元になる血清Cr値に影響しますので、覚えておいてください。
①血清Cr値には10%程度の日内変動があり(朝が高い)、0.1mg/dLの差が推算値ではCCrやGFRで10mL/min前後の差になることがある(特に血清Cr値が低いときに推算値の差が大きくなる)。
②血清Cr値は肉の大量摂取時には上昇し、蛋白摂取制限時には低下する。
表.各種腎機能パラメータの正確性と特徴


「今日はここまで、それではまた次回お楽しみに!」
腎機能を正しく評価するための 10の鉄則 1日目
最近、薬剤師サロンへの問い合わせ、また私自身に来る講演依頼で最も多いのが「腎機能の評価の仕方について」です。ただし「腎機能を評価するのはCockcroft式を使ってCCrを求めたらいいじゃない?」という考えは腎排泄性のハイリスク薬に関して通じません。腎機能を正しく評価することはそんなに簡単ではありません。そこで・・・
本日より「腎機能を正しく評価するための10の鉄則」について連載したいと思います。
この作成には熊本済生会病院薬剤部の柴田啓智先生、熊本中央病院の宮村重幸先生にもお知恵を拝借しております。ではまず本日、1日目は「腎機能を正しく評価するための10の鉄則」の要約です。
◆10の鉄則
【 1 】 eGFRcreat、 CCrでmL/min/1.73m2は薬物投与設計に使わない。mL/minを使うが、抗菌薬・抗がん薬などで投与量がmg/kgやmg/m2となっている場合にはmL/min/1.73m2を使う。
【 2 】 今までの添付文書記載の腎機能として記載されているCCrはほとんどJaffe法による血清Cr値測定による。CCrJaffeはGFRと近似するため、薬物投与設計時の患者の腎機能は酵素法によるCCrEnzは用いずeGFR(mL/min)を使うか、CG式の血清Crに患者の(血清CrEnz+0.2)を代入して求めた推算CCrを使う。
【 3 】 CG式による推算CCrEnzは薬物投与設計には原則として用いないが、血清Cr値の低い痩せた患者にeGFRcreat推算式を使うと過大評価してしまう。そのため後期高齢者やがん末期などのフレイル症例にはeGFRcreatよりもCockcroft-Gault(CG)式による推算CCrEnzが適していることがある。
【 4 】 肥満患者の推算CCr算出のための体重は理想体重または標準体重を用いる。
【 5 】 高齢者のフレイルなど、腎機能予測式では正確な評価ができない症例には24時間畜尿による実測CCrEnz×0.715によりGFRとして評価すると正確な腎機能が得られる。畜尿CCrは畜尿忘れがないよう「畜尿忘れがあれば必ず伝えてください。正直に言ってくれないと薬が効かなくなる恐れがあります」と指導する。
【 6 】 血清Cr値が0.6mg/dL未満の高齢フレイル症例の腎機能推算式の血清Cr値として0.6mg/dLを代入すると予測性が高くなることが多い。ただし自分の目で症例の体格を確認すること。まれに痩せているがフレイルではなく活動的な症例の場合、腎機能がよい可能性がある。
【 7 】 60歳以下の腎機能正常者で全身炎症(SIRS)によりICU管理下で血管作動薬・輸液の投与を受けている患者ではeGFRが150~160mL/min/1.73m2に上昇することがある。これは過大腎クリアランス(ARC)により腎機能が高くなっており、血清Cr値は0.6未満になることもあるが、腎機能推算式や0.6mg/dLを代入するラウンドアップ法を使わず実測CCrの測定による腎機能の正確な把握が望まれる。
【 8 】 ST合剤、シメチジン、コビシスタットは尿細管におけるCrの尿細管分泌を阻害するため腎機能の悪化がなくても血清Cr値がわずかに上昇する。
【 9 】 軽度~中等度腎機能低下症例にはシスタチンCによるeGFRcysも推奨される。
【 10 】 上記の記載は腎機能低下患者にハイリスク薬を投与するとき、あるいは腎機能低下に伴いハイリスク薬になる薬を投与するときに考慮すべきものである。安全性の高い薬物では患者の腎機能にCCrEnzを用いても大きな問題はない。
◆附則
① ネフローゼ症候群などによる低アルブミン血症や糖尿病患者ではCrの尿細管分泌が増加し、腎機能を過大評価してしまう。
② 高齢者のeCCrEnzに0.789をかけない。 eCCrEnzに0.789をかけるのは若年者のみである。
eGFRcreat: Crを基にしたeGFR, eGFRcys: シスタチンCを基にしたeGFR, CCrJaffe: Jaffe法によって測定したCCr, CCrEnz: 酵素法によって測定したCCr

「今日はここまで、それではまた次回お楽しみに!」
アセトアミノフェン単独で腎障害は起こさない
CKD診療ガイドラインでのアセトアミノフェンの位置づけ
エビデンスに基づくCKD診療ガイドライン2009の21項「薬物投与」の3.消炎鎮痛薬に関してはアスピリンとアセトアミノファンが腎機能に及ぼす影響を検討した臨床研究はそれぞれ異なった結果を報告しているが、エビデンスレベルが低くその優劣はつけられないとし、(中略)今回のステートメントでは「CKD患者の腎機能障害の進行に関しては、安全性が確立された消炎鎮痛薬はなく、いずれの薬剤もできるだけ少量短期間の投与とする」とされている。エビデンスに基づくCKD診療ガイドライン2013でもこの内容は21項のCKDにおける薬物投与でCQ4「 NSAIDsはCKDの進展に影響を及ぼすか?」として取り上げられたが「CKDにおいては、いずれのNSAIDsも腎機能を悪化させる危険性がある。ただし、NSAIDsによる腎機能の悪化が長期的なCKDの進展に影響を及ぼすかは、明らかでない」としているものの、いずれのNSAIDsもアセトアミノフェンも腎機能に悪影響を及ぼす危険性があり、使用は最小限にとどめるべきとほぼ同内容になっている。
当然ながら、ガイドラインであるため、個々のエビデンスの高い原著論文を対象とした結果である。私のこれまでの考えも「NSAIDsを腎虚血を起こしやすいリスクの高い患者(CKD、心不全、高血圧、糖尿病、RAS阻害薬、利尿薬服用患者など)では腎虚血から速やかにGFRが低下し、漫然投与すると週・月単位で急性腎障害になる。かたやアセトアミノフェンはGFRを低下させることはないが、大量を漫然と投与すると年単位で鎮痛薬腎症により慢性腎不全に至り透析導入が必要になる」と考えていた。ただし、これらの報告はアセトアミノフェン単独服用によって慢性腎不全を起こすという報告はほとんどないのである。これに気付いたのは現在執筆中の日本医薬品安全性学会誌第1号に「NSAIDsとアセトアミノフェンの安全性について~特に腎機能障害に着目して~」という総説のために大量の論文を取り寄せ、特に出来のいい総説を含めて精査したことによる。
そもそも鎮痛薬腎症とは?
これらの報告は鎮痛薬腎症が、オーストラリアに次いで多いと言われたベルギーのアントワープ大学腎臓高血圧内科のElsevierのグループとCCr予測式のCG式で有名なカナダのSt John’s Newfoundland記念大学内科のGaultのグループの報告がやたらと多きことに気付くが、「鎮痛薬腎症とは何ぞや?」ということから調べてみた。
元来、フェナセチン含有鎮痛薬が原因と考えられていたが、フェナセチン製造中止後も発症しており、アセトアミノフェンを含む2種類の鎮痛薬(アスピリン)とカフェイン±コデインの配合剤が原因と考えられている。米国腎臓財団、ヨーロッパ科学者グループは鎮痛薬腎症は2つの鎮痛薬を含み、ほとんどがカフェイン±コデインからなる多種類の鎮痛薬製剤の過剰服用によって腎乳頭壊死と慢性間質性腎炎を起こす進行性の腎不全であると定義した。鎮痛薬腎症は乳頭壊死・慢性間質性腎炎を起こし、腎の疝痛、顕微鏡的血尿を伴うことが多いが、タンパク尿や尿量減少を呈する症例は少ない。60~75%に無菌膿尿、再発性の泌尿器感染を伴う1)。CTによる両側の乳頭部のでこぼこした形状と石灰化を伴う腎萎縮は鎮痛薬腎症の診断の決め手となる。特に両側の乳糖部石灰化の感度(92%)、特異度(100%)は高い2)。
アセトアミノフェンとアスピリンの服用により皮質および乳糖部で高濃度のサリチル酸(アスピリンの活性代謝物)がグルタチオンを枯渇させる(利尿薬併用により加速)。グルタチオンはアセトアミノフェンの毒性化合物 NAPQIの不活性化に必要なため、枯渇により脂質過酸化、臓器タンパクのアリル化を起こし、乳頭壊死、石灰化することが実証されている(図)3)。
鎮痛薬を少量、毎日服用しても鎮痛薬腎症を起こすには最低5年は必要であり、5年以下では起こらない4)。頭痛を持つ女性に多く、消化性潰瘍を含む上部消化管障害を併発しやすい5)。5~55年間、鎮痛薬を連用し、50~60歳で発症するが1)、緩徐にする腎障害で慢性腎不全(GFR15~30mL/min)になるまで症状は出ない6)。フェナセチンが製造中止になっても鎮痛薬腎症が起こるのに平均22年要するため7),製造中止しても直ちには鎮痛薬腎症は減らない8)。
鎮痛薬腎症の発症率は1970年代のオーストラリアでは22%と世界一であったが9)、1990年代初頭にはオーストラリア9%10)、ヨーロッパ3%H)、米国0.3%であり、国別ではオーストラリア、ベルギー、カナダで高い。少なくとも2成分の鎮痛薬を含むOTC薬の販売禁止によってオーストラリアの鎮痛薬腎症による透析患者数を減らせることができた。
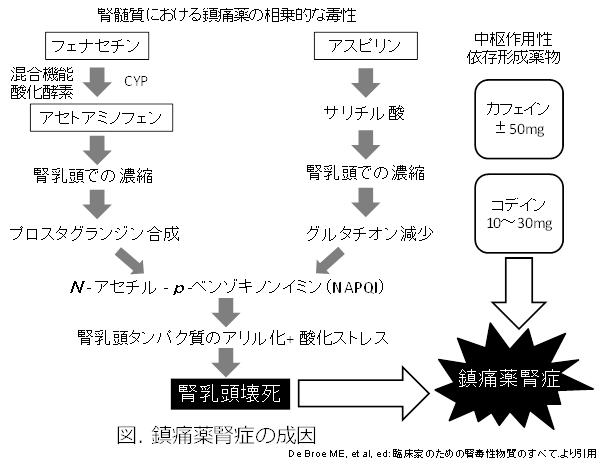
アスピリン、アセトアミノフェンの配合剤が鎮痛薬腎症を発症する
上記のことから鎮痛薬腎症にアセトアミノフェン+アスピリンの併用は必須である。上述のようにアスピリン、アセトアミノフェンの単独長期大量使用ではほとんど発症しない8)11)のであって、アスピリン、アセトアミノフェンの配合剤が鎮痛薬腎症を発症する。アセトアミノフェン単独で相対危険度3.2倍という報告12)もあるが、アスピリン服用者とフェナセチン+アスピリン+コデイン服用者のみで相対危険度が計算されている。またアセトアミノフェン年間服用量が366錠を超えると末期腎不全になるオッズ比が2.1倍に、あるいは生涯5000錠以上の服用でオッズ比が2.4倍になるという報告13)も他の鎮痛薬も含まれておりアセトアミノフェン単独の報告ではない。しかもこの報告では生涯NSAIDs服用量が5000錠以上で8.8倍になることも明らかにしている。
また驚くことに動物実験によっても鎮痛薬腎症については相反する報告があり、いまだに解明されていない14)のである。前章で示したようにアセトアミノフェン単独では鎮痛薬腎症は起こらず、アスピリンの配合が必須であり、さらに多くの鎮痛薬配合剤にはカフェイン±コデインの配合剤が多いのでこれも切り離して考えられないのである。
AAC処方・ACE処方は日本にもある。ただし鎮痛薬腎症は日本で起こるか?
となると日本で問題になるのはAAC処方であり、アセトアミノフェン+アスピリン+無水カフェインから成りOTC薬のバファリンプラスがまさにこの処方である。AAC処方にアリルイソプロピルアンチピリンを加えたものがエキセドリンA錠であり、これもAAC処方と言える。SG配合顆粒の成分はイソプロピルアンチピリン+アセトアミノフェン+アリルイソプロピルアセチル尿素+無水カフェインから成り、アスピリンは含まれていない。
もう1つ可能性がある日本のOTC薬としてACE処方がある。これはアセトアミノフェン+カフェイン+エテンザミドから成るが、エテンザミドも体内で代謝されサリチルアミドになり胃障害が少ないと言われている。AAC処方から成るOTC薬はセデスファースト、新セデス錠、ノーシン、ナロン錠・顆粒、サリドンエース、ハッキリエースなどがあります。医療用医薬品のセラピナ配合顆粒、ピーエイ配合錠などはACE処方+プロメタジンの配合された感冒治療薬である。ただしエテンザミドはあまり海外では使われていないのか情報に乏しく、PubMedで「analgestic nephropathy+ ethenzamide」で検索しても全く論文はヒットせず、薬剤性腎障害の原因になるかどうかは現時点ではわからない。

ただし上述のようにこれらの配合鎮痛薬の大量連日服用、それも最低5年は連日大量服用して50歳代~60歳代になって発症するということは日本で鎮痛薬腎症を見つけること自体が難しそうであり、本当に数年にわたりこれらを連日服用していればやめるように勧告したいが、皆保険制度の日本でこのような症例に出会うことはないのではないかとも思ってしまう。
やはり腎機能低下患者にはカロナールⓇが第一選択であり、アスピリンとの併用は避けよう
そろそろ結論に移ろう。今まで私は腎機能低下患者にはNSAIDsを漫然投与してはいけない。可能な限りNSAIDsは頓服として投与し、腎虚血リスクの高い患者(CKD、心不全、高血圧、糖尿病、RAS阻害薬、利尿薬服用患者など)には漫然投与は絶対に避けよう。そのような症例には十分量のアセトアミノフェンを使用しよう。効果がなければ外用パップ剤を併用しよう。痛みが強ければ弱オピオイドに使用もやむなし。という腎臓保護スタンスをとってきた。また米国腎臓財団が腎機能の低下した症例には優先的にアセトアミノフェンを使うことを推奨したため、優先的に投与されるアセトアミノフェンで透析導入に至るという報告はそれ自体がバイアスが強くかかっていると言ってきた。今回の調査でアセトアミノフェン単独使用は腎障害の原因にならない可能性がより強くなった。アセトアミノフェンは大量投与によって肝障害を起こす危険性があるが全般的にみて極めて安全性の高い薬剤である(表)。やはり腎機能低下した症例に推奨される鎮痛薬の第一選択薬はアセトアミノフェンであり、NSAIDsの漫然投与を避けるようやめようと声を大にして言いたい。またカロナールⓇとアスピリンの長期連日服用は鎮痛薬腎症の原因になりうることに留意されたい。
表.アセトアミノフェンの長所
 引用文献
引用文献
1)Elseviers MM, De Broe ME: Analgesic nephropathy: is it caused by multi-analgesic abuse or single substance use? Drug Saf. 1999 Jan;20(1):15-24.
2)Elseviers MM, De Broe ME: Is analgesic nephropathy still a problem in Belgium?Nephrol Dial Transplant. 1988;3(2):143-9.
3)Duggin GG: Combination analgesic-induced kidney disease: the Australian experience. Am J Kidney Dis. 1996 Jul;28(1 Suppl 1):S39-47.
4)Elseviers MM, Waller I, Nenoy D, Levora J, Matousovic K, Tanquerel T, Pommer W, Schwarz A, Keller E, Thieler H, et al. Evaluation of diagnostic criteria for analgesic nephropathy in patients with end-stage renal failure: results of the ANNE study. Analgesic Nephropathy Network of Europe. Nephrol Dial Transplant. 1995;10(6):808-14
5)Gault MH, Wilson DR: Analgesic nephropathy in Canada: clinical syndrome, management, and outcome.Kidney Int. 1978 Jan;13(1):58-63.
6)Rastegar A1, Kashgarian M: The clinical spectrum of tubulointerstitial nephritis. Kidney Int. 1998 Aug;54(2):313-27.
7)de Broe ME, Elseviers MM: Analgesic nephropathy–still a problem? Nephron. 1993;64(4):505-13.
8)Gault MH, Barrett BJ: Analgesic nephropathy. Am J Kidney Dis. 1998 Sep;32(3):351-60.
9)Nanra RS: Analgesic nephropathy in the 1990s–an Australian perspective. Kidney Int Suppl. 1993 Jul;42:S86-92.
10)Disney AP: Demography and survival of patients receiving treatment for chronic renal failure in Australia and New Zealand: report on dialysis and renal transplantation treatment from the Australia and New Zealand Dialysis and Transplant Registry. Am J Kidney Dis. 1995 Jan;25(1):165-75.
11)Barrett BJ: Acetaminophen and adverse chronic renal outcomes: an appraisal of the epidemiologic evidence. Am J Kidney Dis. 1996 Jul;28(1 Suppl 1):S14-9.
12)Sandler DP1, Smith JC, Weinberg CR, Buckalew VM Jr, Dennis VW, Blythe WB, Burgess WP: Analgesic use and chronic renal disease. N Engl J Med. 1989 May 11;320(19):1238-43.
13)Perneger TV1, Whelton PK, Klag MJ: Risk of kidney failure associated with the use of acetaminophen, aspirin, and nonsteroidal antiinflammatory drugs. N Engl J Med. 1994 Dec 22;331(25):1675-9.
14)Porter GA: Acetaminophen/aspirin mixtures: experimental data. m J Kidney Dis. 1996 Jul;28(1 Suppl 1):S30-3.
薬剤師サロン メール問合せより~CHDF時の抗菌薬投与~
【 問い合わせ内容 】
医師からの問い合わせが多く、よく困っているのがCHDF(continuous hemodiafiltration)持続的血液透析濾過)の患者の抗菌薬、特にバンコマイシンの投与量に関してです。メーカーに問い合わせをしたり、他にいろいろ調べたりしていますが、的確な回答が出来ていない現状があります。条件によって、大きな差がでてくるので一概に「この投与量を推奨します」というのは難しいと思いますが、CHDF患者の抗菌薬の投与量はサンフォードのCRRTの用量を用いればいいのでしょうか?あるいは無尿の患者であれば透析患者と同じで用量でよいのでしょうか?
【 回 答 】
透析クリアランスはCCr5~10mL/minの患者と同等
おっしゃる通り、CHDFの場合、施行条件によって、薬物除去率に大きな差がでてくるので一定の薬物投与量を提示することは困難です。米国など血流量100~150mL/minでやっている場合もあり(表1)、そんなデータを引用しては抗菌薬の除去率を過大評価し、過量投与の原因になります。
表1.血液透析とCHDFの施行条件の日本と海外の差
|
血流量(mL/min) |
透析液流量(mL/min) |
置換液流量(mL/min) |
透析時間 |
ダイアライザーの膜面積 |
||
|
血液透析HD |
日本 |
200 |
500 |
0 |
4hr×3回/週 |
大きい |
|
海外 |
360 |
700 |
0 |
4hr×3回/週 |
大きい |
|
|
持続的血液透析濾過CHDF |
日本 |
80~120 |
7~10 |
5~8 |
24hr以上 |
小さい |
|
海外 |
140~150 |
14~24 |
14~24 |
24hr以上 |
小さい |
血液透析(HD)は透析液流量よりも血流量が低いため、より小さい方のクリアランス以上は得られないので、血流量がHDクリアランスを決定する最も大きな要因になります。小分子量物質のHDクリアランスは血流量と相関します。通常の透析では分子量113と非常に小さいクレアチニンで200mL/minの血流量で回した場合、150mL/min程度のクリアランスになり、分子量がもっと小さい尿素(MW60)のHDクリアランスは180mL/min程度のクリアランスが得られます。ただし週に4時間×3回しか稼働しないため、尿素クリアランスは12.8mL/min、CCrは10.7mL/minと計算されますが、一般的な薬物の分子量は200dalton以上で、ある程度のタンパク結合を考慮すると、5~10mL/min程度のクリアランスしかないと考えられます。実際、透析患者の至適投与量はCCr10mL/min未満の患者と同じとされています。
CHDFクリアランスは無尿患者でサブラッド20L/日仕様の場合、CCr14mL/minの患者と同様
CHDF時の薬物の血液浄化法による抗菌薬の除去については、さまざまな文献がありますが、それぞれ血液浄化方法が異なり、一律にまとめることができません。欧米では透析液流量+置換液流量が20~40mL/minと日本よりもかなり高い条件で24時間以上の持続的血液透析(CHD)、CHF(持続的血液濾過)、CHDF(持続的透析濾過;これらを総称してCRRT:持続的腎代替療法 continuous renal replacement therapyと言います)が行われることがあり、末期腎不全患者であっても血清Cr値が3mg/dL未満に保たれており、βラクタム系の抗菌薬などはほとんど減量の必要がないこともあります。しかし日本のCHDFは海外に比し血流量、透析液流量ともかなり低めですので(表)、海外の文献データの至適投与量を用いると過量投与になってしまいます。ただしやサンフォードガイドではバンコマイシンのCRRTの至適用量は500mgを24~48時間毎と少な目の投与量になっており、意外と日本のCHDFに適しています。ちなみに日本化学療法学会の抗菌薬TDMガイドライン2015では「CHDF患者に初回は25-30 mg/kg(実測体重)を投与し、以降の維持量は1回500 mg(7.5-10 mg/kg)を24時間毎に投与し、適宜TDMで調節する」となっており、ほぼサンフォードガイドよりも多めの投与量が推奨されています。
またCHDFは急性膵炎など腎機能正常者に対して炎症性サイトカインを吸着除去するために行われることもあるため、常用量以上の投与量が必要なこともあります。ただし使用している置換液(サブラッドⓇBなど商品名が違っていてもOK)の量とCHDFクリアランスはほぼ一致します。20L/日なら例えば20L/日(約14mL/min)のCCrになります。なぜならサブラッドⓇを使って補液しているということは補液した量とほぼ同じかそれ以上の限外濾液量が出てきます。その限外濾液中Cr濃度は血清Cr濃度と等しいからです。血清中でCrは血漿タンパクと全く結合していない小分子量物質だから当然ですね。
それからサブラッドⓇの一部は透析液としても使いますが、日本のHDの透析液流量は500mL/minですが、CHDFの透析液流量ははるかに少ない量(7~10mL/min)なので、透析液廃液中Cr濃度と血清Cr濃度は等しくなります。ということは透析液と補液(併せて総廃液量)として1日20L使っていればクレアチニンに関しては1日当たり血清20Lを完全に浄化しているということになりますので20L/日(14mL/min)がCCrになります。ということはHDよりもCHDFのほうがクリアランスが高いため、薬物除去率も高く、抗菌薬もHD患者よりも多めの投与量が必要になります。ただし輸液スペースを確保し、溢水を防ぐため総廃液量が22LになるようなCHDFを施行すると22L/日(15.3mL/min)がCHDFクリアランスになります。つまりCHDFをやっている患者さんが無尿で腎機能が全くなかったとしてもCHDFがCCr14~15mL/minの保存期腎不全患者さんの腎機能と同じ腎機能を肩代わりしてくれているということになります。
投与設計ではCHDF患者の腎機能も考慮する
ということはCHDFによるCCrは14~15mL/minになり、その人が無尿であればCCrが14~15mL/minの人と同じ投与量をすればよいことになります。しかし患者の腎機能が無尿ではなく20mL/minであれば、34~35mL/minの保存期CKD患者と同じ投与量にすればよいということになります。つまりシミュレーションは非常に簡単で、無尿の患者さんで除水をしなければシミュレーションソフトの患者の腎機能にCCr14mL/minを代入すればよいわけです。ただし患者に残腎機能が残っておればそれを足せばよいのです。患者の腎機能が16mL/minであればこの人の腎機能はCHDFをやっている間は14+16mL/minで30mL/minにクリランスがアップしていると考えればよいのですからCCrが30mL/minの人と同じ投与量をすればよいことになります。
このようにCHDFのクリアランスを予測することはサブラッドⓇの使用量が分かれば簡単です。もしもCHDF患者がずっと同じメニューのCHDFをやっていて、患者の腎機能が安定しており、4~5日経過していれば患者の血清クレアチニン値は定常状態になっているためeGFRを算出して、あるいはCockcroft-Gault式からCCrを算出して、その値をシミュレーションソフトの意腎機能に入力してみても大過ないと思われます。
患者の腎機能の変動には要注意
ただしCHDFをやっている人の腎機能は容易に変動するからそう簡単にはいかないというのは確かです。その場合は最初の腎機能に応じた投与量にして予測血中抗菌薬濃度よりも高くなっていれば減量し、予測血中抗菌薬濃度よりも低くなっていれば増量するなどで試行錯誤するしかありませんが、腎機能が安定すれば、その時の至適投与量に当てはまる腎機能からCHDFクリアランス14mL/minを差し引いたものがこの患者の腎機能と予測されます。
CHDF施行時の薬物投与量については腎臓病薬物療法専門薬剤師テキストに古久保先生1)が書いていますし、山本武人先生2)がより詳しい総説を書いており、私も総説を最近書きました3)ので参考にしてください。
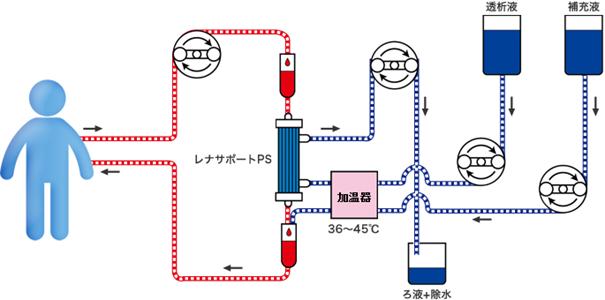
図1.CHDFの方法
CHDFクリアランスは に規定されます。透析液流量は非常に小さいため、透析液の廃液中薬物濃度は血中遊離型薬物濃度と近似し、限外濾液濾液中薬物濃度も血中遊離型薬物濃度と近似するためです。
まとめ
①CHDFのクリアランスはHDクリアランスより小さいがHDは週に12時間しか施行しないためトータルで見るとCHDFクリアランス(サブラッドⓇBを20L/minを使用した場合には14mL/min)はHDクリアランス(通常5~10mL/min)よりも高いため、透析患者の至適投与量では投与量不足になります。
②海外のCHDF(厳密にいうと国によって持続的血液浄化法CRRTのやり方は異なる)は日本に比べクリアランスが大きいため、海外文献やサンフォードガイドを参考にすると日本のCHDF患者では過量投与になります。
③通常、日本では1日20Lの補液が使われているということは患者が無尿で除水も行っていなければ20L/日、つまり14mL/minのCCrの保存期腎不全患者への至適投与量と同じ投与量にすればよいのです。残腎機能があればその腎機能に14mL/minを加えたものがCHDF施行中の患者の腎機能としてシミュレーションソフトに代入してもよいです。
④抗菌薬のタンパク結合率が90%以上と高い、あるいは分布容積が2L/kg以上と大きければ血液透析HDでは除去できません。しかしCHDFでは組織に分布した薬物がゆっくりと除去される可能性があるため、分布容積が2L/kg前後の薬物でも除去される可能性があるかもしれませんが、タンパク結合率が90%以上と高い薬物はやはり除去できません。
参考文献
1)山本武人, 他: CRRT中の薬物投与量 抗菌薬の投与設計を中心として. INTNSIVIST 2: 329-345, 2010
2)古久保 拓: 透析患者の薬物投与設計⑤透析方法による薬物除去の違い. 腎臓病薬物療法専門・認定薬剤師テキストP219-225, じほう, 東京, 2013
3)平田純生: 急性血液浄化施行中の投薬管理. 急性血液浄化法徹底ガイド第3版, 救急・集中治療 26(3, 4): 471-479, 2014

